Sekukinumab z pohledu farmakoekonomiky a nákladové efektivity
Souhrn:
Skoupá J. Sekukinumab z pohledu farmakoekonomiky a nákladové efektivity. Remedia 2020; 30: 159–163.
Článek se zabývá hodnocením nákladové efektivity sekukinumabu ve schválených indikacích ‒ u psoriázy, psoriatické artritidy a ankylozující spondylitidy. Od roku 2008 jsou nedílnou součástí žádostí o stanovení ceny a úhrady nového léku i ekonomické analýzy, které zahrnují analýzu nákladové efektivity a analýzu dopadu do rozpočtu. Přehled se zaměřuje zejména na výsledky v České republice, neboť jsou relevantní pro rozhodnutí o případné úhradě, uvedeny jsou i výsledky některých zahraničních analýz. Sekukinumab v lokálních farmakoekonomických analýzách prokázal, že je nákladově efektivní (nákladnější a účinnější) nebo dominantní (méně nákladný a účinnější) technologií v porovnání s aktuálně běžně používanými biologickými léčivy.
Summary:
Skoupa J. Secukinumab from a point of view of pharmacoeconomics and cost efficiency. Remedia 2020; 30: 159–163.
The article focuses on cost‑effectiveness of secukinumab in the approved indications – psoriasis, psoriatic arthritis and ankylosing spondylitis. Since 2008, economic analyses, i.e., cost‑effectiveness and budget impact, are mandatory elements of price and reimbursement applications. The overview focuses on results from the Czech Republic environment, as those are relevant for a coverage decision. Results from international analyses are mentioned in addition to that. Based on results of local pharmacoeconomic analyses, secukinumab seems to be a cost‑effective (more costly but more effective) or dominant (less costly and more effective) technology in comparison with the currently used biologics.
Key words: pharmacoeconomy, cost‑effectiveness, secukinumab, psoriasis, psoriatic arthritis, ankylosing spondylitis
Úvod
Sekukinumab je plně humánní IgG1/κ monoklonální protilátka, která se selektivně váže na prozánětlivý cytokin interleukin 17A (IL 17A) a neutralizuje ho. Sekukinumab tedy přímo cílí na IL 17A, přičemž inhibuje interakci s receptorem pro IL 17. Receptor pro IL 17 je exprimován různými typy buněk včetně keratinocytů a výsledkem interakce je inhibice uvolňování prozánětlivých látek (cytokinů a chemokinů) a mediátorů tkáňového poškození [1].
Interleukin 17A je přirozeně se vyskytující cytokin, který se účastní normální zánětlivé a imunitní odpovědi a hraje klíčovou roli v patogenezi ložiskové psoriázy, psoriatické artritidy a ankylozující spondylitidy. Jeho množství je zvýšeno v kožních lézích v porovnání s pokožkou bez kožních lézí u pacientů s ložiskovou psoriázou a v synoviální tekutině pacientů s psoriatickou artritidou. Četnost výskytu buněk produkujících IL 17 byla též významně vyšší v subchondrální kostní dřeni intervertebrálních kloubů u pacientů s ankylozující spondylitidou [1].
Podrobný popis mechanismu účinku sekukinumabu a klíčové studie s touto látkou byly publikovány v časopise Remedia již dříve [2]. První ze schválených indikací byla středně těžká až těžká ložisková psoriáza u dospělých pacientů. Jednalo se tak o druhý přípravek biologické terapie (po ustekinumabu), který měl v této indikaci jiný mechanismus účinku než standardně používané protilátky proti tumor nekrotizujícímu faktoru alfa (anti TNFα). V současné době je sekukinumab indikován kromě ložiskové psoriázy i u psoriatické artritidy a ankylozující spondylitidy [1] a v těchto indikacích je také přípravek Cosentyx hrazen z veřejného zdravotního pojištění.
Od roku 2008 jsou nedílnou součástí žádostí o stanovení ceny a úhrady i ekonomické analýzy. Ty zahrnují analýzu nákladové efektivity a analýzu dopadu do rozpočtu. Analýza dopadu do rozpočtu kalkuluje, jak zavedení nového léčivého přípravku ovlivní náklady zdravotních pojišťoven, tedy zda dojde k navýšení (což je u nových přípravků obvyklé), nebo zda zdravotní pojišťovny ušetří (obvykle tato situace nastává, pokud na trh vstupuje generikum nebo biosimilární přípravek). Analýza nákladové efektivity hodnotí přínosy oproti nákladům a kalkuluje inkrement nákladů oproti inkrementu přínosů (tzv. ICER – incremental cost effectiveness ratio), vždy v porovnání se současným stavem. Náklady nezahrnují pouze vlastní technologii (tedy v tomto případě náklady na léčivý přípravek), ale zohledněna je například i následná léčba, hospitalizace, management onemocnění a případných toxicit. Aby bylo možné přínosy jednotlivých technologií porovnávat mezi medicínskými obory, nejsou přínosy vyjádřeny v klinických jednotkách (např. v počtu zlomenin, kardiovaskulárních příhod a jiných), ale v tzv. QALY (quality adjusted life years). Metoda QALY představuje ukazatel, který kombinuje délku dožití (čím déle pacient žije, tím více QALY vytváří) a kvalitu dožití (pacienti v lepším zdravotním stavu mají lepší kvalitu života než nemocní v horším zdravotním stavu). Výsledek – prezentovaný jako ICER/QALY – tedy vyjadřuje, kolik nákladů je třeba při použití nové technologie vynaložit „navíc“ proti současnému standardu na získání dalšího jednoho roku života v plné kvalitě. Z výše uvedeného je zřejmé, že nákladová efektivita vždy porovnává nejméně dvě technologie, a výsledný ICER/QALY je tudíž relativní hodnotou vyjadřující změnu oproti současnému stavu. Analýza nákladové efektivity tedy předpokládá, že určitá technologie (v tomto případě farmakoterapie) je investicí, jejíž přínosy (delší dožití, lepší kvalita života nebo obojí) se projeví až následně v čase. Proto tyto typy ekonomických analýz obvykle uvažují dlouhodobý až celoživotní časový horizont. Výchozí klinické studie s danou technologií však zřídka (pokud se nejedná o intervence u pokročilých onkologických onemocnění) pokrývají celoživotní horizont léčeného. Proto musejí být krátkodobé výstupy z klinických studií kombinovány s jinými zdroji (např. s dlouhodobými registry pro dané onemocnění) za použití různých statistických validovaných metod a modelování. Výsledek analýzy nákladové efektivity (tedy ICER/QALY) představuje, jak bylo uvedeno výše, finanční hodnotu v Kč, kterou je třeba vynaložit na získaný rok života v plné kvalitě. Jednotlivé zdravotní systémy si musejí zvolit hranici, kterou jsou ochotny za daný přínos zaplatit. Tato hranice se nazývá „hranice ochoty platit“ (willingness to pay) a její výše se kromě jiného odvíjí od ekonomické výkonnosti jednotlivých států. V České republice byla tato hodnota stanovena na 1,2 milionu korun. To znamená, že intervence s výsledkem ICER/QALY méně než 1,2 milionu Kč jsou považovány za nákladově efektivní, intervence přesahující tuto částku za QALY nejsou z pohledu českého zdravotního systému nákladově efektivní, a neměly by tedy být z veřejných prostředků hrazeny.
Tento článek se zabývá hodnocením nákladové efektivity sekukinumabu ve schválených indikacích. Zaměřuje se zejména na výsledky v České republice, neboť ty jsou relevantní pro rozhodnutí o případné úhradě, nicméně přehledně uvádíme i výsledky některých zahraničních analýz.
Psoriáza u dospělých
Jedna ze studií v indikaci
psoriáza, konkrétně studie CLEAR, hodnotila účinnost
a bezpečnost sekukinumabu v porovnání s ustekinumabem
[3,4]. Cílem studie bylo prokázat superioritu sekukinumabu
v parametru odpovědi PASI 90 (Psoriasis Area and Severity
Index – zlepšení o 90 % v tomto případě)
v 16. týdnu od zahájení léčby a dále
v 52. týdnu terapie. Držitel registrace zdůvodnil svoji
žádost o stanovení výše a podmínek úhrady právě
závěry studie CLEAR. V té době byl kromě léků ze skupiny
anti TNFα hrazen i ustekinumab, který představoval
srovnávanou léčbu. Úhrada další terapie je u všech
léčivých přípravků po indukci vázána na dosažení
odpovědi PASI 50 (zlepšení o 50 %) v 16. týdnu
terapie. V analýze nákladové efektivity bylo pro sekukinumab
předpokládáno striktnější kritérium účinnosti, a to
dosažení odpovědi PASI 75 (zlepšení o 75 %) a PASI
50 pro ustekinumab (v souladu s definicí respondéra podle
indikačního omezení). Kohorta pacientů vstupující
do farmakoekonomického modelu byla léčena buď sekukinumabem,
nebo ustekinumabem, a pokud v 16. týdnu dosáhla
požadovaných cílových parametrů PASI, pokračovala v léčbě
dlouhodobě. Pokud cíle nebylo dosaženo, přešla kohorta (resp.
odpovídající část) na konvenční, nebiologickou terapii
[5]. Schéma modelu je uvedeno na obrázku 1.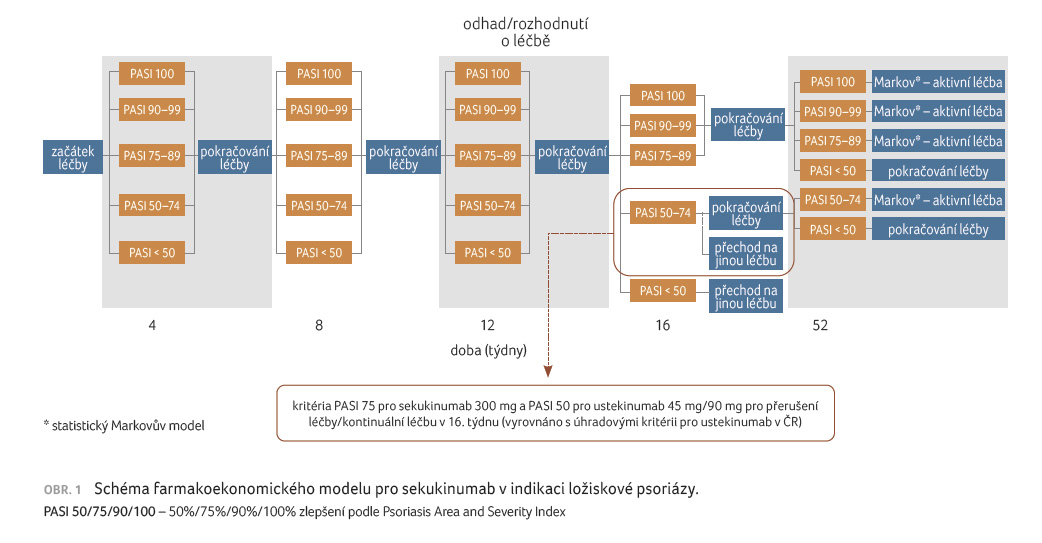
Při porovnatelných nákladech na léčbu sekukinumabem a ustekinumabem byl zisk QALY v případě sekukinumabu vyšší (vyšší podíl pacientů byl ve stavu PASI 90 spojeném s vyšší kvalitou života). Tím se sekukinumab v této indikaci ukázal jako nákladově efektivní a získal úhradu.
Obdobný model byl použit i pro hodnocení nákladové efektivity v Itálii. Kritériem pro pokračování terapie po 16. týdnu indukce bylo dosažení PASI 75. Sekukinumab byl porovnáván nejen s ustekinumabem, ale i s ostatními indikovanými přípravky ze skupiny anti TNFα (infliximab, adalimumab a etanercept) [6]. Navzdory mírně vyšším celkovým nákladům na sekukinumab byl v horizontu analýzy zisk QALY vyšší. Sekukinumab tedy oproti všem uvažovaným komparátorům prokázal nákladovou efektivitu.
Další zajímavá a přínosná publikace reflektuje zdravotní systém Spojených států amerických [7]. Přínos této ekonomické analýzy spatřujeme v zahrnutí veškeré dostupné moderní terapie, a to anti TNFα (infliximab, adalimumab a etanercept), inhibitoru fosfodiesterázy 4 (PDE4; apremilast), inhibitoru IL 12/23 (ustekinumab) a inhibitorů IL 17 (sekukinumab, ixekizumab a brodalumab). Aktivní léčba byla porovnávana i se stavem bez terapie. Z důvodu absence přímého srovnání jednotlivých látek byla účinnost odvozena z publikované síťové metaanalýzy [8]. Pacienti léčení výše uvedenými látkami vstoupili do modelu, a pokud na konci indukce dosáhli cílového zlepšení (definovaného jako PASI 75), pokračovali v této terapii dále. Pokud nebylo dosaženo PASI 75, byla léčba změněna na jiný přípravek cílené terapie nebo byla ukončena. V horizontu analýzy, který byl desetiletý, bylo nejvyššího zisku QALY dosaženo u inhibitorů IL 17, tento typ terapie byl však i nejnákladnější. Autoři nakonec analyzovali, která iniciální léčba je nákladově nejefektivnější, a to při nižší hranici ochoty platit (v poměrech USA 100 000 dolarů/QALY) a při vyšší hranici (150 000 dolarů/QALY). V případě nižší hranice ochoty platit bylo z pohledu čistých peněžních výnosů (net monetary benefits) nejvýhodnější zahájit léčbu první linie apremilastem nebo infliximabem. V případě vyšší hranice ochoty platit přináší zahájení léčby inhibitory IL 17 nejvyšší čistý peněžní výnos.
Spondyloartritidy (ankylozující spondylitida a psoriatická artritida)
U spondyloartritid je sekukinumab
v České republice hrazen od 1. 3. 2017. I pro
tyto indikace bylo pro získání úhrady třeba předložit analýzu
nákladové efektivity, která zahrnovala pacienty dosud neléčené
biologickou léčbou anebo pacienty po jejím selhání.
Klinická data pro ankylozující spondylitidu vycházela z ročních
studií MEASURE 1 a MEASURE 2 [9], data pro psoriatickou
artritidu ze studií FUTURE 1 a FUTURE 2 [10,11]. U obou
spondyloartritid se jednalo o placebem kontrolované studie,
proto muselo být provedeno nepřímé srovnání s anti TNFα
přípravky, jež byly komparativní léčbou v ekonomické
analýze. Použitý farmakoekonomický model, který je shodný pro
obě indikace, je znázorněn na obrázku 2.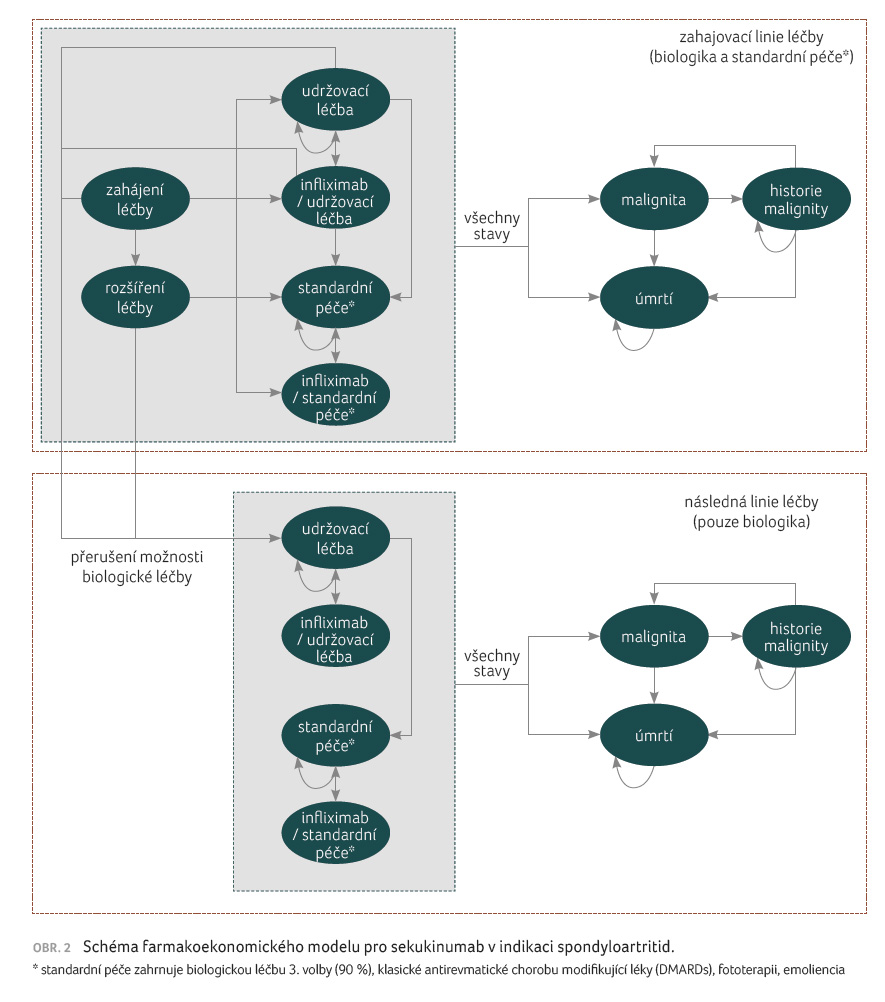
Pacienti vstupují do modelu a jsou léčeni buď sekukinumabem, nebo některým z uvažovaných anti TNFα přípravků. Po úvodních třech měsících je hodnocena léčebná odpověď (BASDAI 50 [Bath Ankylosing Spondylitis Disease Activity Index] u ankylozující spondylitidy nebo PsARC [Psoriatic Arthritis Response Criteria] u psoriatické artritidy). V případě dosažení léčebné odpovědi pacienti pokračují v zavedené terapii, v případě nedosažení cílových parametrů přecházejí na jinou biologickou léčbu v procentuálním zastoupení přípravků podle českého registru ATTRA. K přechodu na další biologickou léčbu dochází i při sekundárním selhání terapie nebo při ukončení podávání prvního biologického léku z jakékoliv jiné příčiny. V modelu byly z pohledu nákladů a kvality života zohledněny i závažné infekce (včetně tuberkulózy) a výskyt malignit.
V době, kdy Státní ústav pro kontrolu léčiv (SÚKL) hodnotil nákladovou efektivitu sekukinumabu, byly náklady na sekukinumab a anti TNFα terapii obdobné. Sekukinumab je navíc u spondyloartritid podáván v nižší dávce než u psoriázy s výjimkou pacientů s psoriatickou artritidou, u nichž již došlo k selhání jiné biologické léčby.
Sekukinumab byl v léčbě ankylozující spondylitidy u biologicky naivní (tedy biologikem dosud neléčené) populace s psoriatickou artritidou účinnější a méně nákladný než anti TNFα (tedy byl tzv. dominantní technologií). Pro pacienty již léčené biologikem pro psoriatickou artritidu byl sekukinumab nákladově efektivní s výsledným ICER/QALY pod hranicí ochoty platit ve výši 1,2 milionu korun.
Velmi obdobné výsledky byly zaznamenány pro hodnocení spondyloartritid i v zahraničí. Finská publikace uvádí nákladovou efektivitu pro sekukinumab vs. relevantní komparátory (anti TNFα včetně biosimilárního adalimumabu a etanerceptu, apremilast a ustekinumab) [12]. Farmakoekonomický model byl postaven na identických principech jako model použitý v České republice. Autoři zjistili, že sekukinumab je v této indikaci dominantní (účinnější a méně nákladný) v porovnání s většinou ostatních biologických léčiv s výjimkou biosimilars, oproti nimž je vysoce nákladově efektivní (účinnější a mírně nákladnější).
K dispozici je kanadská analýza u psoriatické artritidy, která nezahrnuje pouze zdravotní náklady, ale i náklady sociální (např. invalidizaci nebo pracovní neschopnost) [13]. Výsledky jsou obdobné s výše uvedenými. Sociální náklady, které v českých podmínkách nejsou standardně v analýzách zahrnuty, jsou v případě spondyloartritid závažné a z celkových ročních nákladů představují podle literárních zdrojů 52‒72 % [14]. Vysoké sociální náklady jsou dány tím, že většina populace se spondyloartritidami je mladší a v produktivním věku.
Závěr
Sekukinumab v lokálních farmakoekonomických studiích prokázal, že je nákladově efektivní (nákladnější a účinnější) nebo dominantní (méně nákladný a účinnější) technologií v porovnání s tč. běžně používanými biologickými léčivy. V tomto případě (a není tomu vždy tak) jsou české výsledky srovnatelné se zahraničními analýzami. Je však nutné si uvědomit, že výsledky zahraničních farmakoekonomických analýz nejsou automaticky aplikovatelné na české prostředí. Důvodem je odlišná organizace zdravotní péče a zejména odlišné náklady, a to nejen farmakoterapie, ale i výkonů a hospitalizace. Za určité negativum v českém hodnocení zdravotnických technologií lze považovat zahrnutí pouze zdravotních nákladů do analýz. Specificky v případě psoriázy a spondyloartritid tvoří sociální náklady s ohledem na věk nemocných značnou část (více než polovinu) celkových ročních nákladů, které však nejsou v lokálních farmakoekonomických analýzách zohledněny.
Seznam použité literatury
- [1] SPC Cosentyx. Dostupné na: https://www.ema.europa.eu/en/docu-
- [2] Forejtová Š. Secukinumab v nových revmatologických indikacích. Remedia 2016; 26: 516–520.
- [3] Thaçi D, Blauvelt A, Reich K, et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate ro severe plaque psoriasis: CLEAR, a randomized controlled trial. J Am Acad Dermatol 2015; 73: 400‒409.
- [4] Blauvelt A, Reich K, Tsai TF, et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate‑to‑severe plaque psoriasis up to 1 year: Results from the CLEAR study. J Am Acad Dermatol 2017; 76: 60–69.
- [5] Klimes J, Mollon P, Graham C, et al. Cost‑effectiveness analysis of secukinumab compared to ustekinumab in the treatment of moderate to severe plaque psoriasis in the Czech Republic. Poster (PSS51) presented at the 2015 ISPOR 18th Annual European Congress; November 2015. Milan, Italy.
- [6] DʼAusilio A, Aiello A, Daniel F, et al. A cost‑effectiveness analysis of secukinumab 300 mg vs current therapies for the treatment of moderate to severe plaque psoriasis in Italy. Poster (PSS50) presented at the 2015 ISPOR 18th Annual European Congress; November 2015. Milan, Italy.
- [7] Hendrix N, Ollendorf DA, Chapman RH, et al. Cost‑Effectiveness of Targeted Pharmacotherapy for Moderate to Severe Plaque Psoriasis. Manag Care Spec Pharm 2018; 24: 1210‒1217.
- [8] Loos AM, Liu S, Segel C, et al. Comparative effectiveness of targeted immunomodulators for the treatment of moderate‑to‑severe plaque psoriasis: A systematic review and network meta‑analysis. J Am Acad Dermatol 2018; 79: 135–144.
- [9] Baeten D, Sieper J, Braun J, et al. Secukinumab, an Interleukin‑17A Inhibitor, in Ankylosing Spondylitis. N Engl J Med 2015; 373: 2534‒2548.
- [10] Mease PJ, McInnes IB, Kirkham B, et al. Secukinumab Inhibition of Interleukin‑17A in Patients with Psoriatic Arthritis. N Engl J Med 2015; 373: 1329‒1339.
- [11] McInnes IB, Mease PJ, Kirkham B, et al. Secukinumab, a human anti‑interleukin‑17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet 2015; 386: 1114‒1116.
- [12] Purmonen T, Puolakka K, Bhattacharyya D, et al. Cost‑effectiveness analysis of secukinumab versus other biologics and apremilast in the treatment of active Psoriatic arthritis: a Finnish perspective. Cost Eff Resour Alloc 2018; 16: 56‒66.
- [13] Goeree R, Chiva‑Razavi S, Gunda P, et al. Cost‑effectiveness analysis of secukinumab for the treatment of active psoriatic arthritis: a Canadian perspective. J Med Econom 2018; 21: 163‒173.
- [14] Lee S, Mendelsohn A, Sarnes E. The burden of psoriatic arthritis: a literature review from a global health systems perspective. P T 2010; 35: 680‒689.