Siltuximab a jeho léčebné využití u mnohočetného myelomu
Souhrn:
Sandecká V. Siltuximab a jeho léčebné využití u mnohočetného myelomu. Remedia 2021; 31: 480–485.
Siltuximab je monoklonální chimérická IgG protilátka zaměřená proti interleukinu 6 (IL‑6). Klinická hodnocení prokázala významnou účinnost a dobrou toleranci siltuximabu u pacientů s multicentrickou formou Castlemanovy choroby. Americký Úřad pro kontrolu potravin a léčiv (FDA) a následně Evropská léková agentura (EMA) schválily siltuximab k léčbě dospělých pacientů s Castlemanovou chorobou, kteří jsou negativní na lidský virus imunodeficience a na lidský herpesvirus 8. V současnosti probíhají klinická hodnocení se siltuximabem také u jiných hematologických malignit včetně mnohočetného myelomu, myelodysplastického syndromu a non‑Hodgkinových lymfomů. Tento článek přináší detailní pohled na anti‑IL‑6 monoklonální protilátku siltuximab a jeho postavení v léčbě mnohočetného myelomu.
Summary:
Sandecka V. Siltuximab and its treatment use in multiple myeloma Remedia 2021; 31: 480–485.
Siltuximab is a monoclonal chimeric IgG antibody targeted at interleukin 6 (IL‑6). Clinical evaluations demonstrated significant efficacy and good tolerance of siltuximab in patients with a multicentric form of Castleman disease. American Food and Drug Administration (FDA) and subsequently European Medicines Agency (EMA) approved siltuximab to treat adult patients with Castleman disease negative for human immunodeficiency virus and human herpesvirus 8. Clinical studies with siltuximab are currently underway in other hematological malignancies, including multiple myeloma, myelodysplastic syndrome, and non‑Hodgkin lymphoma. This article brings a detailed perspective on anti‑IL‑6 monoclonal antibody siltuximab and its status in the treatment of multiple myeloma.
Key words: siltuximab, anti‑IL‑6, multiple myeloma.
Úvod
Mnohočetný myelom (MM) patří mezi druhé nejčastější krevní nádorové onemocnění, které je způsobeno maligní transformací B lymfocytů, jejich klonální proliferací a akumulací terminálních vývojových stadií plazmocytů − myelomových buněk v kostní dřeni [1]. Jedná se o onemocnění vyššího věku s mediánem výskytu kolem 70 let u žen a 68 let u mužů [2]. Pro nově diagnostikované pacienty s MM, u nichž nebylo vhodné podání vysokodávkované chemoterapie s autologní transplantací kmenových buněk (autologous stem cell transplantation, ASCT), byl donedávna zlatým standardem léčby režim VMP (bortezomib, melfalan, prednison) [3]. V posledních letech se paradigmata léčby velmi dramaticky mění, a to díky zavedení nových léků a jejich kombinací, jako jsou inhibitory proteazomů (bortezomib, ixazomib, karfilzomib), imunomodulační léky (thalidomid, lenalidomid, pomalidomid) a imunoterapie v čele s monoklonálními protilátkami (daratumumab, elotuzumab, isatuximab). Díky novým léčebným možnostem se z nevyléčitelného MM s průměrným přežíváním tři roky stává chronické onemocnění s očekávaným přežíváním 10 a více let [4,5]. V tomto sdělení se budeme věnovat siltuximabu, který byl schválen americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) a Evropskou lékovou agenturou (European Medicines Agency, EMA) v indikaci léčby multicentrické formy Castlemanovy choroby [6]. Účinnost a bezpečnost siltuximabu u jiných hematologických nádorových onemocnění včetně MM je zatím ověřována v klinických studiích. V tomto sdělení přinášíme jejich přehled.
Fyziologická aktivita interleukinu 6
Interleukin 6 (IL 6) představuje
pleiotropní prozánětlivý cytokin produkovaný různými typy
buněk (T a B lymfocyty, monocyty, fibroblasty i maligními
buňkami), který se uplatňuje při imunitní odpovědi (podílí se
na indukci sekrece imunoglobulinů), reakcích akutní fáze
(podporuje jaterní syntézu proteinů akutní fáze), hematopoeze
(stimuluje proliferaci a diferenciaci hematopoetických buněk)
a v kostním metabolismu [7]. Zvýšená hodnota IL 6
ve spojení se zvýšenou syntézou dalších cytokinů v krvi
může nastat u mnoha infekčních, zánětlivých,
autoimunitních a nádorových onemocnění [8]. Fyziologická
aktivita IL 6 je komplexní a v imunitním systému
vyvolává jak prozánětlivé, tak protizánětlivé účinky (obr. 1) [9].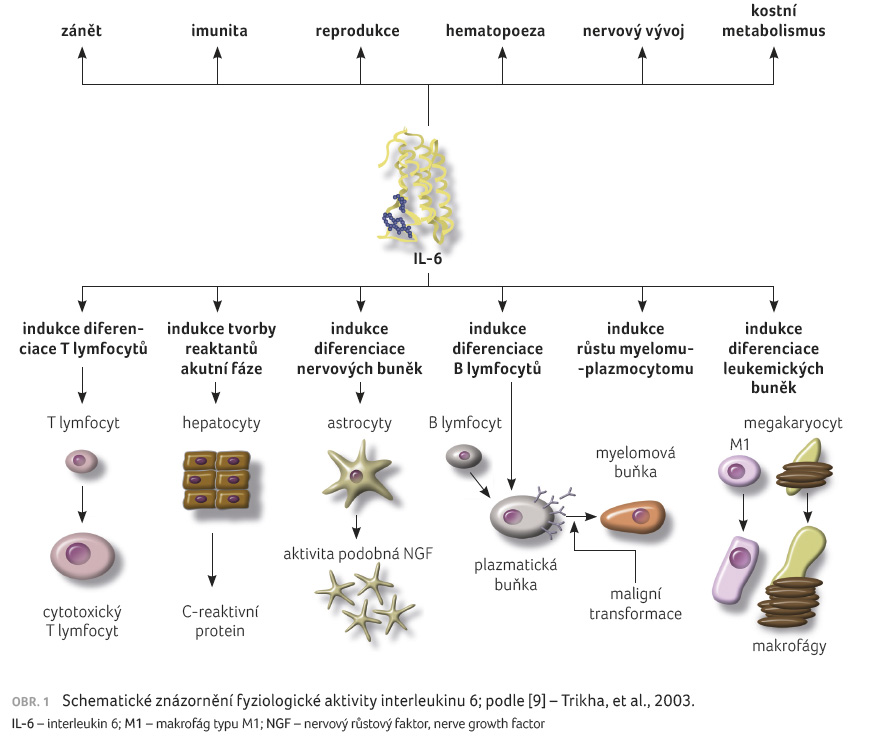
Interleukin 6 moduluje transkripci několika specifických genů během akutních zánětlivých stavů, zejména C reaktivního proteinu (CRP), a kontroluje přežití normálních plazmatických buněk, jak je ukázáno na reaktivní plazmocytóze pomocí monoklonálních protilátek namířených proti IL 6 [10]. Kromě toho je IL 6 in vitro aktivátorem nebo inhibitorem T buněčných reakcí, a to v závislosti na cíli. Tato interakce prozánětlivých a protizánětlivých aktivit ho předurčuje k důležité roli v regulaci fyziologických reakcí na patologický stav [11].
Interakce IL 6 a jeho receptoru
Interleukin 6 je multifunkčním cytokinem, který se váže na specifický receptor IL 6 (IL 6R; řetězec α, IL 6R nebo CD126) na cílových buňkách. Komplex IL 6/IL6 R se spojuje se dvěma molekulami exprimovaného gp130 (β řetězec, CD130), druhého řetězce receptoru, což vede k tvorbě vysoce avidních receptorů vázajících IL 6. Zatímco gp80 se váže specificky na IL 6, gp130 je běžný receptor přenášející signál pro různé cytokiny včetně IL 6, IL 11, onkostatinu M, kardiotropinu 1, neurotropinu 1 a jiných. Po navázání na specifické receptory dochází k iniciaci buněčné signalizace [12]. Na rozdíl od široké distribuce gp130 je gp80 omezen na hepatocyty a specializované podskupiny leukocytů, včetně monocytů, neutrofilů, T lymfocytů a B lymfocytů. Stimulace gp130 je nezbytná pro krvetvorbu in vivo [8].
Systém je komplikován přítomností rozpustných forem jak gp80, tak gp130, které se odštěpují z molekuly buněčné membrány nebo se překládají z alternativní sestřihané jednovláknové RNA [13]. Rozpustný IL 6R (sIL 6R) nebo gp55 si zachovává svoji schopnost vázat IL 6 a vytvořené komplexy jsou schopny aktivovat receptor převodníku gp130. Na rozdíl od jiných rozpustných cytokinových receptorů, které jsou obecně antagonisty, je sIL 6R agonistickou molekulou podporující aktivitu IL 6. Tato schopnost může vysvětlit možnou aktivaci gp130 navzdory nedostatku gp80, pokud molekuly sIL 6R cirkulují ve velkém množství, jak bylo prokázáno v určitých patologických stavech. Buňky, které neexprimují specifické receptory pro IL 6, IL 11 nebo ciliární neurotrofický faktor, nemohou na tyto cytokiny reagovat. Přítomnost sIL 6R způsobuje, že tyto buňky reagují, což je proces nazývaný transsignalizace. Séra od zdravých jedinců obsahují sIL 6R (střední hodnota, 89 ng/ml; rozmezí 17–300 ng/ml). Rozpustný gp130 byl pozorován v lidské plazmě a může vázat rozpustné a na membráně ukotvené komplexy IL 6/IL 6R, takže se jeví jako endogenní antagonista IL 6 [9].
Interleukin 6 se rovněž podílí na hematopoeze jako kofaktor při amplifikaci a diferenciaci kmenových buněk. Časné hematopoetické kmenové buňky exprimují nízké hodnoty receptorů FLT3 a c kit a také receptoru gp130, ale neexprimují IL 6R. Komplexy IL 6/IL 6R jsou proto účinné při amplifikaci a udržování časných progenitorových buněk i jiných cytokinů [14]. Sérové koncentrace sIL 6R odrážejí proliferativní kinetiku kmenových buněk po mobilizaci [15]. Diferenciace různých buněk, včetně mastocytů a kardiomyocytů, je kromě jiných cytokinů též pod kontrolou IL 6 a rodiny gp130 [16].
Interleukin 6 a mnohočetný myelom
Zvýšená produkce IL 6 je asociována s různými chorobnými procesy, včetně Alzheimerovy choroby, poruchy imunity, zánětů, infarktu myokardu, Pagetovy choroby, osteoporózy, solidních nádorů a B lymfoproliferativních stavů (tj. Castlemanovy choroby, některých subtypů lymfomu, chronické lymfatické leukemie a MM) [7,8]. Funkce IL 6 v patogenezi MM již byla popsána v minulosti [17]. Interleukin 6 je nadměrně produkován stromálními buňkami kostní dřeně pacientů s MM. Rozpustný IL 6R hraje roli v patogenezi MM tím, že vytváří komplexy s IL 6, čímž průsobí desetinásobné zvýšení citlivosti buněčných linií závislých na lidském IL 6. Přítomnost vysokých koncentrací sIL 6R v séru pacientů s MM, nezávisle na množství nádorových buněk a stavu onemocnění, naznačuje, že tento cirkulující protein sehrává důležitou roli v patogenezi monoklonální gamapatie [17].
Siltuximab
Farmakodynamika
Siltuximab je chimérická (lidská/myší) monoklonální protilátka IgG1κ, která tvoří vysoce afinitní, stabilní komplexy s rozpustnými bioaktivními formami lidského IL 6. Siltuximab brání vazbě IL 6 na solubilní i membránově vázané IL 6R a inhibuje tvorbu hexamerního signálního komplexu s proteinem gp130 na povrchu buňky [18]. In vitro siltuximab v závislosti na dávce inhiboval růst IL 6 dependentní myší plazmacytomové buněčné linie v reakci na lidský IL 6. Je dobře prokázáno, že IL 6 stimuluje expresi CRP během akutní fáze. Mechanismem účinku siltuximabu je neutralizace bioaktivity IL 6, kterou lze měřit nepřímo supresí CRP. Koncentrace IL 6 v séru nebo plazmě během léčby není vhodným farmakodynamickým markerem, protože komplexy siltuximabem neutralizovaných protilátek proti IL 6 interferují s aktuálními imunologickými metodami kvantifikace IL 6 [19].
Farmakokinetika
Po prvním podání siltuximabu (v rozmezí dávek 0,9−15 mg/kg) se hodnoty plochy pod křivkou koncentrací v čase (AUC) a maximální koncentrace v séru (cmax) zvyšovaly úměrně dávce a hodnota clearance byla nezávislá na dávce. Po jednorázovém podání dávky při doporučeném dávkovacím režimu (dávka 11 mg/kg podaná jednou za tři týdny) činila hodnota clearance 3,54 ± 0,44 ml/kg/den a biologický poločas činil 16,3 ± 4,2 dne. Po opakovaném podávání doporučených dávek byla zjištěna časově neměnná clearance siltuximabu a středně vysoká systémová kumulace (kumulační index 1,7). V souladu s biologickým poločasem po podání první dávky bylo dosaženo rovnovážného stavu sérové koncentrace do šesté infuze (interval každé tři týdny) s průměrnou (± směrodatná odchylka) maximální a minimální koncentrací 332 ± 139 μg/ml, resp. 84 ± 66 μg/ml [20]. Hodnota clearance siltuximabu se zvyšovala se stoupající tělesnou hmotností, nicméně není nutná žádná úprava dávkování podle tělesné hmotnosti, protože podání je dáno na základě hodnoty mg/kg. Následující faktory neměly žádný klinický účinek na clearance siltuximabu: pohlaví, věk a etnický původ. Vliv tvorby protilátek proti siltuximabu nebyl zkoumán, protože nebyl k dispozici dostatečný počet pacientů pozitivních na protilátky proti siltuximabu. Byla analyzována populační farmakokinetika (FK) siltuximabu k vyhodnocení vlivu demografických charakteristik. Výsledky neprokázaly žádný významný rozdíl ve FK siltuximabu u pacientů starších než 65 let v porovnání s pacienty ve věku 65 let nebo mladšími. Nebyly provedeny žádné formální studie, které by hodnotily vliv poškození ledvin na FK siltuximabu. U pacientů s výchozí vypočtenou clearance kreatininu 12 ml/min nebo vyšší nebyl pozorován žádný významný vliv na FK siltuximabu. Do datového souboru byli zahrnuti čtyři pacienti se závažným postižením ledvin (clearance kreatininu 12−30 ml/min).
Nebyly provedeny žádné formální studie, které by hodnotily vliv poškození jater na FK siltuximabu. U pacientů s výchozí hodnotou alaninaminotransferázy odpovídající až 3,7násobku horní hranice normálu, výchozí hodnotou albuminu od 15 do 58 g/l a výchozí hodnotou bilirubinu od 1,7 do 42,8 mg/dl nebyl pozorován žádný významný vliv na FK siltuximabu. Interleukin 6 snižuje aktivitu cytochromu P450 (CYP450), v důsledku vazby siltuximabu na IL 6 tak může dojít ke zvýšení metabolismu substrátů CYP450. Při zahájení nebo ukončení léčby siltuximabem u pacientů užívajících léčiva, která jsou metabolizována prostřednictvím CYP450 a mají úzký terapeutický index, se proto doporučuje monitorování účinku (např. u warfarinu) nebo koncentrace léčiva (např. u cyklosporinu nebo teofylinu) s případnou úpravou dávkování souběžně užívaných léčiv. Účinek siltuximabu na aktivitu CYP450 může přetrvávat ještě několik týdnů po ukončení léčby [20].
Dávkování
Siltuximab je schválen FDA k podávání v dávce 11 mg/kg v hodinové intravenózní infuzi každé tři týdny. Interval dávkování může být v některých případech prodloužen na každých šest týdnů, jak ukazuje klinická studie [21]. Rovnovážného stavu léčiva je dosaženo šestou dávkou a akumuluje se přibližně 1,7násobek toho, čeho je dosaženo po jedné dávce. Kontrolní vyšetření krevního obrazu by mělo být provedeno před každou dávkou siltuximabu v prvním roce léčby, aby byl před léčbou zajištěn odpovídající absolutní počet neutrofilů, krevních destiček a hemoglobinu. Po uplynutí této doby lze laboratorní hodnoty zkontrolovat před každým třetím cyklem. Pacienti s poruchou funkce ledvin (clearance kreatininu ≥ 15 ml/min) nevyžadují žádnou úpravu dávky ve srovnání s pacienty s normální funkcí ledvin (clearance kreatininu ≥ 90 ml/min). Lék nebyl testován u pacientů s clearance kreatininu nižší než 15 ml/min. Mírná až středně těžká porucha funkce jater také nevyžaduje žádnou úpravu dávky, ale osoby s těžkou poruchou funkce jater nebyly zahrnuty do klinických studií [6].
Podávání léku je doporučeno se vyvarovat u těhotných nebo kojících pacientek. Siltuximab nebyl dosud testován v pediatrické populaci, a přestože byl podáván v geriatrické populaci, neexistují dostatečné údaje, které by vyloučily rozdíly v účinnosti u starších pacientů [20].
Nežádoucí účinky
Nejčastějšími nežádoucími účinky, které se vyskytly u více než 20 % pacientů užívajících siltuximab v klinických studiích zaměřených na multicentrickou Castlemanovu chorobu, byly infekce (včetně infekcí horních cest dýchacích), svědění kůže a vyrážka, artralgie a průjem. Nejzávažnějším nežádoucím účinkem spojeným s použitím siltuximabu byly reakce asociované s infuzí siltuximabu charakteru hypersenzitivních reakcí − vyskytly se u 5,1 % (závažné reakce u 0,8 %) pacientů [22].
Siltuximab a asymptomatický mnohočetný myelom
Asymptomatický MM (SMM), dříve nazývaný doutnající myelom (v anglické literatuře smoldering multiple myeloma), je bezpříznakovou formou monoklonální gamapatie. V roce 2003 byl SMM definován International Myeloma Working Group (IMWG) jako plazmocelulární dyskrazie charakterizovaná přítomností ≥ 30 g/l sérového paraproteinu a/nebo ≥ 10% infiltrací kostní dřeně plazmatickými buňkami, současně však chybějí známky orgánového postižení (hyperkalcemie, renální selhání, anémie a kostní léze). V roce 2014 byla tato kritéria IMWG revidována [23,24]. Většina pacientů se SMM progreduje v průběhu různě dlouhé doby do symptomatické formy myelomu s nutností zahájení léčby. Proto je cílem rozeznat skupinu pacientů s vysokým rizikem progrese a tyto jedince začít léčit před rozvojem klinických symptomů. V současné době existují tři stratifikační modely, které dělí pacienty se SMM do rizikových skupin − MAYO, PETHEMA a CMG model [25]. Řada klinických hodnocení probíhá u pacientů se SMM s cílem zabránění přechodu do symptomatické formy MM.
Jedním z klinických hodnocení právě u vysoce rizikových pacientů se SMM je i randomizovaná, dvojitě zaslepená, placebem kontrolovaná, multicentrická studie hodnotící zablokování IL 6 siltuximabem za účelem oddálení přechodu vysoce rizikového SMM do symptomatické formy MM. Do klinického hodnocení bylo zařazeno celkem 85 pacientů randomizovaných v poměru 1 : 1 k podání 15 mg/kg siltuximabu nebo placeba ve formě hodinové intravenózní infuze každé čtyři týdny až do přechodu do symptomatického MM, nepřijatelné toxicity, odvolání souhlasu, nebo do ukončení studie. Primárním cílovým ukazatelem studie bylo zhodnocení jednoletého přežití bez progrese (progression free survival, PFS) dle platných kritérií IMWG [23,24]. Sekundární cílové ukazatele představovaly bezpečnost léčby, zhodnocení míry progrese do symptomatického MM a PFS. Medián věku byl v obou léčebných skupinách podobný: 62 let (rozmezí 21–84 let). Větší počet pacientů tvořili muži (48; 57 %) a běloši (72; 85 %) s performance status dle ECOG (European Cooperative Oncology Group) 0 (74; 87 %).
Jednoleté PFS činilo 84,5 % (95%
interval spolehlivosti [CI] 68,6–92,8) ve skupině se
siltuximabem a 74,4 % (95% CI 57,3–85,5) ve skupině
s placebem (graf 1). Bylo pozorováno absolutní zlepšení
o 10,1 %, nicméně studie nesplnila předem stanovenou
hypotézu, že siltuximab zvýší jednoleté PFS alespoň o 14 %.
Medián sledování činil celkem 29,2 měsíce. Mediánu PFS nebylo
v rameni se siltuximabem dosaženo, zatímco v rameni
s placebem činil 23,5 měsíce. Poměr rizik (hazard ratio, HR)
PFS při srovnání siltuximabu oproti placebu byl 0,50 (95% CI
0,24–1,04; p = 0,0597). Mediánu celkového
přežití (overall survival, OS) nebylo u žádné skupiny
do konce studie dosaženo [26].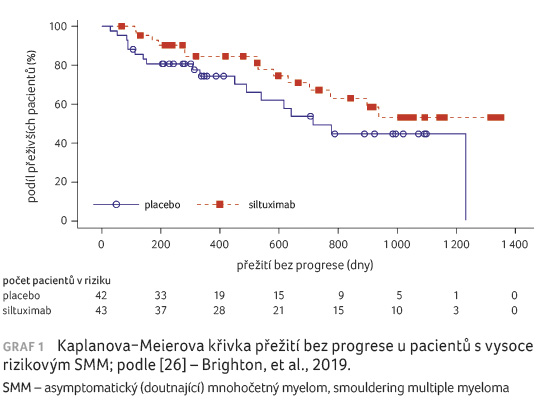
Co se týče bezpečnosti, všichni pacienti zařazení do klinického hodnocení měli alespoň jeden nežádoucí účinek. Výskyt nežádoucích účinků stupně 3 nebo vyššího byl ve skupině se siltuximabem vyšší ve srovnání s placebem (47 % vs. 33 %); < 5 % pacientů ve skupině se siltuximabem však mělo nežádoucí účinky stupně 4. Výskyt nežádoucích účinků stupně 5 byl v obou skupinách nízký (2 % ve skupině se siltuximabem a 5 % ve skupině s placebem). Mezi nejčastější příhody patřily infekční komplikace (5 pacientů [12 %] u siltuximabu, 6 pacientů [14 %] u placeba) a nemoci urogenitálního traktu (1 pacient [2 %] u siltuximabu, 3 pacienti [7 %] u placeba).
Během studie zemřelo sedm osob: tři pacienti ve skupině se siltuximabem a čtyři pacienti ve skupině s placebem. Tři pacienti − jeden ve skupině se siltuximabem a dva ve skupině s placebem − zemřeli na nežádoucí příhody do 30 dnů od poslední dávky. Pacient ve skupině se siltuximabem zemřel na pneumonii, která byla posouzena jako pravděpodobně nesouvisející s léčbou, pacienti ve skupině s placebem zemřeli na kardiální příčinu bez souvislosti s podáním studijní léčby. Dva pacienti ve skupině s placebem zemřeli v důsledku progrese základního onemocnění a následného septického šoku a dva pacienti ve skupině se siltuximabem zemřeli z neznámé příčiny. Ke všem příhodám došlo více než 30 dní po poslední dávce. Výsledky této studie naznačují, že siltuximab může oddálit progresi onemocnění u pacientů s vysoce rizikovým SMM [26].
Siltuximab a mnohočetný myelom
Synergická aktivita siltuximabu a dexametazonu v myelomových buněčných liniích pěstovaných v přítomnosti stromatu kostní dřeně včetně buněk od pacientů s onemocněním rezistentním na kortikosteroidy byla prokázána již dříve [27]. Studie fáze I hodnotila eskalaci dávek chimérické monoklonální anti IL 6 protilátky (cMab) u pacientů s relabujícím nebo refrakterním MM, kteří absolvovali alespoň dvě předchozí léčebné linie. Léčba cMab byla podávána ve dvou cyklech každých 14 dnů ve dvouhodinové infuzi v 28denním cyklu. Denní dávka cMab činila 5 mg u pacientů 1−3, 10 mg u pacientů 4−6, 20 mg u pacientů 7−9 a 40 mg u pacientů 10−12 (celková dávka činila 140 mg, 280 mg, 560 mg a 1 120 mg cMab, jednotlivě). Celkem 11 z 12 pacientů mělo před léčbou cMab zvýšenou hodnotu IL 6 v séru. Léčba byla dobře tolerována. U dvou pacientů došlo přechodně k trombocytopenii stupně 2, jinak nebyly zaznamenány žádné změny v krevním obraze, v hodnotě jaterních enzymů či v renálních funkcích. U cMab byl zaznamenán poměrně dlouhý poločas rozpadu (medián 17,8 dne), což mělo za následek akumulaci cMab a vysoké koncentrace cirkulujícího IL 6, avšak ve formě biologicky neaktivních komplexů IL 6/cMab. Ačkoliv hodnoty CRP byly sníženy pod detekční úroveň u 11 z 12 pacientů, což naznačuje účinné blokování IL 6, žádný z nemocných nedosáhl léčebné odpovědi podle standardních kritérií [23]. Studie zjistila, že chimérická anti IL 6 Mab má nízkou toxicitu, nízkou imunogenicitu a dlouhý poločas rozpadu. Dávku 40 mg/den podávanou po dobu 14 dnů lze bezpečně použít v budoucích studiích fáze II [28]. Bezpečnost cMab při dlouhodobém podávání u pacientů s MM následně potvrdila i práce Kurzrocka a kol. [29].
Na předchozí klinickou studii navazovala otevřená, multicentrická jednoramenná studie fáze II s cílem vyhodnotit účinnost a bezpečnost siltuximabu, a to jak v monoterapii, tak v kombinaci s dexametazonem. Do studie byli zařazeni pacienti s relabujícím/refrakterním MM, kteří byli předléčeni bortezomibem a byli léčeni dvěma nebo více liniemi léčby. Čtrnáct pacientů dostalo samotný siltuximab, 39 pacientů bylo léčeno souběžně siltuximabem a dexametazonem. U všech nemocných bylo prokázáno potlačení hodnot CRP v séru, náhradního markeru inhibice IL 6. V rameni se siltuximabem nebyla pozorována žádná léčebná odpověď, ale u kombinované terapie (siltuximab + dexametazon) byla pozorována parciální remise (partial remission, PR) v 17 % a minimální odpověď v 6 %, přičemž léčebné odpovědi byly pozorovány u pacientů refrakterních na dexametazon. Medián doby do progrese, PFS a OS u kombinované terapie činil 4,4, 3,7 a 20,4 měsíce. Hematologická toxicita nebyla závažná. Infekce se vyskytla u 57 % pacientů léčených kombinací, včetně infekcí stupně 3 a vyššího u 18 % osob [30].
Srovnání bezpečnosti a účinnosti
kombinace siltuximabu a bortezomibu oproti placebu
s bortezomibem u pacientů s relabujícím/refrakterním
MM proběhlo v randomizované studii fáze II. Siltuximab byl
podáván intravenózně v dávce 6 mg/kg každé dva týdny.
U 281 randomizovaných pacientů byl medián PFS pro siltuximab
a bortezomib, resp. placebo a bortezomib 8,0, resp. 7,6
měsíce (HR 0,869; p = 0,345). Míra objektivní
odpovědi na léčbu (objective response rate, ORR) byla 55 %
versus 47 % (p = 0,213), kompletní odpověď
(complete response, CR) 11 % versus 7 % a medián OS činil
30,8 měsíce versus 36,8 měsíce (HR 1,353; p = 0,103).
U kombinace siltuximabu a bortezomibu byla pozorována
trvalá suprese CRP, markeru odrážejícího inhibici aktivity IL 6.
Siltuximab neovlivnil farmakokinetiku bortezomibu. Přerušení
podávání siltuximabu nebo placeba bylo pozorováno v 75 %
oproti 66 %, neutropenie stupně 3 a vyššího se vyskytla
ve 49 % vs. 29 %, trombocytopenie ve 48 % vs. 34 %
a infekce všech stupňů v 62 % vs. 49 %. Přidání
siltuximabu k bortezomibu nevedlo ke zlepšení PFS nebo
OS, nicméně byla pozorována zlepšená léčebná odpověď
u pacientů s relabujícím nebo refrakterním MM [31].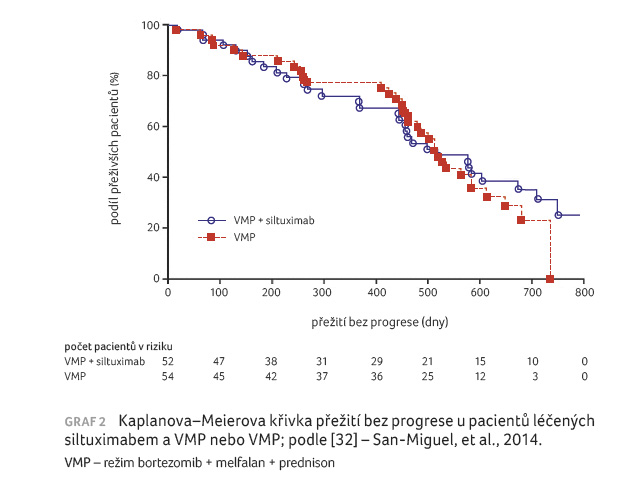
U nově diagnostikovaných pacientů s MM, u nichž nebyla vhodná ASCT, proběhla randomizovaná klinická studie fáze II hodnotící režim VMP samostatně nebo se siltuximabem. Sto šest pacientů bylo randomizováno, aby dostali devět cyklů VMP nebo VMP se siltuximabem (11 mg/kg každé tři týdny), poté následovala udržovací léčba siltuximabem. Kompletní remise byla pozorována u 27 % pacientů léčených siltuximabem a VMP a u 22 % pacientů léčených VMP. Studie nepotvrdila hypotézu, že přidání siltuximabu zvýší míru CR nejméně o 10 %. Míra objektivní odpovědi na léčbu činila 88 % u siltuximabu s VMP a 80 % u VMP. Velmi dobrá parciální remise (very good partial response, VGPR) byla zaznamenána u 71 % pacientů léčených siltuximabem a VMP a u 51 % pacientů léčených VMP (p = 0,0382). Medián PFS (17 měsíců; graf 2) a jednoleté OS (88 %) byly v obou ramenech totožné. Incidence nežádoucích účinků stupně 3 a vyššího byla 92 % u siltuximabu a VMP a 81 % u VMP (p = 0,09), přičemž dominovaly hematologická toxicita a infekční komplikace v rameni se siltuximabem a VMP. Udržovací terapie siltuximabem byla dobře tolerována. Ukázalo se, že přidání siltuximabu k VMP nezlepšilo CR, PFS nebo OS, ale posílilo VGPR [32].
Účinnost a bezpečnost siltuximabu v kombinací s bortezomibem, lenalidomidem a dexametazonem (režim RVD) byly rovněž ověřovány v klinické studii fáze I u nově diagnostikovaných pacientů s MM. Do studie bylo zařazeno 14 pacientů, z toho u většiny nemocných (81,8 %) byly podány minimálně čtyři požadované cykly léčby, zatímco dva nemocní absolvovali pouze tři cykly. Maximální tolerovaná dávka siltuximabu s RVD činila: siltuximab 8,3 mg/kg, bortezomib 1,3 mg/m2, lenalidomid 25 mg, dexametazon 20 mg. Závažnými nežádoucími účinky byly pneumonie stupně 3 a trombocytopenie stupně 4 a během studie ani při následném sledování (medián 28,1 měsíce) nedošlo k úmrtí. Míry objektivní léčebné odpovědi bylo dosaženo v 90,9 % (CR 9,1 %, VGPR 45,5 %, PR 6,4 %). Devět pacientů (81,8 %) se rozhodlo pro následnou ASCT [33].
Závěr
V předklinických studiích bylo prokázáno, že IL 6 působí jako faktor přežití a růstový faktor pro MM buňky. Ukázalo se, že sérová koncentrace IL 6 koreluje se stadiem onemocnění a prognózou u MM. Zvýšené koncentrace IL 6 u MM pocházející ze stromálních buněk kostní dřeně podporují přežití maligních plazmatických buněk prostřednictvím interakcí s adhezními molekulami, cytokiny, tumor supresorovými geny a onkogeny. Siltuximab, chimérická monoklonální protilátka, která váže IL 6, byla schválena FDA a EMA pro léčbu multicentrické Castlemanovy choroby a je rovněž zkoumána u MM. V klinických studiích siltuximab neprodloužil PFS a OS, nicméně prohloubil již dosažené léčebné odpovědi. Účinnost siltuximabu byla též ověřována u pacientů s vysoce rizikovým SMM. Výsledky studie potvrdily, že siltuximab může oddálit progresi SMM do MM, nicméně předem specifikovaná hypotéza, že siltuximab zvýší jednoleté PFS alespoň o 14 %, nebyla splněna. Siltuximab byl dobře tolerován. V současné době je v léčbě MM k dispozici řada nových účinných léků. Čas ukáže, zda siltuximab zaujme své místo i v léčbě této druhé nejčastější hematologické malignity, nebo zůstane na předním místě pouze v terapii multicentrické Castlemanovy choroby.
Seznam použité literatury
- [1] Diagnostika a léčba mnohočetného myelomu. Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a Slovenskou myelómovou spoločností pro diagnostiku a léčbu mnohočetného myelomu. Transfuze Hematol dnes 2018; 24(Suppl 1): 1–160.
- [2] Maluskova D, Svobodová I, Kucerova M, et al. Epidemiology of Multiple Myeloma in the Czech Republic. Klin Onkol 2017; 30(Suppl 2): 35–42.
- [3] San‑Miguel JF, Schlag R, Khuageva NK, et al. Persistent overall survival benefit and no increased risk of second malignancies with bortezomib‑melphalan‑prednisone versus melphalan‑prednisone in patients with previously untreated multiple myeloma. J Clin Oncol 2013; 31: 448–455.
- [4] Mian M, Tinelli M, de March E, et al. Bortezomib, Thalidomide and Lenalidomide: Have They Really Changed the Outcome of Multiple Myeloma? Anticancer Res 2016; 36: 1059–1065.
- [5] van de Donk NW, Janmaat ML, Mutis T, et al. Monoclonal antibodies targeting CD38 in hematological malignancies and beyond. Immunol Rev 2016; 270: 95–112.
- [6] van Rhee F, Voorhees P, Dispenzieri A, et al. International, evidence‑based consensus treatment guidelines for idiopathic multicentric Castleman disease. Blood 2018; 132: 2115–2124.
- [7] Hirano T, Yasukawa K, Harada H, et al. Complementary DNA for a novel human interleukin (BSF‑2) that induces B lymphocytes to produce immunoglobulin. Nature 1986; 324: 73–76.
- [8] Jones SA, Horiuchi S, Topley N, et al. The soluble interleukin 6 receptor: mechanisms of production and implications in disease. FASEB J 2001; 15: 43–58.
- [9] Trikha M, Corringham R, Klein B, Rossi J‑F. Targeted Anti‑Interleukin‑6 Monoclonal Antibody Therapy for Cancer: A Review of the Rationale and Clinical Evidence. Clin Cancer Res 2003; 9: 4653–4665.
- [10] Jourdan M, Bataille R, Seguin J, et al. Constitutive production of interleukin‑6 and immunologic features in cardiac myxomas. Arthritis Rheum 1990; 33: 398–402.
- [11] Jego G, Bataille R, Pellat‑Deceunynck C. Interleukin‑6 is a growth factor for nonmalignant human plasmablasts. Blood 2001; 97: 1817–1822.
- [12] Kishimoto T, Akira S, Taga T. Interleukin‑6 and its receptor: a paradigm for cytokines. Science (Wash. DC) 1992; 258: 593–597.
- [13] Müllberg J, Schooltink H, Stoyan T, et al. The soluble interleukin‑6 receptor is generated by shedding. Eur J Immunol 1993; 23: 473–480.
- [14] Gupta P, Blazar BR, Gupta K, Verfaillie CM. Human CD34+ bone marrow cells regulate stromal production of interleukin‑6 and granulocyte colony‑stimulating factor and increase the colony‑stimulating activity of stroma. Blood 1998; 91: 3724–3733.
- [15] Omura H, Kawatani T, Tajima F, et al. Serum soluble IL‑6 receptor levels during the mobilization of stem cells to peripheral blood. Leuk Lymphoma 2002; 43: 623–630.
- [16] Tsuruda T, Jougasaki M, Boerrigter G, et al. Cardiotrophin‑1 stimulation of cardiac fibroblast growth: roles for glycoprotein 130/leukemia inhibitory factor receptor and the endothelin type A receptor. Circ Res 2002; 90: 128–134.
- [17] Gado K, Domjan G, Hegyesi H, Falus A. Role of interleukin‑6 in the pathogenesis of multiple myeloma. Cell Biol Int 2000; 24: 195–209.
- [18] Deisseroth A, Ko CW, Nie L, et al. FDA approval: siltuximab for the treatment of patients with multicentric Castleman disease. Clin Cancer Res 2015; 21: 950–954.
- [19] Casper C, Chaturvedi S, Munshi N, et al. Analysis of Inflammatory and Anemia‑Related Biomarkers in a Randomized, Double‑Blind, Placebo‑Controlled Study of Siltuximab (Anti‑IL‑6 Monoclonal Antibody) in Patients With Multicentric Castleman Disease. Clin Cancer Res 2015; 21: 4294–4304.
- [20] SPC Sylvant. Dostupné na: https://www.ema.europa.eu/en/docu-
- [21] van Rhee F, Casper C, Voorhees PM, et al. A phase 2, open‑label, multicenter study of the long‑term safety of siltuximab (an anti‑interleukin‑6 monoclonal antibody) in patients with multicentric Castleman disease. Oncotarget 2015; 6: 30408‑30419.
- [22] van Rhee F, Fayad L, Voorhees P, et al. Siltuximab, a novel anti‑interleukin‑6 monoclonal antibody, for Castlemanʼs disease. J Clin Oncol 2010; 28: 3701–3708.
- [23] Korde N, Kristinsson SY, Landgren O. Monoclonal gammopathy of undetermined significance (MGUS) and smoldering multiple myeloma (SMM): novel biological insights and development of early treatment strategies. Blood 2011; 117: 5573–5581.
- [24] Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15: e538–e548.
- [25] Hájek R, Sandecká V, Špička I, et al. Identification of patients with smouldering multiple myeloma at ultra‑high risk of progression using serum parameters: the Czech Myeloma Group model. Br J Haematol 2020; 190: 189–197.
- [26] Brighton TA, Khot A, Harrison SJ, et al. Randomized, Double‑Blind, Placebo‑Controlled, Multicenter Study of Siltuximab in High‑Risk Smoldering Multiple Myeloma. Clin Cancer Res 2019; 25: 3772–3775.
- [27] Voorhees PM, Chen Q, Small GW, et al. Targeted inhibition of interleukin‑6 with CNTO 328 sensitizes pre‑clinical models of multiple myeloma to dexamethasone‑mediated cell death. Br J Haematol 2009; 145: 481–490.
- [28] van Zaanen HC, Lokhorst HM, Aarden LA, et al. Chimaeric anti‑interleukin 6 monoclonal antibodies in the treatment of advanced multiple myeloma: a phase I dose‑escalating study. Br J Haematol 1998; 102: 783–790.
- [29] Kurzrock R, Voorhees PM, Casper C, et al. Long‑Term Safety in a Phase 1 Study of Siltuximab (CNTO 328), an Anti‑Interleukin‑6 Monoclonal Antibody, in Patients with B‑Cell Non‑Hodgkin’s Lymphoma, Multiple Myeloma, or Castleman’s Disease. Blood (ASH Annual Meeting Abstracts) 2011; 118: Abstr 3959.
- [30] Voorhees PM, Manges RF, Sonneveld P, et al. A phase 2 multicentre study of siltuximab, an anti‑interleukin‑6 monoclonal antibody, in patients with relapsed or refractory multiple myeloma. Br J Haematol 2013; 161: 357–366.
- [31] Orlowski RZ, Gercheva L, Williams C, et al. A phase 2, randomized, double‑blind, placebo‑controlled study of siltuximab (anti‑IL‑6 mAb) and bortezomib versus bortezomib alone in patients with relapsed or refractory multiple myeloma. Am J Hematol 2015; 90: 42–49.
- [32] San‑Miguel J, Bladé J, Shpilberg O, et al. Phase 2 randomized study of bortezomib‑melphalan‑prednisone with or without siltuximab (anti‑IL‑6) in multiple myeloma. Blood 2014; 123: 4136–4142.
- [33] Shah JJ, Feng L, Thomas SK, et al. Siltuximab (CNTO 328) with lenalidomide, bortezomib and dexamethasone in newly‑diagnosed, previously untreated multiple myeloma: an open‑label phase I trial. Blood Cancer J 2016; 6: e396.