Subkutánní abatacept
Revmatoidní artritida je chronické autoimunní onemocnění charakterizované zánětem synoviální tkáně. Bez dostatečné kontroly zánětlivého procesu může vést k poškození chrupavky a kosti, dále pak i k orgánovým komplikacím. U pacientů s nedostatečným efektem „standardní” léčby chorobu modifikujícími léky je indikováno zahájení biologické terapie. V současné době je k dispozici celá řada biologických přípravků s různým mechanismem účinku a s různou cestou podání. Abatacept představuje biologický lék podávaný v České republice dosud intravenózně ve druhé linii biologické léčby. V současnosti je dostupná také jeho subkutánní forma.
V posledních letech se významně rozrostla skupina léků označovaných oficiálně jako bDMARDs (biologic Disease Modifying Drugs for Rheumatoid Arthritis) či jednoduše jako biologické léky; navzájem se liší svojí molekulární strukturou, mechanismem účinku či cestou podání. Jedním z těchto přípravků, který je v ČR schválen pro léčbu pacientů s aktivní revmatoidní artritidou, u nichž selhala terapie klasickými DMARDs a anti-TNF (anti-tumor necrosis factor) terapie, je abatacept.
Abatacept v léčbě revmatoidní artritidy
Abatacept je biologický lék interagující s kostimula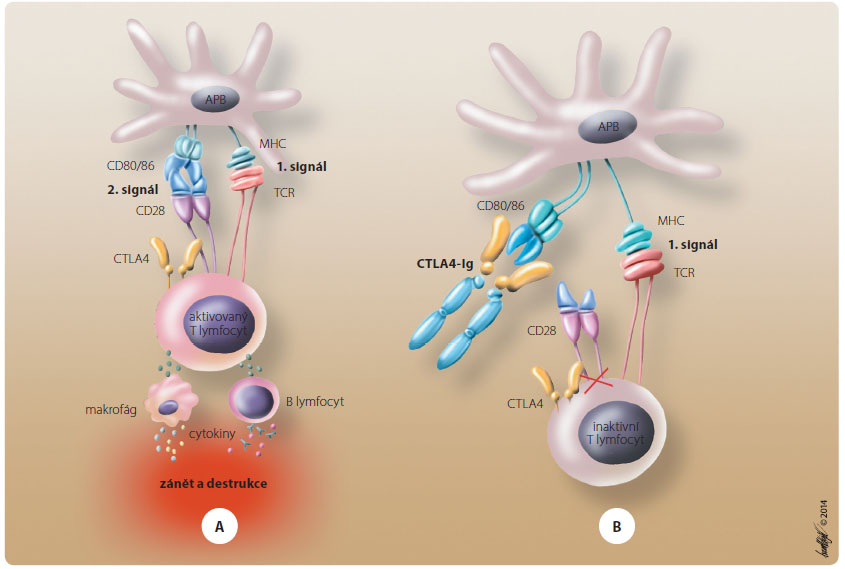 čním systémem při aktivaci T lymfocytů, obr. 1. Aktivace vyžaduje dva signály – jednak prezentaci antigenu prostřednictvím antigenů MHC II. třídy (hlavní histokompatibilní systém II) antigen prezentujícími buňkami T lymfocytům, které disponují TCR (T buněčný receptor), jednak vazbu tzv. kostimulačních molekul, které poskytnou „druhý signál“. Existují dva hlavní kostimulační systémy; první je tvořen molekulami CD28 a CD80/86, druhý molekulou CD40 a ligandem CD40 (CD40L). Kostimulační systémy jsou regulovány rovněž negativní zpětnou vazbou, kterou v případě CD28–CD80/86 představuje molekula CTLA4 (cytotoxic T lymphocyte associated antigen); CTLA4 blokuje prostřednictvím vazby na molekulu CD80/86 druhý signál a tím tlumí aktivaci T buněk [1]. Abatacept je solubilní fúzní protein kombinující Fc fragment IgG1 (imunoglobulin G1) a CTLA4 bránící vazbě CD28 k molekule CD80/86 [2].
čním systémem při aktivaci T lymfocytů, obr. 1. Aktivace vyžaduje dva signály – jednak prezentaci antigenu prostřednictvím antigenů MHC II. třídy (hlavní histokompatibilní systém II) antigen prezentujícími buňkami T lymfocytům, které disponují TCR (T buněčný receptor), jednak vazbu tzv. kostimulačních molekul, které poskytnou „druhý signál“. Existují dva hlavní kostimulační systémy; první je tvořen molekulami CD28 a CD80/86, druhý molekulou CD40 a ligandem CD40 (CD40L). Kostimulační systémy jsou regulovány rovněž negativní zpětnou vazbou, kterou v případě CD28–CD80/86 představuje molekula CTLA4 (cytotoxic T lymphocyte associated antigen); CTLA4 blokuje prostřednictvím vazby na molekulu CD80/86 druhý signál a tím tlumí aktivaci T buněk [1]. Abatacept je solubilní fúzní protein kombinující Fc fragment IgG1 (imunoglobulin G1) a CTLA4 bránící vazbě CD28 k molekule CD80/86 [2].
Abatacept je v současné době v České republice předepisován revmatology v centrech biologické léčby. Intravenózní forma se aplikuje 30minutovou infuzí. Po první dávce se abatacept podává dále po 2 a 4 týdnech od první infuze a poté vždy po 4 týdnech. U nemocných s hmotností do 60 kg se podává intravenózně 500 mg abataceptu, při hmotnosti mezi 60–100 kg je indikováno podání 750 mg abataceptu, u nemocných s hmotností vyšší než 100 kg pak 1000 mg abataceptu. Na českém trhu se tento přípravek objevil v roce 2008. Do konce roku 2013 byla dostupná pouze jeho intravenózní forma.
Nyní je nově k dispozici i subkutánní léková forma abataceptu. Jedná se o předplněné injekční stříkačky obsahující fixní dávku 125 mg abataceptu, která je určena k aplikaci 1krát týdně. Tato nová aplikační forma může být pro část pacientů výhodná a představuje komfortnější možnost aplikace léku bez nutnosti návštěvy zdravotnického zařízení. Léčba se zahajuje úvodním podáním jedné dávky v intravenózní infuzi (≈ 10 mg/kg) 24 hodin před první subkutánní aplikací. Pacienti, u kterých nelze podat infuzi, mohou zahájit týdenní podávání léčiva subkutánně bez předcházející intravenózní zahajovací dávky. Pacientům přecházejícím z intravenózní na subkutánní aplikaci přípravku podáváme první subkutánní dávku namísto následující plánované intravenózní.
Subkutánní abatacept v klinickém hodnocení
Možnost vynechání úvodní dávky potvrzují výsledky post hoc analýzy dat ze studií ACQUIRE (s úvodní dávkou) a AMPLE (bez úvodní dávky). V obou studiích byla prokázána srovnatelná účinnost na dosažení odpovědi ACR 20 (20% zlepšení dle kritérií American College of Rheumatology), zlepšení HAQ-DI (Health Assessment Questionnaire Disability Index), zlepšení DAS28-CRP (Disease Activity Score 28; CRP – C-reaktivní protein) po 6 měsících léčby. Rovněž tak farmakokinetická data ze studií ALLOW (s i.v. úvodní dávkou) a ACCOMPANY (bez i.v. dávky) prokázala dosažení terapeutických hladin léčiva ve dni 15 v obou sledovaných skupinách [3–5]. Další výsledky studií se subkutánním abataceptem prokázaly jeho klinickou účinnost, nízkou imunogenicitu, bezpečnost a tolerabilitu srovnatelnou s intravenózní formou.
Fixní dávka 125 mg týdně byla stanovena na základě výsledků studie II. fáze, ve které byli pacienti s aktivní revmatoidní artritidou léčenou methotrexátem s dalšími perorálními DMARDs nebo bez nich randomizováni v poměru 3 : 1 k podávání subkutánního abataceptu nebo placeba po dobu 12 měsíců. Podávání abataceptu subkutánně bylo zahájeno po úvodní intravenózní infuzi v dávce ≈ 10 mg/kg. Následně pak byl abatacept aplikován v dávce 75–200 mg (v závislosti na tělesné hmotnosti) nebo ve fixní dávce 125 mg. Sérové koncentrace léčiva dosažené při dlouhodobém podávání byly srovnatelné ve všech skupinách a odpovídaly terapeutickým koncentracím dosaženým při intravenózní terapii [6].Klinická účinnost a bezpečnost subkutánního podávání abataceptu byla následně potvrzena dalšími studiemi III. fáze. Jednou z nich je ACQUIRE. Jednalo se o dvojitě zaslepenou, randomizovanou, non-inferioritní studii, která srovnávala účinnost, bezpečnost, farmakokinetiku a imunogenicitu subkutánního a intravenózního abataceptu u 1457 pacientů s aktivní revmatoidní artritidou a nedostatečnou odpovědí na léčbu methotrexátem. Pacienti byli randomizováni v poměru 1 : 1 k týdennímu užívání s.c. abataceptu ve fixní dávce 125 mg s úvodní i.v. dávkou ≈ 10 mg/kg, či k měsíčnímu podání i.v. abataceptu v dávce ≈ 10 mg/kg. Všichni pacienti zároveň pokračovali v užívání methotrexátu. Po 6 měsících mohli pacienti pokračovat v dlouhodobé otevřené extenzi studie, ve které dále aplikovali subkutánní abatacept.
Po 6 měsících léčby dosáhlo 75,8 % pacientů léčených subkutánním abataceptem odpovědi ACR 20, přičemž účinnost byla srovnatelná s intravenózně podávaným abataceptem (rozdíl 0,3 %), viz graf 1, 2. Srovnatelná byla i účinnost obou lékových forem na aktivitu onemocnění (DAS28-CRP) a na zlepšení fyzických funkcí. Dlouhodobá účinnost po 32 měsících léčby byla srovnatelná s výsledky dosaženými v dlouhodobých extenzích studií s intravenózním abataceptem (AIM, ATTAIN) [7, 8]. Samotnými pacienty bylo srovnatelně hodnoceno i zlepšení HAQ-DI a dotazníku o zdravotním stavu SF-36. Povzbudivé jsou i údaje o setrvání na léčbě, kdy po 6 měsících zůstávalo léčeno zhruba 90 % nemocných a po 44 ![Graf 1 Studie ACQUIRE – procento dosažení odpovědi ACR 20 po léčbě subkutánním abataceptem; podle [7] – Genovese, et al., 2011. ACR 20 – 20% zlepšení dle kritérií American College of Rheumatology; MTX – methotrexát](https://www.remedia.cz/photo-a-29702---.jpg) měsících setrvávalo na léčbě 82,7 % nemocných. Zvýšená imunogenicita je obecně problémem při léčbě subkutánními biologiky, proto bylo sledování protilátek proti abataceptu metodou ELISA zahrnuto jako jeden z primárních cílů celé řady studií, včetně studie ACQUIRE. Po 6měsíčním sledování byla data srovna
měsících setrvávalo na léčbě 82,7 % nemocných. Zvýšená imunogenicita je obecně problémem při léčbě subkutánními biologiky, proto bylo sledování protilátek proti abataceptu metodou ELISA zahrnuto jako jeden z primárních cílů celé řady studií, včetně studie ACQUIRE. Po 6měsíčním sledování byla data srovna![Graf 2 Studie ACQUIRE – dosažení léčebné odpovědi ACR 20, ACR 50 a ACR 70 po léčbě subkutánním abataceptem; podle [7] – Genovese, et al., 2011. ACR 20/50/70 – 20%/50%/70% zlepšení dle kritérií American College of Rheumatology; MTX – methotrexát](https://www.remedia.cz/photo-a-29703---.jpg) telná u obou aplikačních forem, přičemž přítomnost protilátek neměla vliv na účinnost a bezpečnost léčby [7].
telná u obou aplikačních forem, přičemž přítomnost protilátek neměla vliv na účinnost a bezpečnost léčby [7].
ACCOMPANY byla 4měsíční studie sledující imunogenicitu, farmakokinetiku, účinnost a bezpečnost subkutánního abataceptu podávaného s konkomitantní terapií methotrexátem nebo bez ní. Ve skupině s monoterapií byli zařazeni jednak methotrexát-naivní pacienti, a dále pacienti, u kterých byla léčba methotrexátem ukončena z důvodu intolerance nebo neúčinnosti. Změny v DAS28-CRP a HAQ-DI byly vyšší ve skupině léčené monoterapií [9], viz graf 3. Podávání methotrexátu současně s biologiky je doporučováno i z hlediska snížení jejich imunogenicity, proto byla ve zmíněné studii sledována i tato data. V průběhu 4měsíčního sledování byl v obou skupinách výskyt protilátek nízký (2 % u pacientů s monoterapií vs. 3,9 % při kombinované léčbě) [9].Účinnost a bezpečnost přechodu z dlouhodobé terapie i.v. aba![Graf 3 Studie ACCOMPANY – změna DAS28-CRP v průběhu léčby subkutánním abataceptem; podle [9] – Nash, et al., 2012. DAS28-CRP – Disease Activity Score 28; CRP – C-reaktivní protein; MTX – methotrexát](https://www.remedia.cz/photo-a-29704---.jpg) taceptem na podávání subkutánní formy přípravku u 123 pacientů s aktivní revmatoidní artritidou, kteří nedostatečně reagovali na podávání methotrexátu nebo anti-TNF terapie a účastnili se extenze studií s i.v. abataceptem (AIM a ATTAIN), potvrdily výsledky studie ATTUNE. Převedení na subkutánní abatacept u pacientů dlouhodobě léčených intravenózním abataceptem (4 a více roků) vedlo k trvale pokračujícímu efektu na zmírnění aktivity onemocnění a funkčního postižení po dobu 12 měsíců. Byl rovněž potvrzen i dobrý bezpečnostní profil převodu na subkutánní formu, v průběhu 3 měsíců nedošlo ke zvýšení incidence závažných infekcí, autoimunních projevů či malignit [10]. Rovněž tak nedošlo po změně aplikační formy k signifikantnímu zvýšení výskytu protilátek proti abataceptu.
taceptem na podávání subkutánní formy přípravku u 123 pacientů s aktivní revmatoidní artritidou, kteří nedostatečně reagovali na podávání methotrexátu nebo anti-TNF terapie a účastnili se extenze studií s i.v. abataceptem (AIM a ATTAIN), potvrdily výsledky studie ATTUNE. Převedení na subkutánní abatacept u pacientů dlouhodobě léčených intravenózním abataceptem (4 a více roků) vedlo k trvale pokračujícímu efektu na zmírnění aktivity onemocnění a funkčního postižení po dobu 12 měsíců. Byl rovněž potvrzen i dobrý bezpečnostní profil převodu na subkutánní formu, v průběhu 3 měsíců nedošlo ke zvýšení incidence závažných infekcí, autoimunních projevů či malignit [10]. Rovněž tak nedošlo po změně aplikační formy k signifikantnímu zvýšení výskytu protilátek proti abataceptu.
Studie ALLOW zkoumala bezpečnost a vliv přerušení léčby na imunogenicitu. Jednalo se o dvojitě zaslepenou studii, ve které pacienti (n = 167) po úvodní intravenózní dávce aplikovali subkutánní abatacept po dobu 12 týdnů a následně byli randomizováni v poměru 2 : 1 k užívání abataceptu či placeba. Po 12 týdnech zaslepené fáze všichni pokračovali v aplikaci abataceptu. Přechodné přerušení léčby nezhoršuje bezpečnostní profil abataceptu a nezvyšuje výskyt protilátek proti abataceptu [11].Aktuálně probíhá 2letá randomizovaná non-inferioritní studie AMPLE, která porovnává přímo („head to head“) účinek a bezpečnost s.c. abataceptu a adalimumabu v kombinaci s methotrexátem u 646 pacientů s aktivní revmatoidní artritidou doposud neléčených biologickou terapií. První, 12měsíční výstupy potvrzují non-inferioritu subkutánního abataceptu (v kombinaci s methotrexátem) oproti adalimumabu (v kombinaci s methotrexátem). Obě kombinace prokázaly srovnatelnou účinnost v dosažení odpovědi ACR 20 (64,8 % vs. 63,4 %), ACR 50 (50% zlepšení dle kritérií ACR) i ACR 70 (70% zlepšení dle kritérií ACR). Rovněž čas do dosažení léčebné odpovědi byl podobný. Tato studie rovněž poskytla první data týkající se strukturálního postižení; počet pacientů, u kterých nedošlo po roce léčby k radiografické progresi, byl v obou léčených skupinách srovnatelný [12]. Po roce trvání studie dále setrvávalo na léčbě 86,2 % pacientů.
Bezpečnostní profil subkutánního abataceptu ukazují data získaná ze studií ACQUIRE, ALLOW a ACOMPANY. Celkově byly hodnoceny údaje od 1879 pacientů, jednalo se o 3086 pacientoroků s průměrnou expozicí 20 měsíců. Výskyt závažných infekcí (nejčastěji pneumonie a uroinfekce) byl nižší u pacientů léčených subkutánním ve srovnání s intravenózním abataceptem (53,91 vs. 75,68); ve skupině léčené subkutánním abataceptem byl hlášen jeden případ pulmonální a jeden případ peritoneální tuberkulózy, incidence tuberkulózní infekce nevzrůstala s dobou expozice. Autoimunní choroby (psoriáza, Sjögrenův syndrom) se vyskytly u 2,1 % pacientů ze skupiny léčené subkutánní formou a u 5,6 % pacientů ze skupiny léčené intravenózním přípravkem, přičemž nejčastěji se jednalo o psoriázu a její incidence se nezvyšovala s délkou expozice. Výskyt malignit v souvislosti s léčbou byl srovnatelný v obou skupinách, nejčastěji se jednalo o karcinom prsu a kožní karcinomy (bazocelulární a karcinom ze skvamózních buněk). Rovněž i přímé srovnání obou lékových forem ve studii ATTUNE prokázalo jejich srovnatelný bezpečnostní profil [7, 8, 13–15].
Data ze studie AMPLE potvrzují srovnatelný bezpečnostní profil abataceptu a adalimumabu, jen výskyt autoimunních událostí byl u pacientů léčených abataceptem mírně vyšší (3,1 % vs. 1,2 %); reakcí v místě vpichu bylo naopak ve skupině s abataceptem méně (3,8 % vs. 9,1 %) a méně bylo také přerušení léčby z důvodu závažných nežádoucích účinků (1,3 % vs. 3,0 %).
Závěr
Na základě výše uvedených dat lze konstatovat, že týdenní podání fixní dávky 125 mg abataceptu subkutánně má srovnatelnou farmakokinetiku, klinickou účinnost, nízkou imunogenicitu, bezpečnost a tolerabilitu jako intravenózní podání tohoto přípravku. Před zahájením léčby je doporučeno podání první dávky intravenózně, v případě nemožnosti podání infuze se však celková účinnost nijak nesnižuje. Účinnost prvního podání subkutánní formy (po úvodní infuzi) je srovnatelná s účinností při převedení pacienta z jedné lékové formy na druhou, a tato možnost tedy představuje pro celou řadu aktivně žijících pacientů pohodlnější způsob aplikace mimo zdravotnické zařízení. V případě potřeby (operační zákrok, infekční komplikace) lze léčbu abataceptem na přechodnou dobu přerušit. Důležitým přínosem je i zpomalení či zastavení rentgenové progrese onemocnění, které je srovnatelné s anti-TNF léčbou (adalimumabem); rovněž účinnost a bezpečnost léčby u pacientů doposud neléčených biologiky je srovnatelná s anti-TNF terapií, což vede k logické úvaze o možném zařazení tohoto přípravku mezi biologika první linie léčby revmatoidní artritidy. Subkutánní abatacept představuje novou lékovou formu, která zcela jistě najde svou cílovou skupinu pacientů s aktivní revmatoidní artritidou.
Seznam použité literatury
- [1] Kremer JM, Westhovens R, Leon M, et al. Treatment of rheumatoid arthritis by selective inhibition of T-cell activation with fusion protein CTLA4Ig. N Engl J Med 2003; 349: 1907–1915.
- [2] Linsley PS, Brady W, Urnes M, et al. CTLA-4 is a second receptor for the B cell activation antigen B7. J Exp Med 1991; 174: 561–569.
- [3] Nash P, Ludivico C, Delaet I, et al. Improvements in disease activity and physical function in patients with RA receiving subcutaneous abatacept in the presence or absence of an initial IV loading dose. Ann Rheum Dis 2011; 70: SAT0287.
- [4] Nash P, Ludivico C, Delaet I, et al. Efficacy, safety and pharmacokinetics of subcutaneous abatacept in patients with rheumatoid arthritis, with or without an intravenous (IV) loading dose. Arthritis Rheum 2011; 63: S151.
- [5] Murthy B, Gao L, Vakkalagadda B, et al. Clinical pharmacokinetics of subcutaneous abatacept in the presence or absence of an intravenous loading dose in patients with rheumatoid arthritis. Ann Rheum Dis 2011; 70 (Suppl 3): SAT0284.
- [6] Corbo M, Valencia X, Raymond R, et al. Subcutaneous administration of abatacept in patients with rheumatoid arthritis: pharmacokinetics, safety and immunogenicity. Ann Rheum Dis 2009; 68: S574.
- [7] Genovese MC, Covarrubias A, Leon G, et al. Subcutaneous abatacept versus intravenous abatacept: a phase IIIb noninferiority study in patients with an inadequate response to methotrexate. Arthritis Rheum 2011; 63: 2854–2864.
- [8] Genovese MC, Cobos AC, Leon G, et al. Subcutaneous (SC) abatacept (ABA) versus intravenous (IV) ABA in patients (pts) with rheumatoid arthritis: long-term data from the ACQUIRE (Abatacept Comparison of sub[QU]cutaneous versus intravenous in Inadequate Responders to methotrexatE) trial. Arthritis Rheum 2011; 63: S150.
- [9] Nash P, Nayiager S, Genovese M, et al. Immunogenicity, safety and efficacy of subcutaneous abatacept with or without MTX in patients with rheumatoid arthritis: the Phase III ACCOMPANY study. Arthritis Care Res (Hoboken) 2012, Oct 24. doi: 10.1002/acr.21876. [Epub ahead of print].
- [10] Keystone EC, Kremer JM, Russell A, et al. Abatacept in subjects who switch from intravenous to subcutaneous therapy: results from the phase IIIb ATTUNE study. Ann Rheum Dis 2012; 71: 857–861.
- [11] Kaine J, Gladstein G, Strusberg I, et al. Evaluation of abatacept administered subcutaneously in adults with active rheumatoid arthritis: impact of withdrawal and reintroductionon immunogenicity, efficacy and safety (phase IIIb ALLOW study). Ann Rheum Dis 2012; 71: 38–44.
- [12] Weinblatt M, Schiff M, Valente R, et al. Head-to-head comparison of subcutaneous abatacept versus adalimumab for rheumatoid arthritis: findings of a phase IIIb, multinational, prospective, randomized study. Arthritis Rheum 2012; 65: 28–38.
- [13] Hochberg MC, Westhovens R, Aranda R, et al. Long-term safety of abatacept: integrated analysis of clinical program data of up to 7 years of treatment. Arthritis Rheum 2010; 62: S164.
- [14] Alten R, Kaine J, Keystone EC, et al. Safety of subcutaneous abatacept in patients with rheumatoid arthritis (RA): integrated analysis of five clinical trials up to 4.5 years. Ann Rheum Dis 2011; 70 (Suppl 3): 617.
- [15] Alten R, Kaine J, Keystone EC, et al. Safety profile of subcutaneous abatacept focusing on clinically relevant events in patients with rheumatoid arthritis (RA) and up to 4.5 years of exposure. Arthritis Rheum 2011; 63: S150.