Úvod
Myorelaxancia jsou běžně používána v průběhu chirurgického výkonu k svalové relaxaci anestezovaných pacientů. Rizikem při jejich použití je výskyt reziduální nervosvalové blokády, která může přispět k vývoji pooperačních plicních komplikací a ke zvýšení peroperační morbidity a mortality. Současný výzkum uvádí, že 12 % pacientů, kteří mají výborné klinické hodnocení zotavení z nervosvalové blokády, má dosud riziko reziduálního bloku. Mnozí anesteziologové i v dnešní době stále spoléhají na klinické zhodnocení zotavení z neuromuskulární blokády více než na objektivní výsledky měření relaxometrem.
Výskyt reziduální blokády lze snížit podáním antagonistů cholinesterázy, především syntostigminu a edrofonia. Obě farmaka však mají cholinergní účinky. Ovlivňují především kardiovaskulární a gastrointestinální systém. Často dochází k bradykardii a ke zvýšené salivaci. Podání antagonistů acetylcholinesterázy není kromě toho účinné při hluboké nervosvalové blokádě.
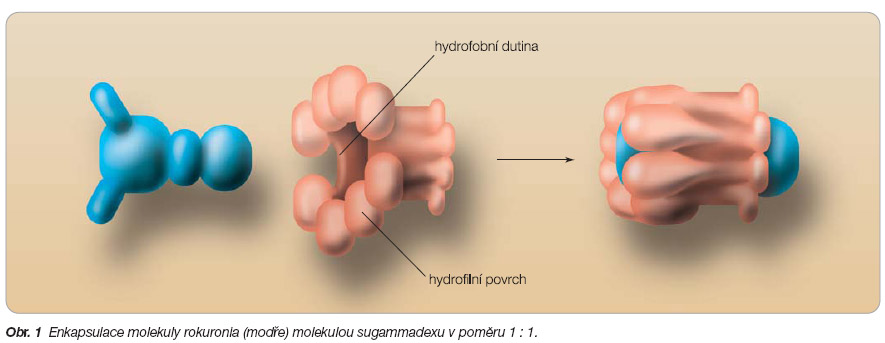
Se zcela novou koncepcí přicházejí nyní výzkumní pracovníci firmy Organon z Nizo zemska. Syntetizovali g -cyklodextrin, lát ku, která selektivně váže svalové relaxans. Představuje nový revoluční přístup k anta gonizování steroidních svalových relaxancií. Je to modifikovaný g -cyklodextrin, kte rý tvoří se steroidním relaxans velmi pevné ve vodě rozpustné komplexy v poměru 1 : 1. Byl nazván sugammadex (od slov sugar – cukr – a gammadex – vztahující se k molekule gamma-cyklodextrinu) [1]. Po intravenózním podání rychle obalí (enkapsuluje) molekuly steroidních relaxancií, převážně rokuronia, a znemožní tak jejich účinky na acetylcholinovém receptoru. Je to vlastně molekulární kondom pro steroidní svalová relaxancia, jak vtipně napsal Willighagen ( obr. 1 ).
Cyklodextriny jsou cyklické oligosacharidy, které byly objeveny v 19. století jako krystalický vedlejší produkt při degradaci
škrobu. Mají kulovitou strukturu s hydrofil ním povrchem, který činí cyklodextriny vysoce rozpustnými ve vodě, a zároveň mají schopnost vázat hydrofobní molekuly uvnitř centrální dutiny. Nejčastěji je označujeme a , b , g podle počtu glukózových jednotek 6, 7, 8. V medicíně jsou často používány jako látky pro rozpouštění vysoce nerozpustných farmak. Jsou také používány ke zlepšení farmakodynamických a farmakokinetických parametrů léčiv podávaných nazálně, transdermálně nebo rektálně. Jedná se především o opioidy, benzodiazepiny a nesteroidní antirevmatika. Dále jsou používány v preparátech s řízeným uvolňováním farmak.
Fyzikální a chemické vlastnosti
Podrobnou studií za pomoci rentgenové krystalografie a nukleární magnetické rezonanční spektroskopie bylo zjištěno, že sugammadex tvoří komplex s rokuroniem. K vazbě molekuly rokuronia dochází uvnitř molekuly cyklodextrinu. Struktura cyklodextrinu má hydrofobní dutinu a hydrofilní povrch vzhledem k přítomnosti polárních hydroxylových skupin.
Nejsilnější účinek má sugammadex na rokuronium, slabší na vekuronium a nejslabší na pankuronium. Ačkoliv nemodifikovaný
g
-cyklodextrin má větší lipofilní dutinu než jiné cyklodextriny, není dostatečně hluboká, aby se přizpůsobila velké rigidní struktuře molekuly rokuronia. Proto je cyklodextrin modifikován přidáním osmi postranních řetězců k zvětšení dutiny a k lepšímu přizpůsobení pro čtyři hydrofobní steroidní kruhy rokuronia. Na konci postranních řetězců jsou připojeny negativně nabité karboxylové skupiny ke zvýšení elektrostatické vazby k pozitivně nabitému kvarternímu dusíku rokuronia. Tyto úpravy vedou k tomu, že sugammadex tvoří vysoce ve vodě rozpustné komplexy s lipofilní dutinou, která je dostatečně velká k enkapsulaci steroidních neuromuskulárních relaxancií, zvláště pak rokuronia. Povrch sugammadexu je naproti tomu hydrofilní. Stabilita komplexu rokuronium -sugammadex je výsledkem intermoleku lárních van der Waalsových sil, zahrnujících interakce termodynamické (vodíkové vazby) a hydrofobní. Molekulová hmotnost sodné soli sugammadexu je 2178,01. Sugammadex je první látkou, která selektivně váže svalové relaxans (selective relaxans binding agent, SRBA).
Mechanismus účinku, farmakodynamika
Během neuromuskulární blokády indukované rokuroniem vede intravenózní aplikace sugammadexu k rychlému odstranění volných molekul rokuronia z plazmy. Tím se vytváří koncentrační gradient, který urychluje pohyb zbývajících molekul
rokuronia z neuromuskulární ploténky zpět
do plazmy, kde jsou enkapsulovány volnými molekulami sugammadexu. Některé
molekuly vstupují také do tkání a tvoří kom plex s rokuroniem, proto je neuromuskulární blokáda způsobená rokuroniem rychle ukončena difuzí rokuronia z neuromuskulární ploténky zpět do plazmy. Výsledkem je zvýšení plazmatické koncentrace rokuronia (volného a vázaného na sugammadex). Vzhledem k nízké disociaci nebyla pozorována u člověka svalová slabost. Sugammadex působí jako vazebná látka a nemá žádný vliv na acetylcholinesterázu nebo na jiný receptorový komplex organismu.
Sugammadex se váže v poměru 1 : 1 s rokuroniem nebo s vekuroniem. Pro účinnou antagonizaci však není zapotřebí, aby všechny molekuly těchto svalových relaxancií vytvořily komplex se sugammadexem. Terapeutická šíře neuromuskulárního přenosu je taková, že stačí pouze 20–25 % volných postsynaptických receptorů k uskutečnění nervosvalového přenosu. Jestliže tedy sugammadex redukuje obsazení těchto receptorů ze 100 % na 70 %, stačí to k úplnému antagonizování účinku. Po indukci neuromuskulární blokády rokuroniem a úplným antagonizováním sugammadexem u anestezovaných morčat bylo zjištěno, že následné podání cisatrakuria způsobí intenzivnější neuromuskulární blokádu s nástupem účinku rychlejším, než je běžné.
Farmakokinetika
Celková plazmatická clearance sugammadexu je přibližně 120 ml/min, distribuční objem je 18 litrů. Biologický poločas trvá přibližně 100 minut. Vyloučené množství látky závisí na dávkování, během 24 hodin se močí vyloučilo 59–80 % sugammadexu.
Preklinické zkoušení
Uskutečnily se četné studie, v nichž byl sugammadex aplikován různým druhům laboratorních zvířat, především morčatům, kočkám a primátům. U makaka rhesus vede podání rokuronia v dávce 0,1 mg/kg ke 100% nervosvalové blokádě. Spontánní zotavení trvá 28 minut. Po aplikaci sugammadexu v dávce 0,5 mg/kg nastalo zotavení za 3,7 min. a při dávce 1 mg/kg
dokonce za 1,9 min. (TOF > 0,9, poměr
mezi výškou čtvrtého a prvého záškubu při testu TOF*). Je však třeba uvést, že makak je ve srovnání s člověkem citlivější na účinek rokuronia. ED 90 – účinná dávka, při jejímž podání vykazuje 90 % subjektů odpověď – je u člověka přibližně 0,3 mg/kg, u makaka pouze 0,1 mg/kg. K redukci nervosvalového bloku u člověka proto musíme podat vyšší dávku sugammadexu. Spontánní zotavení z 90% nervosvalového bloku je mnohem rychlejší u makaka než u člověka [2].
V další studii testoval de Boer a kol. [2] v pokusech na opicích makak rhesus délku biologického poločasu sugammadexu. Rokuronium podané v dávce 0,1 mg/kg vedlo ke 100% nervosvalové blokádě, poté byl podán sugammadex v dávce 1 mg/kg a během tří minut došlo k úplnému antagonizování nervosvalového bloku. Za dalších 15 minut bylo opět podáno rokuronium v dávce 0,1 mg/kg. Dosažený blok představoval pouze 17 % nervosvalové blokády, po 30 minutách 49 % a po 60 minutách 79 %. Z toho vyplývá, že biologický poločas sugammadexu u makaka rhesus je 30 minut. Opět zde musíme přihlédnout při převodu do humánní anestezie ke specifitě primátů.
*
Test train-of-four (TOF) se používá pro měření stupně neuromuskulární blokády.
Klinické zkušenosti
První klinickou studii u člověka provedli Gijsenbergh a kol. [3]. U 29 mužských dob rovolníků testovali účinnost při různém dáv kování, farmakokinetiku a výskyt nežádoucích účinků. K relaxaci byla podána intubační dávka rokuronia 0,6 mg/kg. Za tři minuty po nastoupení relaxace byl aplikován sugammadex v dávce 0,1 až 8 mg/kg. Neuromuskulární blokáda byla měřena akceleromyografem (TOF-SX, Organon). K obnovení TOF na 0,9 došlo za 2–3 minuty poté, co byl podán sugam madex v dávce 2–4 mg. Při nejvyšší dáv ce 8 mg/kg bylo dosaženo zotavení dokon ce během jedné minuty. Při aplikaci sugam madexu u neanestezovaných dobrovolní ků byl výskyt nežádoucích účinků malý. Vyskytl se mírný pokles krevního tlaku, nauzea, parestezie, změna chuti po dobu 30 minut od aplikace a sucho v ústech, které trvalo 1–2 hodiny.
Cammu a kol. [4] provedli zajímavou studii, při které podali dobrovolníkům současně sugammadex s rokuroniem nebo
s vekuroniem. V první části této studie
podali 12 dobrovolníkům, kteří byli anestezováni kombinací propofol/remifentanil, sugammadex v dávkách 16 mg/kg, 20 mg/kg nebo 32 mg/kg v kombinaci s rokuroniem v dávce 1,2 mg/kg nebo s vekuroniem v dávce 0,1 mg/kg. V druhé části klinické studie podali 4 dobrovolníkům, kteří neby li anestezováni, sugammadex v dávce 32 mg/kg v kombinaci s rokuroniem v dávce 1,2 mg/kg nebo s vekuroniem v dávce 0,1 mg/kg. Neuromuskulární funkce byla monitorována akceleromyografem (TOF-SX, Organon). Současně byly měře ny plazmatické hladiny sugammadexu a obou svalových relaxancií. Sugammadex velmi rychle eliminoval blokádu vyvolanou svalovými relaxancii; i u neanestezovaných dobrovolníků rychle snížil jejich plazmatickou hladinu, takže nebyl patrný reziduální neuromuskulární blok.
Nežádoucí účinky a interakce
Byla testována také interakce sugammadexu s ostatními molekulami. Schopnost tvorby komplexu sugammadexu s ostatními steroidními nebo nesteroidními látkami, jako je kortizon, atropin a verapamil, je pravděpodobně klinicky nevýznamná a je přibližně 120–700krát menší než u rokuronia.
Pokusy na zvířatech ukázaly, že při antagonizování neuromuskulární blokády indukované rokuroniem nedochází k podstatnému ovlivnění krevního tlaku nebo srdeční frekvence. Schopnost sugammadexu antagonizovat neuromuskulární blokádu i při současné infuzi rokuronia je unikátní charakteristikou této látky.
Závěr
Z provedených experimentů i z klinického užití vyplývají možnosti i otázky,
které zasáhnou a do určité míry změní ane steziologickou praxi. Sugammadex neúčinkuje na myorelaxancia benzylizochinolinové skupiny, jako je např. cisatrakurium. Proto je i v budoucnosti nutná dostupnost neostigminu, pokud budeme tato relaxancia používat. Sugammadex je však drahý a cena by mohla v budoucnosti omezit uží vání přípravku. Naopak neostigmin je laciný. Sugammadex je zřejmě závislý z největší části na vylučování ledvinami. Není dosud přesně známo, zda se komplex rokuroni um-sugammadex vyloučí ledvinami při jejich funkční nedo statečnosti. Cisatrakurium u renálně handicapovaných pacientů zůstane pravděpo dobně bezpečnější volbou. Navíc po podání sugammadexu bude obtížné obnovit svalovou blokádu rokuroniem nebo vekuroniem. Pro tyto situace tvoří léčiva benzylizochinolinové skupiny zálohu. Rokuronium v dávce 1 mg/kg nebo i vyš ší následované v krátkosti podáním sugam madexu může zdařile napodobit stále oceňovaný efekt suxamethonia, a to dokonce bez jeho nežádoucích účinků. Přesto není pravděpodobné, že by uvedený postup byl doporučen k rutinnímu užívání. Jeho hlavním indikačním polem by byla situace „cannot intubate, cannot ventilate". Stále proto zůstává prostor pro vývoj nedepolarizujícího relaxans, které by převzalo všechny výhody suxamethonia bez jeho nežádoucích účinků.
Experimentální a klinické studie ukazují, že použití sugammadexu představuje mílový krok. Již dnes je jisté, že přispěje ke zvýšení bezpečnosti a ke snížení výskytu reziduální blokády při užití steroidních svalových relaxancií.
Práce vznikla s podporou grantu IGA NR/9369-3.
*
Test train-of-four (TOF) se používá pro měření stupně neuromuskulární blokády.
