Svět klinických studií v ČR z pohledu SÚKL a AIFP: roční investice ve výši 1,9 miliardy korun
Klinická hodnocení jsou prestižním, náročným procesem probíhajícím ve zdravotnických zařízeních po celém světě, včetně České republiky. Poradenská společnost Ernst & Young s. r. o. (EY) provedla analýzu výzkumné aktivity inovativních farmaceutických společností sdružených v Asociaci inovativního farmaceutického průmyslu (AIFP). Investice společností do realizace klinických hodnocení v ČR v roce 2019 dosáhly 1,9 miliardy korun. V posledních letech probíhá nejvíce klinických studií v oblasti onkologie a imunologie. Charakter a typ klinických studií se však zásadně mění. Nová klinická hodnocení představují náročné projekty zaměřené na personalizovanou medicínu. S tím souvisí i častý přesun hodnocení do specializovaných nemocničních center.
Podle Mgr. Jakuba Dvořáčka, LL.M.,
MHA, výkonného ředitele AIFP, z analýzy vypracované EY
vyplynulo, že v roce 2019 bylo v České republice
společnostmi sdruženými v AIFP realizováno 389 klinických
hodnocení, 55 % z nich v oblasti onkologických
onemocnění a imunologie. Inovativní společnosti v ČR
hodnotí další léčivé přípravky, a to v oblastech:
neurologie (39 studií), kardiologie (39), revmatologie (22),
pneumologie (16), endokrinologie (17), psychiatrie (3) a v dalších
nespecifikovaných oblastech (40).
Mnohostranný význam klinických
studií
Účelem klinických studií je v první řadě validace účinnosti a bezpečnosti nových léčivých přípravků, ale není pominutelný benefit pro lékaře v podobě metodologických a terapeutických zkušeností, a především pro nemocné, kterým inovace nabízí výjimečnou léčebnou možnost.
Mgr. Zdeněk Dušek, senior manager EY, zdůrazňuje význam finančních prostředků, které díky klinickým studiím do českého zdravotnictví proudí. V roce 2019, jak už bylo zmíněno, investovaly inovativní farmaceutické společnosti v ČR celkem 1,9 miliardy korun do klinických studií, z toho zhruba 1,6 miliardy putovalo přímo do zdravotnického sektoru, necelých 100 milionů pak bylo zaplaceno na poplatcích regulátorům a etickým komisím. Ve srovnání s rokem 2017 jde o nárůst o přibližně 300 milionů korun.
Česká republika v evropském
regionu není mezi posledními
Investice do výzkumu nových léčiv (vyjádřená podílem hrubého domácího produktu, podle Organizace pro hospodářskou spolupráci a rozvoj [OECD] 2021), která probíhá v České republice, je nejvyšší ze zemí V4, je dokonce srovnatelná s Nizozemskem a Francií a jen o 0,5 procentního bodu zaostává za průměrem zemí OECD (graf 1).
„V dostupnosti inovativních
technologií se dostáváme již na úroveň vyspělých
evropských zemí, a to i v oblasti léčiv pro vzácná
onemocnění. Do České republiky nepřicházejí klinická
hodnocení z důvodu nízkých nákladů. Ty jsou sice nižší
než v sousedním Německu, nejde však o desítky pr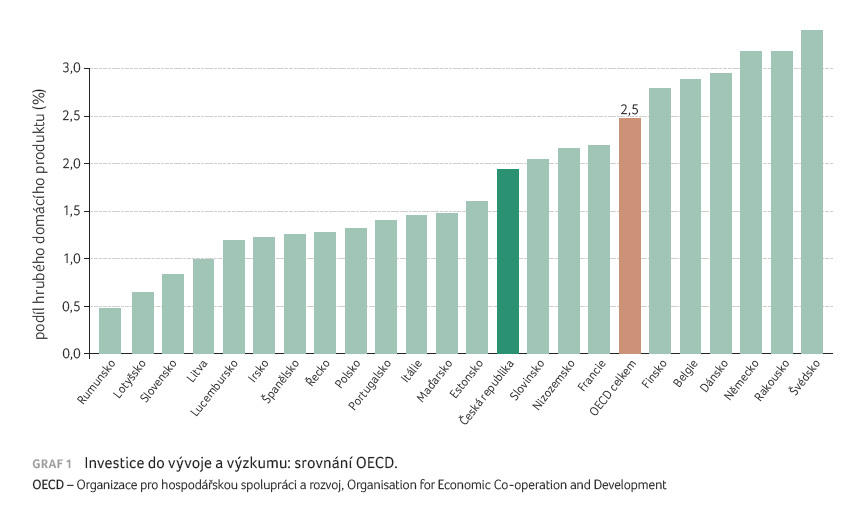 ocent,
ale o jednotlivá procenta finančních objemů. Pro zadávání
klinických studií je pro farmaceutický průmysl rozhodující
kvalita provedení studie v českých centrech. K tomu,
abychom v ČR udrželi zejména vysoce přínosná klinická
hodnocení inovativních technologií, je nezbytná podpora státu.
V každém zdravotnickém zařízení, které se podílí
na ověřování léků, by měl být zřízen tým odborníků
s adekvátními kompetencemi, který se bude zabývat výhradně
administrací klinického hodnocení. Je nutné definovat obecný
smluvní rámec, včetně administrativních a organizačních
pokynů, a zřetelně nastavit standardy spolupráce,“ uvádí
Mgr. Jakub Dvořáček.
ocent,
ale o jednotlivá procenta finančních objemů. Pro zadávání
klinických studií je pro farmaceutický průmysl rozhodující
kvalita provedení studie v českých centrech. K tomu,
abychom v ČR udrželi zejména vysoce přínosná klinická
hodnocení inovativních technologií, je nezbytná podpora státu.
V každém zdravotnickém zařízení, které se podílí
na ověřování léků, by měl být zřízen tým odborníků
s adekvátními kompetencemi, který se bude zabývat výhradně
administrací klinického hodnocení. Je nutné definovat obecný
smluvní rámec, včetně administrativních a organizačních
pokynů, a zřetelně nastavit standardy spolupráce,“ uvádí
Mgr. Jakub Dvořáček.
V roce 2019 participovalo na klinických studiích realizovaných společnostmi AIFP celkem 16 854 pacientů. Nejvíce pacientů bylo zapojeno v kardiologických (6 431), neurologických (2 151) a onkologických (1 989) studiích. Počet pacientů účastnících se jednotlivých klinických studií postupně klesá, což souvisí s vývojem poznatků o patomechanismu určitých onemocnění, kdy se původně jedna diagnóza rozpadla do několika (většinou molekulárně definovaných) chorob. Příkladem může být karcinom plic se svými molekulárními mutacemi/charakteristikami, které dávají vznik kvalitativně jiné chorobě s odlišnou léčbou.
Většinu studií, které se
realizovaly v roce 2019 v ČR, představovala klinická
(předregistrační) hodnocení fáze III (graf 2).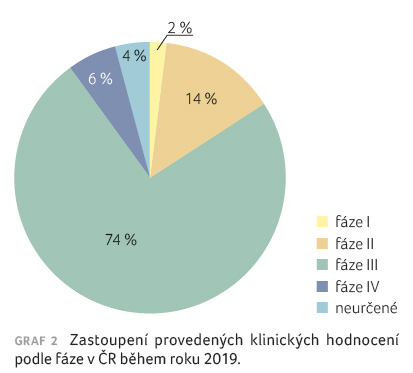
Vysoce inovativní přípravky
V roce 2020 schválila Evropská léková agentura (EMA) o 80 % více léčivých přípravků než v roce 2019, a to i přes problémy, které způsobila pandemie nemoci COVID 19. Kolem 40 % z nich tvořily tzv. orphan drugs, tedy léčiva pro vzácná onemocnění (EFPIA [European Federation of Pharmaceutical Industries and Associations] Pipeline Rewiew 2021). Léčivé přípravky EMA nově zařazené do posuzovacího procesu zahrnují především vysoce inovativní technologie, například genovou terapii, CAR T technologie, tkáňové inženýrství apod. (graf 3).
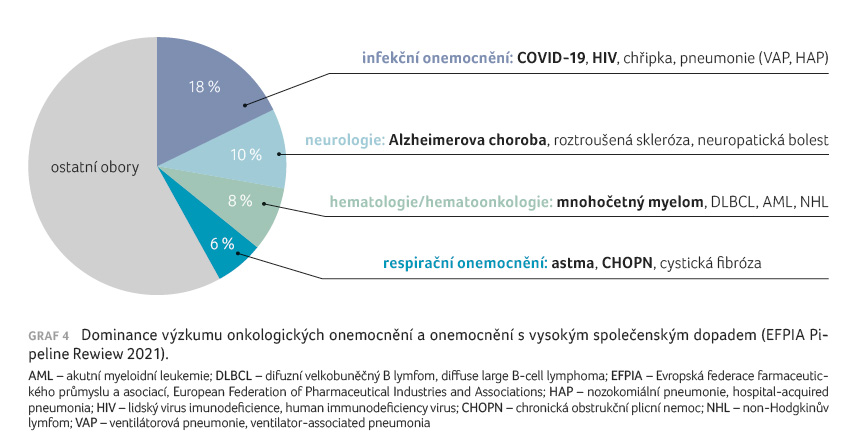
V roce 2020 bylo celosvětově
zahájeno zhruba 5 000 klinických hodnocení. V současnosti
se vyvíjí a testuje nejvíce léků pro onkologické pacienty,
ale velký důraz se klade na výzkum a vývoj léků pro
onemocnění s vysokým společenským dopadem (graf 4).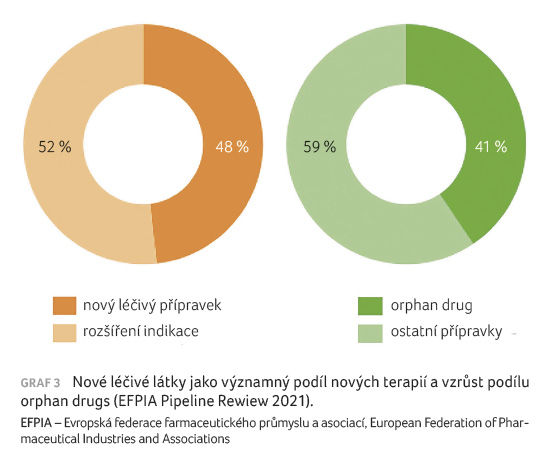
Státní ústav pro kontrolu léčiv
Státní ústav pro kontrolu léčiv
(SÚKL) nerealizuje klinická hodnocení, ale poskytuje konzultace
a metodologickou podporu, a to pro akademický sektor
zdarma. Klinická hodnocení u pacientů mohou v ČR
probíhat pouze ve zdravotnických zařízeních. Velká část
z nich se zejména dříve realizovala v ambulantní sféře
a na menších zdravotnických pracovištích. V důsledku
změn charakteru klinických hodnocení, tlaku na multidisciplinaritu
i s ohledem na čím dál komplexnější
a komplikovanější povahu výzkumných projektů se klinická
hodnocení nyní často přesouvají do velkých nemocnic
a specializovaných pracovišť, tzv. Centres of Excellence.
Nejvíce výzkumných týmů se účastní onkologických (493),
kardiologických (427) a imunologických klinických studií
(415).
SÚKL v době pandemie
Systém klinického hodnocení se v průběhu pandemie musel vyrovnávat s mnoha obtížemi. Proto vydal SÚKL v březnu 2020 (a následně 12× aktualizoval) Stanovisko odboru klinických hodnocení léčivých přípravků SÚKL k probíhajícím klinickým hodnocením a k ještě nezahájeným klinickým hodnocením v souvislosti s COVID 19.
Stanovisko zahrnovalo několik mimořádných opatření, která napomohla pokračovat v účasti v klinických hodnoceních například u onkologických pacientů s oslabenou imunitou, kteří by mohli být při cestování do center klinického hodnocení ohroženi infekcí s vážným průběhem. Jednalo se například o:
- zajištění bezpečných návštěv v centrech (covidová anamnéza, ochranné pomůcky pro zdravotníky i pacienty zajištěné zadavatelem, telefonické objednání na přesný termín apod.);
- zapojení Home Care při návštěvách v domácím prostředí pacienta, možnost podání léků, kontrolní odběry, dovoz léků;
- zajištění vzdáleného monitoringu prostřednictvím videokonference při dodržení požadavků GDPR vyplývajících ze zákona č. 110/2019 Sb. Zároveň tím došlo i k částečnému snížení administrativní zátěže zdravotnických pracovníků, která realizaci studií doprovází.
Pro SÚKL znamenala pandemie COVID 19 nutnost zajistit plynulý chod i v nouzovém stavu, a to při zvýšené agendě spojené s hlášením mimořádných opatření v probíhajících klinických hodnoceních. Byla ustanovena skupina (REG COVID 19) ze zástupců jednotlivých útvarů zapojených do monitorování a vyhodnocování situace COVID 19 nejen v ČR, ale i v EU a celosvětově. Sledoval se vývoj vakcín a léčivých přípravků na COVID 19, schválená a v databázi EU vedená klinická hodnocení přípravků na léčbu či prevenci COVID 19. Zrychlené bylo posuzování žádostí o klinické hodnocení cílené na léčbu či prevenci COVID 19. Všechny aktuální informace byly zveřejňovány na webu SÚKL v sekci COVID 19.
Celkem bylo předloženo 26 žádostí o povolení/schválení klinického hodnocení přípravku na léčbu nebo prevenci COVID 19, z nichž bylo 20 povoleno/schváleno, šest žádostí bylo staženo zadavatelem a dvě žádosti jsou ve správním řízení.
„Pandemie ukázala, že jako agentura dokážeme zvládnout krizovou situaci,“ prohlašuje ředitelka SÚKL Mgr. Irena Storová. „Naši odborníci se zapojili do evropských aktivit v mezinárodních pracovních skupinách, například při přípravě guidelines, do registračních procedur, vědeckých doporučení EMA,“ dodala Irena Storová.
Nové trendy ve vývoji, ověřování
a schvalování léčivých přípravků
Pandemie změnila výzkumné prostředí, působil zde tlak farmaceutických společností na urychlení vývoje/schválení léčivých přípravků. Mnohá mimořádná opatření budou využitelná i po skončení COVID 19 a budou zavedena do běžné praxe provádění klinických hodnocení. Příkladem je snaha o maximální elektronizaci dokumentace a sdílení dat. V budoucnosti přijdou ke slovu také virtuální/hybridní klinická hodnocení, Adaptive Platform Trials (Basket CT, Umbrela CT, Complex innovative Trial Design), což znamená, že klinická hodnocení budou zaměřena více na personalizovanou medicínu.
Koncem ledna 2022 nabude účinnosti Nařízení Evropského parlamentu a Rady (EU) č. 536/2014 ze dne 16. dubna 2014 o klinických hodnoceních humánních léčivých přípravků (a o zrušení směrnice 2001/20/ES). Nařízení přináší do oblasti klinických hodnocení zásadní změnu, která by mohla znamenat větší zájem o provádění klinických studií v EU. V ČR je Nařízení upraveno zákonem č. 66/2017, který nabude účinnosti spolu s tímto právním aktem. Vyhláška 226/2008 bude zrušena a nahrazena novou vyhláškou.
Základním rozdílem oproti stávajícími stavu je nutnost předkládat žádost o hodnocení a komunikovat pouze prostřednictvím portálu EU (pro žadatele i pro regulatorní orgány). Ke všem změnám bude SÚKL organizovat semináře pro všechny zainteresované.
Redakčně zpracovala MUDr. Marta Šimůnková