Trastuzumab emtansin
V současné době jsme svědky překotného rozvoje biologické léčby u HER2-pozitivního karcinomu prsu. Z dřívějšího zabijáka se stalo díky novým molekulám onemocnění, které je velmi dobře léčitelné a vyléčitelné. Trastuzumab emtansin je příkladem nového typu cílené terapie, kde prostřednictvím účinné protilátky je do cílové nádorové buňky vneseno velmi účinné cytostatikum, které zneškodní jen tuto nádorovou buňku. Přesvědčivé výsledky studií od fáze I do fáze III ukazují nezaměnitelnost této nové revoluční molekuly spojující přesnost protilátky, její blokádu proliferace a účinnost velmi silného cytostatika, které cílovou buňku usmrtí. Právě tato kombinace zvyšuje efektivitu léčby a snižuje rizika toxicity.
Úvod
Hledání účinné a přesně cílené terapie nádorů bylo úspěšné v konstrukci nového léčiva trastuzumab emtansinu (T-DM1) určeného pro léčbu nemocných s HER2-pozitivním (receptor 2 pro epidermální růstový faktor) karcinomem prsu. Velmi účinné cytostatikum emtansin – derivát maytansinu (DM1) – ze skupiny antimikrotubulárních cytostatik bylo navázáno na trastuzumab – protilátku proti lidskému epidermálnímu růstovému faktoru 2 (ErbB2/HER2), který se objevuje v amplifikované formě asi u 13–15 % karcinomů prsu. Před objevením trastuzumabu byla exprese ErbB2 spojena s významně kratším přežitím pacientek s karcinomem prsu. Navázání molekuly cytostatika pevnou vazbou na tuto protilátku umožnilo přímé dopravení léčiva do cílové nádorové buňky a stalo se revoluční metodou naplňující ideu léčby tzv. šité pacientovi na míru.
Mechanismus účinku
Trastuzumab emtansin (T-DM1) je konjugát tvořený rekombinantní monoklonální protilátkou a účinným cytostatikem. Tato unikátní konstrukce umožňuje zasáhnout nádorové buňky exprimující HER2, poškodit je, a to s minimalizovým negativním působením na zdravé tkáně [1]. Aby byly splněny cíle léčby, musí být vazba mezi monoklonální protilátkou a cytostatikem stabilní – v tomto případě pomocí vazebného thioetherového můstku [2].Maytansinoid DM1, jeden z mnoha derivátů antimitotické látky maytansinu, je mnohem účinnější než paklitaxel, a to 24krát až 270krát, a 2–3krát účinnější než doxorubicin. Tato látka se přímo váže na mikrotubuly, brání jejich polymerizaci a inhibuje formaci mikrotubulů, což vede k poruchám mitózy a výsledkem je apoptóza nádorové buňky, tedy její usmrcení. Thioetherový můstek, který je na dané molekule tolik unikátní, umožňuje, že tato molekula pevně váže trastuzumab kovalentní vazbou a brání předčasnému uvolnění z vazby mimo nádorovou buňku. Tím se dosáhne mnohem vyšší koncentrace účinné látky v nádorové buňce oproti zdravé tkáni, protože dojde k její expozici pouze u HER2-pozitivních buněk. Následně je zajištěn minimální vliv na zdravé tkáně a nízká systémová toxicita DM1 [3–5].
Je tak dosaženo duálního účinku tohoto konjugátu na nádorovou buňku: přímého působení trastuzumabu jako inhibitoru HER2, tj. inhibice nitrobuněčné signalizace, a prevence vzniku p95HER. Tento fragment vykazuje kinázovou aktivitu, účastní se další signalizace při růstu nádoru, p95HER je prognostickým faktorem, jeho zvýšená exprese je spojena s agresivnějším růstem tumoru.
Trastuzumab s navázanou molekulou DM1 se váže na receptor HER2 na povrchu buňky a blokuje nitrobuněčnou signalizaci [6]. Komplex receptoru HER2 a na něj vázaný T-DM1 je endocyticky internalizován do nádorové buňky [7]. Zde je potom trastuzum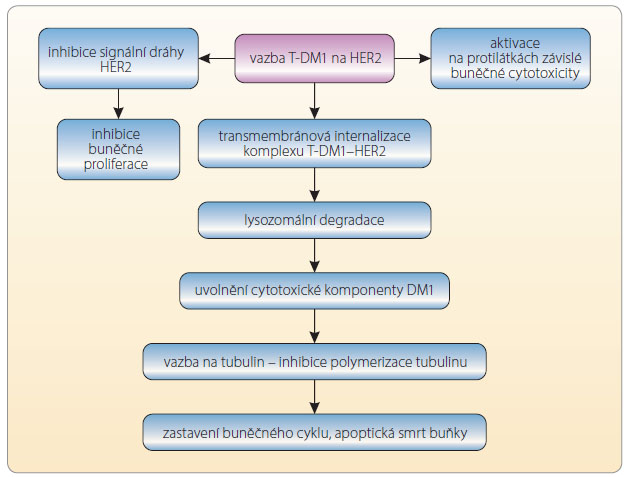 ab a jeho receptor degradován pomocí lysinu vázaného na vazebný můstek a DM1. Maytansinoid DM1 je uvolněn do nádorové buňky, kde se váže na mikrotubuly a blokuje jejich polymerizaci a svým účinkem způsobí smrt buňky, viz obr. 1. Konjugát T-DM1 si zachovává všechny účinky trastuzumabu, biologické vlastnosti včetně vazby na HER2, inhibice odštěpení mimobuněčné části HER2, snížení aktivity signalizace kinázy PI3 a aktivace buněčné cytotoxicity závislé na protilátkách. Zachovává si svůj účinek u HER-pozitivních nádorů i po selhání trastuzumabu, a je dokonce účinnější [2].
ab a jeho receptor degradován pomocí lysinu vázaného na vazebný můstek a DM1. Maytansinoid DM1 je uvolněn do nádorové buňky, kde se váže na mikrotubuly a blokuje jejich polymerizaci a svým účinkem způsobí smrt buňky, viz obr. 1. Konjugát T-DM1 si zachovává všechny účinky trastuzumabu, biologické vlastnosti včetně vazby na HER2, inhibice odštěpení mimobuněčné části HER2, snížení aktivity signalizace kinázy PI3 a aktivace buněčné cytotoxicity závislé na protilátkách. Zachovává si svůj účinek u HER-pozitivních nádorů i po selhání trastuzumabu, a je dokonce účinnější [2].
Farmakologické vlastnosti
Přípravek T-DM1 je podáván intravenózně. Pevný vazebný můstek mezi DM1 a trastuzumabem zajistí, že nedojde k uvolnění DM1 do plazmy a jeho hladiny v séru jsou velmi nízké. Díky vazebné specifitě je konjugát dopraven do nádorové tkáně a internalizován jako komplex do buněk, kde podléhá proteolýze v lysozomech a rozpadá se na emtansin a trastuzumab, který je dále také proteolyticky degradován. Katabolit obsahující DM1 je po splnění své farmakologické funkce (inhibice polymerace mikrotubulů) metabolizován v játrech enzymem CYP3A4 a v menším rozsahu enzymem CYP3A5. Neindukuje ani neinhibuje metabolismus zprostředkovaný enzymy cytochromu P450, tím se snižuje riziko lékových interakcí. V důsledku rychlé eliminace z organismu je i možná systémová toxicita DM1 nízká. Degradace probíhá v játrech, a proto poškození jaterních funkcí může zvýšit koncentraci metabolitů DM1. Z organismu je vylučován hlavně do žluče a následně stolicí nebo močí, kde probíhá odstraňování v menší míře. Poškození funkcí ledvin farmakokinetiku T-DM1 neovlivňuje [8].
Klinické studie
Prvním úkolem bylo stanovit účinnou a bezpečnou dávku T-DM1. V klinické studii TDM3569g [9, 10] byl T-DM1 podáván v monoterapii s eskalací dávky. Pacientkám s HER2-pozitivním lokálně pokročilým nebo metastatickým karcinomem prsu s progresí při léčbě anti-HER2 (trastuzumab) byl podáván T-DM1 v dávce 0,3 mg/kg až 4,8 mg/kg každé tři týdny (n = 24) nebo T-DM1 v dávce 1,2 mg/kg až 2,9 mg/kg jednou týdně (n = 28). Primárním cílem bylo stanovit limitující dávku určenou toxicitou, bezpečným podáním a farmakokinetikou. Sekundárními cíli byla četnost odpovědí, trvání odpovědi a přežití bez progrese.
Výsledkem studie bylo stanovení maximální tolerované dávky 3,6 mg/kg při podávání každé tři týdny a 2,4 mg/kg při podávání jednou týdně. Limitující toxicitou v obou skupinách pacientů byla trombocytopenie a dalšími nejčastějšími nežádoucími účinky byly elevace aktivity transamináz, únava, anémie a nauzea. Tyto nežádoucí příhody dosahovaly zpravidla stupně 1 až 2 a byly reverzibilní. Žádné kardiální nežádoucí účinky a ovlivnění kardiálních funkcí, které by si vyžádaly úpravu dávky, nebyly zaznamenány. Klinický přínos dosáhl 57 % (týdenní režim) a 50 % (třítýdenní režim).
Ve studii fáze Ib nazvané TDM4652g byla zkoumána eskalace dávky T-DM1 v kombinaci s paklitaxelem a pertuzumabem nebo bez pertuzumabu. Ve čtyřech ramenech studie byly porovnány eskalace dávky T-DM1 a vliv přidání paklitaxelu a pertuzumabu k léčbě [11]. Kombinace T-DM1 a paklitaxelu s pertuzumabem nebo bez pertuzumabu vykázala povzbudivou aktivitu u pacientek s předléčeným HER2-pozitivním metastatickým karcinomem. Kombinace T-DM1 a paklitaxelu s pertuzumabem nebo bez pertuzumabu měla zvladatelný profil toxicity. Maximální tolerované dávky T-DM1 v těchto kombinacích jsou ekvivalentní maximálním tolerovaným dávkám T-DM1 v monoterapii při režimu podávání jednou týdně a každé tři týdny (2,4 mg/kg a 3,6 mg/kg).
Incidence trombocytopenie a vzestupu hodnot jaterních transamináz v séru byla podobná jako při monoterapii T-DM1. Nebyly pozorovány neočekávané příznaky toxicity při podání T-DM1, paklitaxelu nebo pertuzumabu.
Kombinaci léčby T-DM1 s pertuzumabem dále hodnotila studie fáze Ib/II označená jako TDM4373g [12]. Do studie byly zařazeny pacientky s HER2-pozitivním, lokálně pokročilým nebo metastatickým karcinomem prsu (n = 67) po předchozí léčbě trastuzumabem (n = 46) nebo po první linii chemoterapie (n = 21). V první části studie byla eskalována dávka T-DM1 z 3,0 mg na 3,6 mg a ve druhé fázi již byl T- DM1 podáván v dávce 3,6 mg. Tato studie ukazuje, že riziko možné lékové interakce je při kombinaci pertuzumabu a T-DM1 nízké [12]. Ve studii TDM4374g se silně předléčenými pacientkami byl T-DM1 podáván v monoterapii do progrese. Monoterapie T-DM1 vykázala významnou a trvající protinádorovou aktivitu u pacientek s HER2-pozitivním metastatickým karcinomem prsu, které byly dříve léčeny oběma standardními léky anti-HER2. Četnost odpovědí dosáhla dle nezávislého hodnocení 34,5 % a přežití bez progrese 6,9 měsíce. Přípravek T-DM1 byl v testovaných dávkách a režimech dobře snášen, bez omezení dávky limitované kardiotoxicitou [14].
Studie TDM4450g [15] je první randomizovanou studií hodnotící konjugát protilátka-cytostatikum v léčbě HER2-pozitivního metastatického karcinomu prsu; v první linii této léčby prokázal konjugát T-DM1 ve srovnání se standardní léčbou kombinací trastuzumab a docetaxel významné prodloužení doby bez progrese (14,2 měsíce vs. 9,2 měsíce; poměr rizik, hazard ratio – HR: 0,594; p = 0,0353). Četnost odpovědí byla obdobná u obou ramen (64,2 % vs. 58,0 %), ale průměrné trvání odpovědi bylo v rameni docetaxel plus trastuzumab 9,5 měsíce, zatímco v rameni s T-DM1 nebylo této průměrné hodnoty dosaženo. Toxicita byla při léčbě T-DM1 významně nižší, jak ukazuje počet nežádoucích příhod stupně 3 a více (46,4 % vs. 89,4 %). Byla ověřena hypotéza, že unikátní vlastnosti T-DM1 mohou zlepšit terapeutický index, a tohoto výsledku bylo docíleno díky jedinečnosti molekuly, která cíleně dopravuje účinnou látku do nádorové buňky.
Studie fáze III nazvaná EMILIA [16] porovnala účinnost léčby kombinací kapecitabin plus lapatinib versus T-DM1 u pacientek s progredujícím HER-pozitivním karcinomem prsu, viz graf 1. Ve studii EMILIA bylo léčbou T-DM1 dosaženo významného zlepšení doby přežití bez progrese, kde střední doba přežití bez progrese byla v případě léčby kombinací kapecitabin plus lapatinib 6,4 měsíce, zatímco při léčbě T-DM1 dosahovala tato doba 9,6 měsíce (HR: 0,65; p < 0,![Graf 1 Křivka přežití bez progrese dle hodnocení nezávislými řešiteli; volně podle [16] − Verma, et al., 2012. CI – interval spolehlivosti (confidence interval); HR – hazard ratio; T-DM1 – trastuzumab emtansin](https://www.remedia.cz/photo-a-29965---.jpg) 0001). Celkové přežití v rameni s léčbou T-DM1 dosáhlo 30,9 měsíce proti 25,1 měsíce u pacientek léčených kombinací kapecitabin plus lapatinib (HR: 0,682; p = 0,0006). Hodnocení bezpečnosti favorizuje opět T-DM1 a počet nežádoucích příhod stupně 3 a vyššího představoval v rameni s T-DM1 41 % proti 57 % u pacientek v kontrolním rameni. Také počet odpovědí byl pro T-DM1 příznivý a rozdíl dosáhl 12,7 % a délka trvání odpovědi dosáhla ve skupině s T-DM1 12,6 měsíce (8,4–20,8) proti kontrolnímu rameni, kde byla výrazně kratší – 6,5 měsíce (5,5–7,2). Dosavadní výsledky všech studií ukazují, že T-DM1 je významnou možností léčby HER2-pozitivního metastatického karcinomu prsu.
0001). Celkové přežití v rameni s léčbou T-DM1 dosáhlo 30,9 měsíce proti 25,1 měsíce u pacientek léčených kombinací kapecitabin plus lapatinib (HR: 0,682; p = 0,0006). Hodnocení bezpečnosti favorizuje opět T-DM1 a počet nežádoucích příhod stupně 3 a vyššího představoval v rameni s T-DM1 41 % proti 57 % u pacientek v kontrolním rameni. Také počet odpovědí byl pro T-DM1 příznivý a rozdíl dosáhl 12,7 % a délka trvání odpovědi dosáhla ve skupině s T-DM1 12,6 měsíce (8,4–20,8) proti kontrolnímu rameni, kde byla výrazně kratší – 6,5 měsíce (5,5–7,2). Dosavadní výsledky všech studií ukazují, že T-DM1 je významnou možností léčby HER2-pozitivního metastatického karcinomu prsu.
Bezpečnost a snášenlivost
Mezi nejčastější nežádocí účinky léčby T-DM1 patří únava, nevolnost, trombocytopenie, poruchy jaterních funkcí, vzestup aktivity jaterních transamináz (aspartátaminotransferázy – AST, alaninaminotransferázy – ALT). Nežádoucí účinek trombocytopenie stupně 3 a 4 byl zaznamenán ve studii EMILIA u 12,9 % a vzestup hodnot AST u 4,3 % léčených a hodnot ALT u 2,9 % léčených. Trombocytopenie stupně 3 a 4 byla zaznamenána po prvních dvou cyklech a většina pacientů mohla po redukci dávky pokračovat v léčbě. Pouze 2 % pacientů (celkově 10) musela léčbu přerušit. Krvácení spojené s trombocytopenií bylo zaznamenáno u 29,8 %, ale stupně 3 a 4 dosáhlo pouze u 1,4 % léčených. Byl zjištěn pouze jeden případ gastrointestinálního krvácení stupně 4. K vzestupu hodnot AST na stupeň 3 a 4 došlo u tří pacientů, kteří museli léčbu přerušit. V žádném případě nebylo zaznamenáno lékové poškození jater. Kardiotoxicita byla sledována velmi pečlivě a v průběhu léčby T-DM1 došlo u osmi pacientů (1,7 %) k poklesu ejekční frakce o 15 %. Stupeň 3 dysfukce levé srdeční komory byl zaznamenán u jednoho pacienta. K úmrtí spojenému s aplikací T-DM1 nedošlo. Podání T-DM1 je z tohoto pohledu bezpečné s minimálním počtem závažných reakcí.
Indikace
T-DM1 je indikován k léčbě pacientek s HER2-pozitivním neresekovatelným lokálně pokročilým nebo metastatickým karcinomem prsu, které byly dříve léčeny trastuzumabem a taxanem (samostatně nebo v kombinaci). Jednoznačně pozitivní výsledky studií fáze III zařadily tuto látku prozatím do 2. linie léčby metastatického karcinomu prsu po selhání předchozí léčby s trastuzumabem. V jakém postavení bude vůči lapatinibu? Bude TDM-1 zařazen před tuto látku, nebo po ní? Data studií ukazují, že bude zařazen do léčby před použitím lapatinibu. V současné době probíhají studie, které již zařazují TDM-1 do adjuvantní a neoadjuvantní léčby. Do jaké míry budou tyto výsledky lepší než duální blokáda receptorů HER2, ukáže čas. Zatím je novou nadějí pro ženy s HER2-pozitívním karcinomem, u nichž dochází při podávání standardní léčby k relapsu onemocnění.
Dávkování a způsob podání
Přípravek T-DM1 v dávce 3,6 mg/kg se podává nitrožilně každé 3 týdny, ve studiích byla zaznamenána redukce dávky na 3,0 mg/kg a 2,4 mg/kg bez omezeí účinnosti [15]. Léčba je podávána do progrese onemocnění nebo do nepřijatelné toxicity.
Závěr
Trastuzumab emtansin je lék, jehož úspěšnost byla prokázána napříč heterogenní populací pacientek s HER2-pozitivním karcinomem prsu, která byla léčena pro pokročilý a metastatický karcinom prsu již trastuzumabem a taxany. Léčba je úspěšná při podání v pozdních liniích a přináší významné celkové prodloužení života pacientů a období bez progrese onemocnění.
Seznam použité literatury
- [1] Gerber HP, Senter PD, Grewal IS, et al. Antibody drug-conjugates targeting the tumor vasculature: Current and future developments. mAbs 2009; 1: 247–253.
- [2] Junttila TT, Li G, Parsons K, et al. Trastuzumab-DM1 (T-DM1) retains all the mechanisms of action of trastuzumab and efficiently inhibits growth of lapatinib insensitive breast cancer. Br Cancer Res 2011; 128: 347–356.
- [3] Hudis CA. Trastuzumab: mechanism of action and use in clinical practice. N Engl J Med 2007; 357: 39–51.
- [4] Barok M, Tanner M, Köninki K, et al. Trastuzumab-DM1 is highly effective in preclinical models of HER2-positive gastric cancer. Cancer Lett 2011; 306: 171–179.
- [5] Burris HA 3rd, Rugo HS, Vukelja SJ, et al. Phase II study of the antibody drug conjugate trastuzumab-DM1 for the treatment of human epidermal growth factor receptor 2 (HER2)-positive breast cancer after prior HER2-directed therapy. J Clin Oncol 2010; 29: 398–405.
- [6] Lewis Phillips GD, Li G, Dugger DL, et al. Targeting HER2-positive breast cancer with trastuzumab-DM1, an antibody-cytotoxic drug conjugate. Cancer Res 2008; 68: 9280–9290.
- [7] Erickson HK, Park PU, Widdison WC, et al. Antibody-maytansinoid conjugates are activated in targeted cancer cells by lysosomal degradation and linker-dependent intracellular processing. Cancer Res 2006; 66: 4426–4433.
- [8] Girish S, Gupta M, Wang B. Clinical pharmacology of trastuzumab emtansine (T-DM1): an antibody-drug conjugate in development for the treatment of HER2-positive cancer. Cancer Chemother Pharmacol 2012; 69: 1229–1240.
- [9] Krop IE, Beeram M, Modi S, et al. Phase I study of trastuzumab-DM1, an HER2 antibody-drug conjugate, given every 3 weeks to patients with HER2-positive metastatic breast cancer. J Clin Oncol 2010; 28: 2698–2704.
- [10] Modi S, Beeram M, Krop IE, et al. A phase I study of trastuzumab-DM1 (T-DM1), a first-in-class HER2 antibody-drug conjugate (ADC), in patients (pts) with advanced HER2+ breast cancer (BC). J Clin Oncol 2008; 26 (Suppl; abstr 1028).
- [11] Krop IE, Modi S, Elias A, et al. A dose-escalation study of trastuzumab-DM1 (T-DM1), paclitaxel (T), and pertuzumab (P) in patients with HER2-positive, locally advanced or metastatic breast cancer (MBC) previously treated with a trastuzumab-containing regimen. Cancer Res 2010; 70 (24 suppl Abstract/poster P3-14-10), p 295s.
- [12] Miller K, Gianni L, Andre F, et al. A phase Ib/II trial of trastuzumab-DM1 (T-DM1) with pertuzumab (P) for women with HER2-positive, locally advanced or metastatic breast cancer (BC) who were previously treated with trastuzumab (T). J Clin Oncol 2010; 28 (Suppl; abstr 1012).
- [13] Burris HA, Lu D, Dees EC, et al. Pharmacokinetic (PK) interaction potential of trastuzumab-DM1 (T-DM1) and pertuzumab (P) in pts with HER2-positive, locally advanced or MBC: results from a phase 1b/2 study. Cancer Res 2010; 70 (24 suppl Abstract/poster P3-14-06), p 293s.
- [14] Krop IL, Miller KD. A phase 2 study of the HER2 antibody-drug conjugate trastuzumab-DM1 (T-DM1) in patients (pts) with HER2-positive metastatic breast cancer (MBC) previously treated with trastuzumab, lapatinib, and chemotherapy. [Abstract 2770]. Presented at: 35th ESMO Congress; 8-12 October 2010, Milan, Italy.
- [15] Hurvitz SA, Dirix L, Kocsis J, et al. Trastuzumab Emtansine (T-DM1) Vs Trastuzumab plus Docetaxel (H + T) in Previously-untreated HER2-positive Metastatic Breast Cancer (MBC): Primary Result of a Randomized, Multicenter, Open-label Phase II Study (TDM4450 g/BO21976). Eur J Cancer 2011; 47 (Suppl 330): Abstract 5001.
- [16] Verma S, Miles D, Gianni L, et al. Trastuzmab Emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012; 367: 1783–1791.