Tváří v tvář spondyloartritidě
Odborný program 66. výročního sjezdu českých a slovenských revmatologů, který se konal 12.–14. října 2023 v Hradci Králové, byl nabitý přednáškami. Odborná veřejnost si mohla poslechnout, co zajímavého se v dalším roce událo v oboru revmatologie a kam se posunuly dosavadní znalosti. Satelitní sympozium společnosti UCB obrátilo svoji pozornost na léčbu spondyloartritid (SpA).
První duální inhibitor IL‑17A/F v léčbě SpA aneb Autoimunita pod dvojitou palbou
Prvního sdělení se ujal prof. MUDr. Ladislav Šenolt, Ph.D., (Revmatologický ústav, Praha). V úvodu připomněl, že v patogenezi SpA hraje roli několik aspektů. Při genetické predispozici je tvorba interleukinu (IL) 23 a dalších cytokinů spuštěna na podkladě vnějších podnětů, jimiž mohou být např. narušený mikrobiom či nízkozátěžové trauma v oblasti entezí. Interleukin 23 a další cytokiny se vážou na své receptory na T lymfocytech a stimulují tvorbu IL‑17 a tumor nekrotizujícího faktoru (TNF). Zvýšená tvorba prozánětlivých cytokinů a aktivace buněk přirozené imunity vede k tvorbě chronického zánětu. IL‑23/IL‑17, TNF a signalizace JAK/STAT aktivují efektorové buňky k úbytku kosti, osteoprodukci a zánětu.
Spondyloartritida představuje skupinu zánětlivých onemocnění. Jednotlivé podtypy onemocnění sdílejí klinické a imunologické rysy. Etiologie SpA je stále předmětem výzkumu. Je známo, že v patogenezi SpA hraje významnou úlohu dráha IL‑17. Tento interleukin byl objeven před třiceti lety. Zhruba před dvaceti lety byl objeven IL‑23 a popsán jeho aktivační účinek na T lymfocyty a polarizaci Th17 buněk, které tvoří IL‑17 a další působky. Od roku 2010 probíhaly klinické studie s anti‑IL‑17 léčbou u pacientů s revmatoidní artritidou (RA). V léčbě tohoto onemocnění však byly výsledky klinických hodnocení protichůdné, významná role IL‑17 byla ale následně popsána v imunopatologických pochodech u psoriatické artritidy (PsA) a axiální SpA.
Interleukin 17 není pouze cytokinem s úlohou v patogenezi autoimunitního zánětu. Jeho důležitou biologickou funkcí je účast v obranychopnosti a obrana hostitele proti houbovým a extracelulárním bakteriálním infekcím indukcí sekrece prozánětlivých a/nebo antimikrobiálních mediátorů. Tento účinek vídáme při léčbě namířené proti IL‑17 v podobě nežádoucích účinků, kdy se s vyšší frekvencí vyskytuje např. orální kandidóza.
Rodina IL‑17 se skládá z IL‑17A, IL‑17B, IL‑17C, IL‑17D, IL‑17E a IL‑17F, které tvoří dimery (heterodimery nebo homodimery) a takto aktivují jednotlivé receptory. Nejlépe prostudovaným je IL‑17A, který má ze šesti členů rodiny nejsilnější homologii s IL‑17F (> 50 %) a také překrývající se biologické funkce. IL‑17F a IL‑17A jsou exprimovány v místech zánětu a nezávisle spolupracují s dalšími cytokiny (např. TNF) při zprostředkování chronického zánětu.
IL‑17 je produkován různými buňkami vrozené a adaptivní imunity. Tyto buňky uvolňují IL‑17 v reakci na infekci a zánět podle specifičnosti buněk a typů onemocnění. IL‑17 zprostředkovává svou imunologickou funkci indukcí sekrece prozánětlivých molekul. Tento proces spouští nábor vrozených imunitních buněk do místa infekce s cílem odstranit patogen. Obdobně se může IL‑17 podílet na podpoře zánětu u imunitně zprostředkovaných onemocnění.
Výsledky klinických studií u pacientů s ankylozující spondylitidou (AS) potvrdily, že IL‑17 může být produkován nezávisle na IL‑23. Inhibice IL‑23 tak nevede ke kompletní inhibici IL‑17. Stejně tak inhibice IL‑17A netlumí homodimerní IL‑17F; duální inhibice IL‑17A/F má proto širší záběr. In vitro modely PsA a axiální SpA doložily, že duální inhibice IL‑17A/F vede k utlumení exprese prozánětlivých genů synoviálních fibroblastů, ke snížené migraci buněk adaptivní i vrozené imunity i k redukci novotvorby kosti z periostálních kmenových buněk [1,2].
Profesor Šenolt dále vyzdvihl výsledky klinického hodnocení inhibitoru IL‑17A/F bimekizumabu. Efekt tohoto biologického léčiva u PsA hodnotily studie BE ACTIVE (fáze II), BE OPTIMAL a BE COMPLETE (fáze III). U axiální SpA to byly studie BE AGILE (fáze II), BE MOBILE 1 a 2 (fáze III).
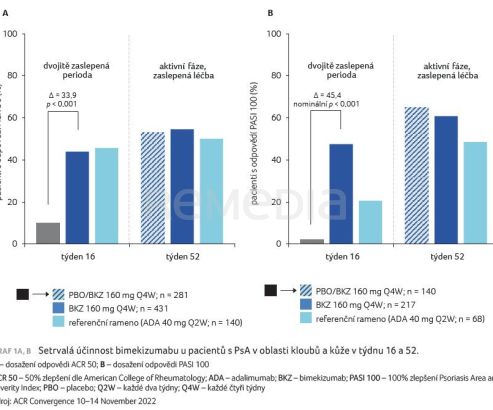 Ve studii BE OPTIMAL u pacientů s PsA naivních k biologické terapii vedla léčba bimekizumabem v porovnání s placebem k výraznému zlepšení v oblasti kloubů, kůže i radiografického zobrazení [3]. Efekt léčby bimekizumabem na kůži i klouby přetrvával až do 52. týdne sledování (graf 1A, B).
Ve studii BE OPTIMAL u pacientů s PsA naivních k biologické terapii vedla léčba bimekizumabem v porovnání s placebem k výraznému zlepšení v oblasti kloubů, kůže i radiografického zobrazení [3]. Efekt léčby bimekizumabem na kůži i klouby přetrvával až do 52. týdne sledování (graf 1A, B).
Při porovnání se secukinumabem, který selektivně inhibuje pouze IL‑17A, vedla u pacientů se středně těžkou až těžkou psoriázou léčba bimekizumabem po dobu 16 a 48 týdnů k výraznějšímu vyčištění kůže než léčba secukinumabem. Léčbu provázel častější výskyt orální kandidózy (převážně mírné nebo střední závažnosti) [4].
U pacientů s PsA, u nichž selhala léčba inhibitorem TNF nebo kteří tuto léčbu netolerovali, vedla léčba bimekizumabem k výraznějšímu zlepšení hodnocených výsledků v oblasti kloubů a kůže oproti placebu [5].
![GRAF 2A, B Efekt léčby bimekizumabem (dosažení odpovědi ASAS 40) v klinických studiích BE MOBILE 1 (A) a BE MOBILE 2 (B); podle [6] – van der Heijde, et al., 2023. GRAF 2A, B Efekt léčby bimekizumabem (dosažení odpovědi ASAS 40) v klinických studiích BE MOBILE 1 (A) a BE MOBILE 2 (B); podle [6] – van der Heijde, et al., 2023.](https://www.remedia.cz/photo-pg-1212---.jpg) Účinnost a bezpečnost bimekizumabu u pacientů s axiální SpA sledovaly dvojitě zaslepené studie fáze III BE MOBILE 1 (non‑radiografická axiální SpA) a BE MOBILE 2 (radiografická forma) [6]. Duální inhibice IL‑17A/F bimekizumabem vedla k významnému a rychlému zlepšení parametrů účinnosti oproti placebu (graf 2A, B) a byla dobře tolerována u pacientů s non‑radiografickou i radiografickou formou onemocnění. Dosažení odpovědi ASAS 40 (40% zlepšení dle Assessment in SpondyloArthritis International Society) bylo rovněž posuzováno z hlediska předchozí léčby a ukázalo se, že pacienti dříve léčení inhibitory TNF měli stejnou, ne‑li lepší míru dosažení odpovědi.
Účinnost a bezpečnost bimekizumabu u pacientů s axiální SpA sledovaly dvojitě zaslepené studie fáze III BE MOBILE 1 (non‑radiografická axiální SpA) a BE MOBILE 2 (radiografická forma) [6]. Duální inhibice IL‑17A/F bimekizumabem vedla k významnému a rychlému zlepšení parametrů účinnosti oproti placebu (graf 2A, B) a byla dobře tolerována u pacientů s non‑radiografickou i radiografickou formou onemocnění. Dosažení odpovědi ASAS 40 (40% zlepšení dle Assessment in SpondyloArthritis International Society) bylo rovněž posuzováno z hlediska předchozí léčby a ukázalo se, že pacienti dříve léčení inhibitory TNF měli stejnou, ne‑li lepší míru dosažení odpovědi.
Co se týče bezpečnosti, je profil bimekizumabu podobný jako u jiných inhibitorů IL‑17. Častěji oproti placebu byl v klinických studiích zaznamenán výskyt nazofaryngitidy, infekcí dýchacích a močových cest a orální kandidózy. Nebyly pozorovány žádné závažné kardiovaskulární nežádoucí účinky ani úmrtí.
Přednášející shrnul, že bimekizumab prokázal účinnost a přijatelnou bezpečnost v léčbě pacientů se SpA a v léčbě psoriázy vyšší účinnost v porovnání se secukinumabem, ustekinumabem a secukinumabem.
RHEUM OFF: Inhibitory TNF vs. inhibitory IL‑17 v léčbě spondyloartritid
Prof. MUDr. Jiří Vencovský, DrSc., (Revmatologický ústav, Praha) a prof. MUDr. Želmíra Macejová, PhD., MPH, (I. interná klinika UPJŠ LF a UNLP, Košice) se ve svém vystoupení zaměřili na praktické využití řešené problematiky. Představili celkem sedm případů z praxe, u nichž diskutovali volbu terapie.
Kazuistika 1
První případ, muž, nyní 38 let, s 15letou anamnézou bolestí v zádech a velkých kloubech. Před sedmi lety u něj byla diagnostikována non‑radiografická axiální SpA (hodnota C‑reaktivního proteinu [CRP] 28, Bath Ankylosing Spondylitis Disease Activity Index [BASDAI] 5,5, sakroiliitida na magnetické rezonanci [MRI]), artritida ramene, asi i kyčle. Léčba sulfasalazinem v minulosti byla bez efektu, léčba nesteroidními antirevmatiky (NSA) jen s malým efektem. Dále byl pacient sedm let léčen adalimumabem s velmi dobrým efektem, nicméně v poslední době došlo opět ke zvýšení hodnot CRP a ke vzestupu skóre BASDAI na 4. Profesor Vencovský diskutoval jako následnou léčebnou volbu inhibitor IL‑17.
Aktuálně jsou k dispozici inhibitory IL‑17A secukinumab a ixekizumab a inhibitor IL‑17A/F bimekizumab. Přípravky jsou shodně indikovány k léčbě dospělých s aktivní non‑radiografickou axiální SpA s objektivními známkami zánětu (indikováno zvýšenou hladinou CRP a/nebo MRI), kteří nereagují adekvátně na NSA nebo tuto terapii netolerují. Žádný z přípravků však nemá v současné době pozitivní doporučení v indikačních omezeních Státního ústavu pro kontrolu léčiv.
![GRAF 3A, B Dosažení nízké aktivity onemocnění (ASDAS < 2,1) v týdnu 52 u pacientů s non‑radiografickou (A) a radiografickou axiální spondyloartritidou (B); podle [7] – Baraliakos, et al., 2022. GRAF 3A, B Dosažení nízké aktivity onemocnění (ASDAS < 2,1) v týdnu 52 u pacientů s non‑radiografickou (A) a radiografickou axiální spondyloartritidou (B); podle [7] – Baraliakos, et al., 2022.](https://www.remedia.cz/photo-pg-1215---.jpg) Přednášející prezentoval doklady o účinnosti bimekizumabu u pacientů se SpA. Extenze klinických studií BE MOBILE 1 a 2 demonstrovaly setrvalou účinnost bimekizumabu včetně potlačení zánětu a zlepšení funkce a kvality života až do týdne 52 u celého spektra onemocnění axiální SpA (u non‑radiografické i radiografické formy) [7]. Nízké aktivity onemocnění (ASDAS < 2,1) bylo po 52 týdnech dosaženo u 61,6 % pacientů s non‑radiografickou a u 57,1 % nemocných s radiografickou axiální SpA, (graf 3A, B).
Přednášející prezentoval doklady o účinnosti bimekizumabu u pacientů se SpA. Extenze klinických studií BE MOBILE 1 a 2 demonstrovaly setrvalou účinnost bimekizumabu včetně potlačení zánětu a zlepšení funkce a kvality života až do týdne 52 u celého spektra onemocnění axiální SpA (u non‑radiografické i radiografické formy) [7]. Nízké aktivity onemocnění (ASDAS < 2,1) bylo po 52 týdnech dosaženo u 61,6 % pacientů s non‑radiografickou a u 57,1 % nemocných s radiografickou axiální SpA, (graf 3A, B).
Připomenut byl též dobrý efekt léčby prezentovaný v předchozí přednášce i po selhání léčby inhibitory TNF, což je také případ prvního pacienta.
Přednášející se shodli, že u SpA má na rozdíl od RA další přípravek obvykle dobrý efekt. Profesorka Macejová doložila tyto závěry na výsledcích studie RAPID‑axSpA [8], v níž certolizumab pegol (CZP) potvrdil setrvalou účinnost i u pacientů již dříve léčených inhibitory TNF. U prvního případu je tedy bez jasného vodítka na domluvě s pacientem, kterou další léčbu zvolit.
Kazuistika 2
Druhý případ (z publikace [9]) představuje aktivního 63letého pacienta s více než 20letou anamnézou AS. V roce 2010 byl zvažován infliximab. Test Quantiferon vyšel s pozitivním výsledkem, pacient byl léčen devět měsíců isoniazidem a následně byla zahájena terapie infliximabem. V roce 2013 byla u nemocného diagnostikována tuberkulóza centrálního nervového systému. Kvůli aktivitě byl dále léčen jen prednisonem. Po šesti letech vyvinul nekrózy obou hlavic humerů, nejspíše v souvislosti s touto terapií. Terapie prednisonem byla ukončena. Otázkou je opět, kterou další léčbu indikovat.
Profesor Vencovský se nejprve zaměřil na problematiku tuberkulózy a její možnou reaktivaci v souvislosti s léčbou. Rozsáhlá práce hodnotící možnou souvislost léčby secukinumabem s reaktivací tuberkulózy u pacientů s psoriázou, PsA nebo AS sledovala více než 12 tisíc pacientů. Před léčbou bylo 5,6 % pacientů pozitivních na latentní infekci tuberkulózy (LTBI – dle TST či Quantiferon). Pacienti dostali profylaktickou terapii. Během pěti let sledování byla LTBI jako nežádoucí účinek ohlášena u 13 nemocných, v sedmi případech se objevila nově. Nikdo nedostal aktivní tuberkulózu. U pacientů s AS mělo anamnézu aktivní tuberkulózy před zahájením terapie 10 % nemocných, u pacientů s psoriázou a PsA jen 1 % [10]. Ani u pacientů léčených bimekizumabem nebyl v registračních studiích zaznamenán žádný případ aktivní tuberkulózy [7]. Z tohoto pohledu se tedy léčba anti‑IL‑17 jeví jako bezpečná.
Profesorka Macejová naproti tomu upozornila na zaznamenané případy výskytu tuberkulózy při léčbě CZP [11] a v souvislosti s tím na potřebu opatrnosti při léčbě inhibitory TNF v tomto případě.
Kazuistika 3
Třetí případ představuje opět vyhledaná kazuistika [12], 33letá pacientka s potvrzenou AS léčená NSA, sulfasalazinem a metotrexátem, BASDAI 6,2, BASFI 5,3. Dále byla léčena golimumabem (50 mg s.c. 1× měsíčně) s výborným efektem na projevy AS. Po páté injekci došlo do 24 hodin k vývoji erythema nodosum na dolních končetinách. Pacientka léčena prednisonem bez většího efektu, nutná vyšší dávka. Léčbu golimumabem odmítla přerušit pro dobrý efekt této terapie. V časové souvislosti s podáním inhibitoru TNF se ale vždy objevilo zhoršení erythema nodosum s nutností podání vyšších dávek prednisonu, což profesor Vencovský nepovažuje za optimální přístup, a k diskusi je další léčba.
U této pacientky by přednášející byli s léčbou anti‑IL‑17 opatrní. U erythema nodosum existuje spojitost se zánětlivým onemocněním střev (IBD), a i když se u této pacientky IBD nerozvinulo, není v budoucnu rozvoj této choroby vyloučen a je žádoucí se tomu snažit předejít. Dle aktuálních doporučení není u pacientů s mimokloubními manifestacemi typu IBD léčba anti‑IL‑17 doporučena [13]. Navrženo je proto pokračovat v tomto případě v léčbě jiným přípravkem ze skupiny inhibitorů TNF.
Kazuistika 4
Čtvrtým případem je muž, který byl poprvé diagnostikován s pokročilou AS v 53 letech, současně u něj byl diagnostikován SAPHO syndrom (synovitida, akné, pustulóza, hyperostóza a osteitida) [14]. Byl léčen adalimumabem s efektem na AS a pustulózu, ale během tří měsíců pacient vyvinul silnou paradoxní psoriázu na ploskách nohou a v dlaních. Terapii adalimumabem bylo nutno ukončit. Zahájena byla terapie secukinumabem s rychlým efektem na projevy SAPHO i AS, došlo k plné klinické i laboratorní remisi obou onemocnění. Dle prof. Vencovského zůstává otázkou, zda se nejednalo o jedno onemocnění, protože i u SAPHO syndromu bývá přítomna sakroiliitida a některé projevy AS. Každopádně nasazená léčba přinesla žádoucí efekt.
Kazuistika 5
Další kazuistika prezentuje 46letou ženu s PsA, občasnými entezitidami a daktylitidou. Těžké kožní postižení lupenkou zaujímá více než 20 % těla, v anamnéze jsou opakované vulvovaginální kandidózy. Pacientka byla léčena adalimumabem se zmírněním artritidy, entezitidy a daktylitida vymizely. Došlo k ústupu projevů lupenky na kůži, ale ne k dosažení normy. Po dvou letech došlo ke ztrátě efektu adalimumabu a nález se začal horšit. Kterou další terapii zvolit – jiný inhibitor TNF, nebo přípravek s jiným mechanismem účinku?
![GRAF 4A–C Dosažení odpovědi PASI 100 při léčbě bimekizumabem v porovnání s léčbou ustekinumabem (A), adalimumabem (B) a secukinumabem (C); podle [4,15,16] – Reich, et al., 2021; Reich, et al., 2021; Warren, et al., 2021. GRAF 4A–C Dosažení odpovědi PASI 100 při léčbě bimekizumabem v porovnání s léčbou ustekinumabem (A), adalimumabem (B) a secukinumabem (C); podle [4,15,16] – Reich, et al., 2021; Reich, et al., 2021; Warren, et al., 2021.](https://www.remedia.cz/photo-pg-1216---.jpg) Profesor Vencovský představil výsledky srovnání účinnosti léčby bimekizumabem u pacientů postižených psoriázou ve studiích BE VIVID, BE SURE a BE RADIANT (graf 4A–C), které dokládají velmi dobrý efekt bimekizumabu na projevy psoriázy (hodnoceno jako dosažení odpovědi PASI 100, tedy dosažení čisté kůže) [4,15,16]. Z tohoto pohledu se léčba bimekizumabem, anti‑IL‑17 terapie, jeví jako vhodná, s dobrou účinností i po selhání inhibitoru TNF [5]. Proti léčbě mohou svědčit opakované vulvovaginální kandidózy v anamnéze pacientky, tento nežádoucí účinek je u anti‑IL‑17 léčby častější, ale jedná se spíše o orální kandidózy. Je opět k diskusi s pacientem.
Profesor Vencovský představil výsledky srovnání účinnosti léčby bimekizumabem u pacientů postižených psoriázou ve studiích BE VIVID, BE SURE a BE RADIANT (graf 4A–C), které dokládají velmi dobrý efekt bimekizumabu na projevy psoriázy (hodnoceno jako dosažení odpovědi PASI 100, tedy dosažení čisté kůže) [4,15,16]. Z tohoto pohledu se léčba bimekizumabem, anti‑IL‑17 terapie, jeví jako vhodná, s dobrou účinností i po selhání inhibitoru TNF [5]. Proti léčbě mohou svědčit opakované vulvovaginální kandidózy v anamnéze pacientky, tento nežádoucí účinek je u anti‑IL‑17 léčby častější, ale jedná se spíše o orální kandidózy. Je opět k diskusi s pacientem.
Profesorka Macejová navrhla jako další léčebnou možnost switch na jiný inhibitor TNF a připomněla již výsledky studie RAPID‑PsA, kam byli zařazeni i pacienti dříve léčení inhibitorem TNF [17]. Změna léčby na další inhibitor TNF u nich vedla k dobré klinické odpovědi i efektu na kožní projevy.
Kazuistika 6
Šestým případem je 27letý muž sledovaný pro non‑radiografickou axiální SpA s uveitidou a občasnými entezitidami. Před šesti lety byla u pacienta zahájena terapie adalimumabem s dobrou klinickou odpovědí. V průběhu času ale došlo ke zhoršení akné a zároveň k postupné ztrátě účinnosti. Léčba byla změněna na secukinumab s dobrým efektem na muskuloskeletální systém. Postupně se objevily symptomy v oblasti gastrointestinálního traktu a provedená vyšetření potvrdila diagnózu ulcerózní kolitidy. Profesorka Macejová připomněla, že pacienti trpící SpA mají často řadu mimokloubních projevů, mezi něž patří i IBD. Na podkladě výsledků klinických hodnocení [18] a již zmíněných doporučení [13] byla v tomto případě doporučena léčba inhibitory TNF. U pacienta se podařilo kloubní i střevní projevy onemocnění dostat pod kontrolu.
Kazuistika 7
Poslední případ představuje 24letou ženu s PsA s vysokou klinickou i humorální aktivitou. Pacientka byla dosud léčena NSA a cyklosporinem. Aktuálně splňuje indikační kritéria pro zavedení biologické léčby. Jedná se o mladou ženu, která plánuje těhotenství, je třeba se zamyslet nad optimálním postupem.
Profesorka Macejová se u této pacientky přiklání k zahájení terapie CZP. Jako podklad prezentovala výsledky studie CRIB [19], které dokládají minimální placentární přenos CZP z matky na dítě. Dle této farmakokinetické studie se koncentrace CZP u 13 ze 14 vzorků dětské krve při narození a u všech vzorků ve 4. a 8. týdnu nacházely pod hodnotou limitu hodnotitelnosti (< 0,032 μg/ml). S opatrností je tedy možné v průběhu těhotenství pokračovat s touto léčbou. Klinický význam nízkých hladin CZP u kojenců není znám.
Profesor Vencovský potvrdil tuto výhodu CZP a uvedl, že o skupině inhibitorů IL‑17 v souvislosti s těhotenstvím a laktací se toho vzhledem ke kratší době v klinické praxi dosud ví málo. Očekávána jsou nová britská doporučení zaměřená právě na použití různých léků v souvislosti s těhotenstvím a kojením. Uvedeny zde budou i inhibitory IL‑17. Zatím nejsou známy signály svědčící proti použití, nicméně vzhledem k absenci dokladů o bezpečnosti je doporučeno tuto léčbu v těhotenství a při kojení nepodávat.
Přechod na léčbu certolizumab pegolem z důvodu plánované gravidity/gravidity/kojení
Součástí odborného programu bylo i sdělení doc. MUDr. Jakuba Závady, Ph.D., (Revmatologický ústav, Praha), které se zaměřilo právě na použití CZP v souvislosti s plánováním gravidity, graviditou a kojením. Certolizumab pegol díky svým farmakokinetickým vlastnostem souvisejícím s pegylací téměř nepřechází transplacentárně ani do mateřského mléka.
 Docent Závada prezentoval výsledky analýzy pacientek z registru ATTRA, ve kterém je zaznamenáván (mj.) přechod na jiné léčivo a důvod změny terapie (switch). Předmětem zkoumání tedy byly pacientky převedené na léčbu CZP z důvodu (plánované) gravidity. Identifikováno bylo celkem 88 pacientek; 35 trpících AS, 10 s PsA a 43 s RA. Předmětem analýzy byl i vliv změny léčby na kontrolu onemocnění, vyřazeny byly proto čtyři pacientky z důvodu absence informace o aktivitě onemocnění při přechodu na léčbu CZP.
Docent Závada prezentoval výsledky analýzy pacientek z registru ATTRA, ve kterém je zaznamenáván (mj.) přechod na jiné léčivo a důvod změny terapie (switch). Předmětem zkoumání tedy byly pacientky převedené na léčbu CZP z důvodu (plánované) gravidity. Identifikováno bylo celkem 88 pacientek; 35 trpících AS, 10 s PsA a 43 s RA. Předmětem analýzy byl i vliv změny léčby na kontrolu onemocnění, vyřazeny byly proto čtyři pacientky z důvodu absence informace o aktivitě onemocnění při přechodu na léčbu CZP.
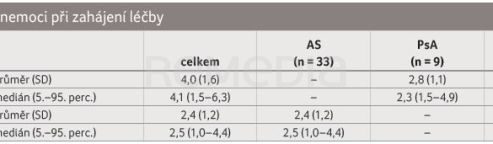
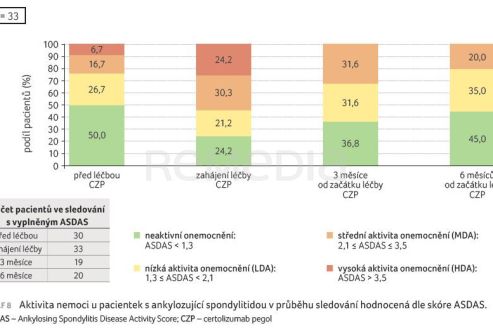
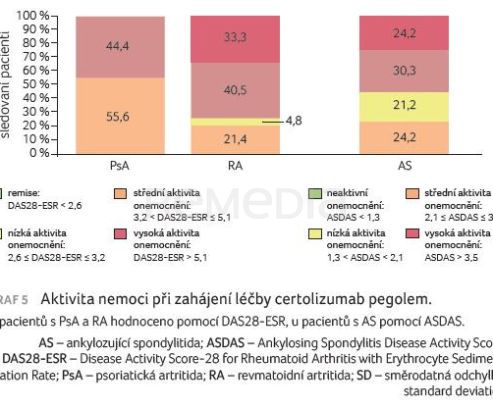 Průměrný věk pacientek byl 32 let. U dvou třetin pacientek byl CZP nasazen ve druhé linii léčby (66,7 %), u nižšího podílu pacientek ve třetí (23,8 %) a čtvrté linii (9,5 %). Nejčastější předchozí terapií byly adalimumab (u 24 % pacientek) a etanercept (14 % pacientek). Aktivitu onemocnění při zahájení léčby CZP detailně popisují tab. 1, graf 5. U pacientek s RA a PsA bylo hodnoceno skóre DAS28‑ESR (Disease Activity Score‑28 for Rheumatoid Arthritis with Erythrocyte Sedimentation Rate), u nemocných s AS ukazatel aktivity nemoci ASDAS.
Průměrný věk pacientek byl 32 let. U dvou třetin pacientek byl CZP nasazen ve druhé linii léčby (66,7 %), u nižšího podílu pacientek ve třetí (23,8 %) a čtvrté linii (9,5 %). Nejčastější předchozí terapií byly adalimumab (u 24 % pacientek) a etanercept (14 % pacientek). Aktivitu onemocnění při zahájení léčby CZP detailně popisují tab. 1, graf 5. U pacientek s RA a PsA bylo hodnoceno skóre DAS28‑ESR (Disease Activity Score‑28 for Rheumatoid Arthritis with Erythrocyte Sedimentation Rate), u nemocných s AS ukazatel aktivity nemoci ASDAS.
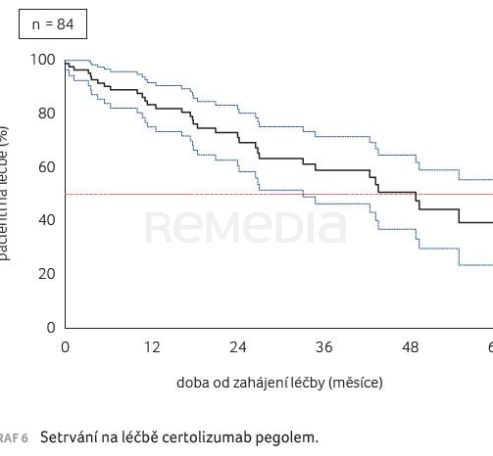 Zaznamenané setrvání na léčbě bylo příznivé (graf 6). U pacientek, které byly na léčbu CZP převedeny z důvodu gravidity, činil medián téměř 50 měsíců.
Zaznamenané setrvání na léčbě bylo příznivé (graf 6). U pacientek, které byly na léčbu CZP převedeny z důvodu gravidity, činil medián téměř 50 měsíců.
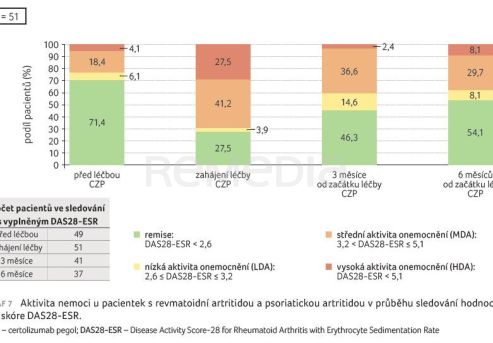 Aktivita onemocnění hodnocená na začátku léčby, v jejím průběhu a na konci sledování ukázala dobrý efekt léčby CZP (graf 7, 8).
Aktivita onemocnění hodnocená na začátku léčby, v jejím průběhu a na konci sledování ukázala dobrý efekt léčby CZP (graf 7, 8).
 Docent Závada závěrem shrnul, že dle předložené analýzy neměla změna přípravku negativní vliv na kontrolu aktivity onemocnění a následné dlouhé setrvání na léčbě svědčilo pro dobrou účinnost, bezpečnost i toleranci CZP.
Docent Závada závěrem shrnul, že dle předložené analýzy neměla změna přípravku negativní vliv na kontrolu aktivity onemocnění a následné dlouhé setrvání na léčbě svědčilo pro dobrou účinnost, bezpečnost i toleranci CZP.
Literatura
[1] Shah M, Maroof A, Gikas P, et al. Dual neutralisation of IL‑17F and IL‑17A with bimekizumab blocks inflammation‑driven osteogenic differentiation of human periosteal cells. RMD Open 2020; 6: e001306.
[2] Glatt S, Baeten D, Baker T, et al. Dual IL‑17A and IL‑17F neutralisation by bimekizumab in psoriatic arthritis: evidence from preclinical experiments and a randomised placebo‑controlled clinical trial that IL‑17F contributes to human chronic tissue inflammation. Ann Rheum Dis 2018; 77: 523–532.
[3] McInnes IB, Asahina A, Coates LC, et al. Bimekizumab in patients with psoriatic arthritis, naive to biologic treatment: a randomised, double‑blind, placebo‑controlled, phase 3 trial (BE OPTIMAL). Lancet 2023; 401: 25–37.
[4] Reich K, Warren RB, Lebwohl M, et al. Bimekizumab versus Secukinumab in Plaque Psoriasis. N Engl J Med 2021; 385: 142–152.
[5] Merola JF, Landewé R, McInnes IB, et al. Bimekizumab in patients with active psoriatic arthritis and previous inadequate response or intolerance to tumour necrosis factor‑α inhibitors: a randomised, double‑blind, placebo‑controlled, phase 3 trial (BE COMPLETE). Lancet 2023; 401: 38–48.
[6] van der Heijde D, Deodhar A, Baraliakos X, et al. Efficacy and safety of bimekizumab in axial spondyloarthritis: results of two parallel phase 3 randomised controlled trials. Ann Rheum Dis 2023; 82: 515–526.
[7] Baraliakos X, Deodhar A, van der Heijde D, et al. Bimekizumab Maintains Improvements in Efficacy Endpoints and Has a Consistent Safety Profile Through 52 Weeks in Patients with Non‑Radiographic Axial Spondyloarthritis and Ankylosing Spondylitis: Results from Two Parallel Phase 3 Studies. ACR2022, Presentation L14.
[8] van der Heijde D, Dougados M, Landewé, et al. Sustained efficacy, safety and patient‑reported outcomes of certolizumab pegol in axial spondyloarthritis: 4‑year outcomes from RAPID‑axSpA. Rheumatology (Oxford) 2017; 56: 1498–1509.
[9] Cretu I, Geoanta C, Bogheanu OI, et al. Cerebral Tuberculosis in a Patient Following Treatment With Infliximab for Ankylosing Spondylitis: A Case Report. Cureus 2023; 15: e39117.
[10] Elewski BE, Baddley JW, Deodhar AA, et al. Association of Secukinumab Treatment With Tuberculosis Reactivation in Patients With Psoriasis, Psoriatic Arthritis, or Ankylosing Spondylitis. JAMA Dermatol 2021; 157: 43–51.
[11] Bykerk VP, Cush J, Winthrop K, et al. Update on the safety profile of certolizumab pegol in rheumatoid arthritis: an integrated analysis from clinical trials. Ann Rheum Dis 2015; 74: 96–103.
[12] Kudsi M, Asaad W, Khalayli N, et al. Erythema nodosum after golimumab treatment in ankylosing spondylitis patients: a case report and literature review. Ann Med Surg (Lond) 2023; 85: 4633–4637.
[13] Coates LC, Soriano ER, Corp N, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol 2022; 18: 465–479.
[14] Tu W, Nie D, Chen Y, et al. Successful Treatment of SAPHO Syndrome Complicated with Ankylosing Spondylitis by Secukinumab: A Case Report. J Pers Med 2023; 13: 516.
[15] Reich K, Papp KA, Blauvelt A, et al. Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52‑week, multicentre, double‑blind, active comparator and placebo controlled phase 3 trial. Lancet 2021; 397: 487–498.
[16] Warren RB, Blauvelt A, Bagel J, et al. Bimekizumab versus Adalimumab in Plaque Psoriasis. N Engl J Med 2021; 385: 130–141.
[17] Mease PJ, Fleischmann R, Deodhar A, et al. Effect of certolizumab pegol on signs and symptoms in patients with psoriatic arthritis: 24‑week results of a Phase 3 double‑blind randomised placebo‑controlled study (RAPID‑PsA). Ann Rheum Dis 2014; 73: 48–55.
[18] Deodhar A, Gensler LS, Kay J, et al. A Fifty‑Two‑Week, Randomized, Placebo‑Controlled Trial of Certolizumab Pegol in Nonradiographic Axial Spondyloarthritis. Arthritis Rheumatol 2019; 71: 1101–1111.
[19] Mariette X, Förger F, Abraham B, et al. Lack of placental transfer of certolizumab pegol during pregnancy: results from CRIB, a prospective, postmarketing, pharmacokinetic study. Ann Rheum Dis 2018; 77: 228–233.