Vismodegib – cílená léčba inoperabilního bazocelulárního karcinomu
Bazaliom je nejčastější maligní kožní nádor a jeho incidence se stále zvyšuje. Léčba bazaliomu zahrnuje chirurgii, radioterapii, kryoterapii, fotodynamickou léčbu a lokální aplikaci imiquimodu, ale v případech pokročilých a metastazujících bazaliomů nejsou tyto metody účinné. Aktivace signální dráhy Hedgehog (HH) způsobuje proliferaci buněk a stimuluje nádorové kmenové buňky. Bylo prokázáno, že signální dráha je aktivní u téměř všech bazaliomů. Vismodegib je první lék zaměřený na signální dráhu HH a je účinný v léčbě pokročilého a metastazujícího bazaliomu. Schválení vismodegibu lékovými autoritami Food and Drug Administration i European Medicines Agency je velmi důležitým krokem v léčbě pokročilého bazaliomu.
Úvod
Bazocelulární karcinom (bazaliom, BCC) představuje nejčastěji se vyskytující kožní nádor, s vysokou incidencí a nízkou mortalitou. Je lokálně agresivní, pokročilé nádory dokáží výrazně destruovat okolní tkáně, ale metastazování je velmi vzácné. Bazaliom vzniká maligní transformací keratinocytů bazální vrstvy epidermis. Přesný mechanismus vzniku znám není, ale na jeho etiologii se jistě podílejí genetické faktory i vliv prostředí. Bazaliom je popisován zejména u jedinců se světlou kůží poškozenou chronickou expozicí slunečnímu záření.
V České republice byla v roce 2010 incidence BCC přibližně 195 případů na 100 000 obyvatel a v absolutních počtech bylo hlášeno 20 584 nových případů (dle ÚZIS ČR). I přes tyto relativně vysoké počty je možné předpokládat, že výskyt je ve sku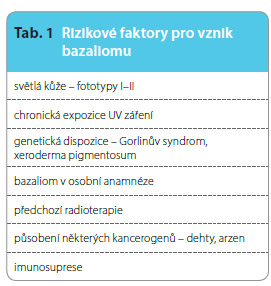 tečnosti významně vyšší, protože ne o každém bazaliomu je lékařem napsáno onkologické hlášení. V USA jsou ročně diagnostikovány více než 2 miliony případů nových BCC [1].
tečnosti významně vyšší, protože ne o každém bazaliomu je lékařem napsáno onkologické hlášení. V USA jsou ročně diagnostikovány více než 2 miliony případů nových BCC [1].
Na základě mnohaletého sledování incidence je zřejmé, že výskyt BCC, stejně jako dalších kožních nádorů, včetně melanomu, se v posledních desetiletích trvale zvyšuje. Kromě hlavních etiologických faktorů, mezi něž patří kožní fototyp a expozice slunečnímu záření, se na vzniku BCC podílí nemalou měrou také imunosuprese vyvolaná buď souběžně probíhajícím onemocněním nebo imunosupresivní léčbou. Zvýšený výskyt bazaliomů provází některé hereditární syndromy, jako je Gorlinův syndrom, xeroderma pigmentosum, a řadu dalších. Hlavní rizikové faktory pro vznik bazaliomu shrnuje tab. 1.
Naprostá většina BCC je dobře a kompletně vyléčitelná chirurgickým zákrokem nebo kryoterapií. Základem pro úspěšnost léčby je ale včasné rozpoznání nádoru. Pro pokročilé bazaliomy je typická tendence k častým lokálním recidivám a v závažnějších případech i k prorůstání do sousedních přilehlých partií kůže a dalších tkání. Tyto nádory jsou obtížně léčitelné chirurgicky a je nutné zvolit jiné postupy, jako je radioterapie, fotodynamická terapie (photodynamic therapy, PDT) nebo lokální aplikace imiquimodu. I tyto metody ale mají omezenou účinnost, a tak je velká naděje vkládána do nově zaváděné cílené léčby zaměřené na signální dráhu Hedgehog (HH). Význam patologické aktivace této dráhy byl poprvé popsán u nemocných s Gorlinovým syndromem a následně bylo zjištěno, že má klíčovou úlohu i při rozvoji a progresi sporadických bazaliomů. Vismodegib je prvním inhibitorem signální dráhy HH, který prokazuje účinnost v terapii pokročilých inoperabilních bazaliomů, u kterých již selhaly klasické léčebné možnosti, a je účinný i u metastazujících BCC.
Signální dráha Hedgehog a vismodegib
Signální dráha HH fyziologicky reguluje buněčné dělení a diferenciaci tkání v průběhu embryonálního vývoje obratlovců a kontroluje sebeobnovu kmenových buněk. Zčásti se podílí i na regulaci kmenových buněk v dospělosti, 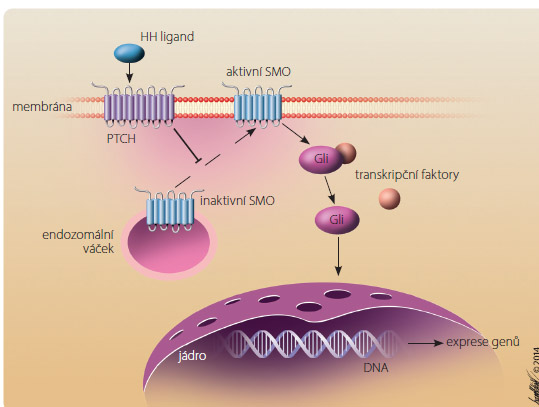 čímž umožňuje regeneraci některých tkání, zejména vlasových folikulů a kůže. V roce 1993 byly popsány tři důležité HH proteiny této dráhy – Desert Hedgehog (DHH), Indian Hedgehog (IHH) a Sonic Hedgehog (SHH), který hraje při rozvoji bazaliomu nejspíše nejvýznamnější roli. V buňkách obratlovců je signalizace HH zahájena navázáním ligandu HH na membránový protein Patched-1 (PTCH); poté dochází k aktivaci proteinu Smoothened (SMO), který po následné translokaci a aktivaci transkripčních faktorů vyvolá expresi řady genů s onkogenním účinkem (obr. 1).
čímž umožňuje regeneraci některých tkání, zejména vlasových folikulů a kůže. V roce 1993 byly popsány tři důležité HH proteiny této dráhy – Desert Hedgehog (DHH), Indian Hedgehog (IHH) a Sonic Hedgehog (SHH), který hraje při rozvoji bazaliomu nejspíše nejvýznamnější roli. V buňkách obratlovců je signalizace HH zahájena navázáním ligandu HH na membránový protein Patched-1 (PTCH); poté dochází k aktivaci proteinu Smoothened (SMO), který po následné translokaci a aktivaci transkripčních faktorů vyvolá expresi řady genů s onkogenním účinkem (obr. 1).
Vedle své účasti na vzniku BCC se abnormální signalizace HH, způsobená zejména mutacemi v PTCH nebo SMO, podílí také na vzniku dalších malignit, například meduloblastomu, některých hematologických onemocnění i některých solidních nádorů. Zdá se, že hraje významnou roli i při vzniku metastáz [2]. Zablokování signální dráhy HH zpomaluje proliferaci a růst buněk, tlumí aktivitu onkogenů a tím umožňuje potlačení růstu nádoru.
V současné době je nejúčinnějším inhibitorem proteinu SMO vismodegib, označovaný dříve jako GDC-0449. Na základě výsledků klinických studií a zejména studie ERIVANCE, jejíž výsledky byly publikovány v roce 2012 v New England Journal of Medicine, byl vismodegib v lednu 2012 schválen Food and Drug Administration (FDA) pro léčbu pokročilého inoperabilního nebo metastazujícího bazocelulárního karcinomu a v červenci 2013 byl registrován také European Medicines Agency (EMA) v Evropě ve stejných indikacích [3].
Bazaliom a jeho metastazování
Bazaliom se vyskytuje nejčastěji v oblastech kůže vystavených chronickému působení UV zářen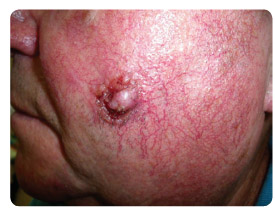 í, jako je hlava a krk, ale tvoří se velmi často i na trupu a končetinách. Pouze malé procento bazaliomů se chová agresivně již od svého počátku. Ve velké většině případů neznamená BCC pro svého nositele příliš závažné postižení a je dobře léčitelný chirurgicky nebo kryoterapií. I pro počínající bazaliomy ale bývá typický sklon ke vzniku lokálních recidiv, které se popisují asi u 2–3 % nádorů [1]. Existuje řada klinických i histopatologických variant BCC lišících se vzhledem i biologickým chováním. Nejčastější formou je nodulární bazaliom, nejvyšší sklon k lokálním recidivám a agresivnímu růstu mají infiltrativní sklerodermiformní bazaliomy nebo varianty ulcus rodens a ulcus terebrans, viz obr. 2. Pokročilé BCC, které ve velkém počtu případů vznikají primárním zanedbáním ze strany pacienta, již ale mohou způsobit významné zdravotní problémy, viz obr. 3.
í, jako je hlava a krk, ale tvoří se velmi často i na trupu a končetinách. Pouze malé procento bazaliomů se chová agresivně již od svého počátku. Ve velké většině případů neznamená BCC pro svého nositele příliš závažné postižení a je dobře léčitelný chirurgicky nebo kryoterapií. I pro počínající bazaliomy ale bývá typický sklon ke vzniku lokálních recidiv, které se popisují asi u 2–3 % nádorů [1]. Existuje řada klinických i histopatologických variant BCC lišících se vzhledem i biologickým chováním. Nejčastější formou je nodulární bazaliom, nejvyšší sklon k lokálním recidivám a agresivnímu růstu mají infiltrativní sklerodermiformní bazaliomy nebo varianty ulcus rodens a ulcus terebrans, viz obr. 2. Pokročilé BCC, které ve velkém počtu případů vznikají primárním zanedbáním ze strany pacienta, již ale mohou způsobit významné zdravotní problémy, viz obr. 3.
V učebnicích bývá převážně uvedeno, že bazaliom je maligní nádor s tendencí k lokálně infiltrativnímu růstu, bez schopnosti zakládat vzdálené metastázy. V posledních letech se nicméně objevují, i když stále velmi vzácně, případy histologicky potvrzených metastazujících bazaliomů. Metastazují převážně rozsáhlé nádory větší než 7,5 cm, lokalizované na hlavě a krku. Nejčastějším místem metastazování bývají regionální lymfatické uzliny, plíce a kosti. Vznik metastáz bazaliomu je ale, v porovnání s metastazováním jiných maligních nádorů, významně pomalejší, medián 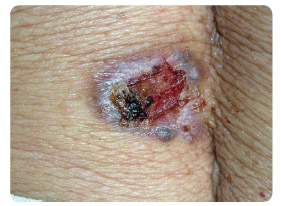 doby od vzniku primárního nádoru do potvrzení metastáz se pohybuje okolo 9 let [4].
doby od vzniku primárního nádoru do potvrzení metastáz se pohybuje okolo 9 let [4].
Příčiny stoupajícího počtu popsaných metastazujících bazaliomů zatím nejsou zřejmé, asi nelze vyloučit určitou roli zvýšené imunosuprese i zlepšené diagnostiky. Prognóza nemocných s metastazujícím BCC je závažná, medián celkové doby přežití (overall survival, OS) se uvádí okolo 10 měsíců. Nejvýznamnějšími faktory nepříznivě ovlivňujícími OS je velikost nádoru a pozdě zahájená léčba [4].
Za pokročilé, rizikové a velmi špatně léčitelné bazaliomy se považují nádory, které opakovaně recidivují, dále bazaliomy prorůstající do okolních struktur a bazaliomy v metastatickém stadiu, tedy nádory, které je již velmi obtížné či zcela nemožné odstranit chirurgicky. Uvádí se, že představují přibližně 1–10 % všech BCC s tím, že bazaliomy s metastatickým rozsevem tvoří 0,003–0,5 % [5]. Léčebné možnosti u běžných i pokročilých bazaliomů zahrnují chirurgii, kryoterapii, radioterapii, imunoterapii lokální aplikací imiquimodu nebo PDT. Ze systémové léčby se zkoušela bez většího léčebného efektu zejména chemoterapie s využitím cisplatiny.
Po potvrzení spojitosti mezi signální dráhou HH a BCC u Gorlinova syndromu bylo zjištěno, že signální dráha HH je aktivována téměř u všech typů bazaliomů. Také některé další nádory provázející Gorlinův syndrom, jako jsou rhabdomyosarkomy nebo meningeomy, mají buď aktivovanou signální dráhu HH nebo zvýšenou expresi cílových genů této dráhy. Zvýšená signalizace HH bývá prokazována jak v nádoru, tak ve stromatu.
Vismodegib v léčbě bazaliomu
Nejúčinnějším selektivním inhibitorem signální dráhy HH je v současné době vismodegib, lék, který je indikován k terapii pokročilých a metastazujících bazaliomů nevhodných k chirurgické léčbě či radioterapii. Jeho účinnost byla poprvé popsána ve studii fáze I vedené pod o![Graf 1 Odpověď na léčbu vismodegibem; podle [6] – Von Hoff, et al., 2009. CR – complete response, kompletní odpověď; PD – progression disease, progrese onemocnění; PR – partial response, částečná odpověď; SD – stable disease, stabilizované onemocnění](https://www.remedia.cz/photo-a-29882---.jpg) značením NCT00607724 s 33 pacienty s pokročilým BCC (15 pacientů) a s metastazujícím BCC (18 pacientů). Medián léčby byl 9,8 měsíce a u 18 pacientů bylo dosaženo léčebné odpovědi. U dvou nemocných došlo ke kompletní remisi (complete remission, CR) onemocnění a u 16 nemocných k částečné léčebné odpovědi (partial response, PR). U 11 pacientů došlo ke stabilizaci onemocnění trvající více než 10 měsíců a pouze u 4 pacientů došlo k progresi nádoru. Charakter léčebných odpovědí a doba trvání jsou znázorněny v grafu 1 [6].
značením NCT00607724 s 33 pacienty s pokročilým BCC (15 pacientů) a s metastazujícím BCC (18 pacientů). Medián léčby byl 9,8 měsíce a u 18 pacientů bylo dosaženo léčebné odpovědi. U dvou nemocných došlo ke kompletní remisi (complete remission, CR) onemocnění a u 16 nemocných k částečné léčebné odpovědi (partial response, PR). U 11 pacientů došlo ke stabilizaci onemocnění trvající více než 10 měsíců a pouze u 4 pacientů došlo k progresi nádoru. Charakter léčebných odpovědí a doba trvání jsou znázorněny v grafu 1 [6].
Následovala studie fáze II ERIVANCE BCC, do které bylo zařazeno 71 pacientů s lokálně pokročilým BCC a 33 nemocných s metastazujícím BCC. Za pokročilé byly považovány inoperabilní biopticky potvrzené nádory a nádory opakovaně recidivující po chirurgických zákrocích i po radioterapii. U metastazujících bazaliomů bylo vyžadováno histologické ověření metastáz a minimálně jedna měřitelná léze podle kritérií RECIST (Response Evaluation Criteria In Solid Tumors). Vismodegib byl aplikován v dávce 150 mg jedenkrát denně perorálně do progrese či toxicity vyžadující přerušení nebo ukončení léčby. Medián doby podávání vismodegibu byl 10 měsíců v obou kohortách. U 18 % pacientů s metastazujícím BCC byla příčinou ukončení léčby progrese nádoru, zatímco u pacientů s lokálně pokročilým nádorem bylo hlavním důvodem rozhodnutí pacienta (25 %). Ve skupině nemocných s lokálně pokročilým bazaliomem dosáhlo léčebné odpovědi 43 % pacientů, z toho u 21 % pacientů došlo k CR potvrzené biopticky. U pacientů s metastazujícím BCC byly léčebné odpovědi popsány ve 30 %. Jednalo se o PR, CR nebyly zaznamenány. Medián trvání léčebných odpovědí dosáhl 7,6 měsíce v obou kohortách a medián přežití do progrese (progression free survival, PFS) byl v obou skupinách 9,5 měsíce [7].
Nežádoucí účinky léčb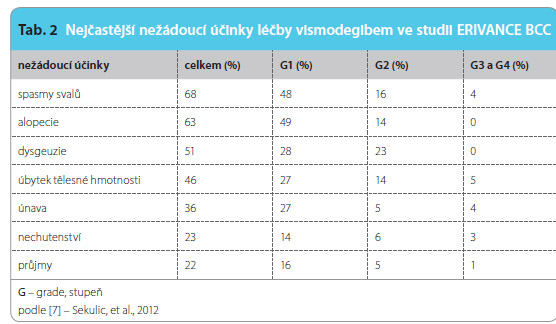 y vismodegibem byly popisovány u všech léčených, ve více než polovině případů (v 57 %) se jednalo o mírné potíže stupně 1 a 2. Přehledně jsou nežádoucí účinky uvedeny v tab. 2. Svalové spasmy, dysgeuzie a únava představují nejčastější a pacienty nejhůře vnímané nežádoucí účinky. I když by se mohlo zdát, že například poruchy chuťového vnímání nemohou být příliš závažné, znamenají v některých případech výrazné zhoršení kvality života.
y vismodegibem byly popisovány u všech léčených, ve více než polovině případů (v 57 %) se jednalo o mírné potíže stupně 1 a 2. Přehledně jsou nežádoucí účinky uvedeny v tab. 2. Svalové spasmy, dysgeuzie a únava představují nejčastější a pacienty nejhůře vnímané nežádoucí účinky. I když by se mohlo zdát, že například poruchy chuťového vnímání nemohou být příliš závažné, znamenají v některých případech výrazné zhoršení kvality života.
V roce 2013 byla publikována další zajímavá data získaná při léčbě nemocných vismodegibem v rámci specifického léčebného programu. Do studie bylo, na základě stejných zařazovacích kritérií jako ve studii ERIVANCE BCC, zařazeno 119 pacientů s pokročilým (62 pacientů) nebo metastazujícím (57 pacientů) bazaliomem. Účinnost léčby byla hodnocena u 95 nemocných (56 a 39 pacientů). Medián doby podávání vismodegibu byl 5,5 měsíce a následně musela být studie ukončena, protože vismodegib byl schválen FDA. Léčebné odpovědi byly pozorovány u 46,4 % nemocných s lokálně pokročilým bazaliomem a u 30,8 % pacientů s metastazujícím nádorem, z toho u 6 nemocných s lokálně pokročilým bazaliomem a u 2 pacientů s metastazujícím BCC došlo ke kompletní léčebné odpovědi. Téměř polovina (49,5 %) všech pacientů vykazovala stabilizaci onemocnění a u žádného z pacientů s lokálně pokročilým nádorem nedošlo k progresi onemocnění. Ta byla popsána pouze u tří nemocných s metastazujícím bazaliomem. Pozorované nežádoucí účinky byly velmi podobné jako ve studii ERIVANCE BCC. Téměř všichni léčení nemocní uváděli alespoň jeden druh nežádoucích účinků, převážně se ale jednalo o závažnost stupně 1 a 2 [8]. Vismodegib byl schválen FDA i EMA pro léčbu inoperabilního lokálně pokročilého nebo metastazujícího bazaliomu.
Vismodegib je vysoce permeabilní látka, jejíž vstřebávání není nijak významně ovlivněno jídlem, může být užíván nalačno i po jídle. Váže se převážně na lidský albumin a je metabolizován CYP2C9, CYP3A4/5 a P-glykoproteiny. Vylučuje se zejména játry, asi z 82 %, a pouze minimálně ledvinami. Vliv jaterního či renálního poškození na metabolismus vismodegibu nebyl dosud ozřejmen.
Vismodegib má v důsledku svého působení na signální dráhu HH teratogenní účinky, může způsobovat embryofetální úmrtí i vyvolávat vznik závažných vrozených defektů v podobě kraniofaciálních anomálií či vývojových poškození končetin. Lék nesmějí užívat ženy v průběhu gravidity a vzhledem k tomu, že může být obsažen ve spermatu, musejí i muži léčení vismodegibem dodržovat všechna opatření k prevenci početí. Rozsah vylučování vismodegibu do mateřského mléka nebyl zatím přesně zhodnocen. V rámci preventivních opatření nesmějí ženy po dobu léčby a 24 měsíců od užití poslední dávky vismodegibu otěhotnět ani kojit a muži nesmějí minimálně další 2 měsíce po ukončení léčby oplodnit ženu. Pacienti také nesmějí v průběhu léčby a 24 měsíců po jejím ukončení být dárci krve (čerpáno z distribuovaného Doporučení společnosti Roche z 1. 7. 2014).
Závěr
Vismodegib je prvním inhibitorem signální dráhy HH schváleným FDA a EMA k léčbě lokálně pokročilého inoperabilního, metastazujícího bazaliomu, v jehož léčbě již byly vyčerpány dostupné terapeutické možnosti. Základem pro schválení léčby je nemožnost nebo neúčinnost chirurgického řešení či radioterapie. Vismodegib se podává perorálně v dávce 150 mg denně do progrese nebo neúnosné toxicity léčby. Medián doby podávání v uskutečněných klinických studiích se pohybuje kolem 10 měsíců, hlavním důvodem k ukončení léčby bývá progrese onemocnění, zejména u metastazujícího bazaliomu, nežádoucí účinky léčby i vznik rezistence.
Hlavními nežádoucími účinky léčby jsou svalové spasmy, dysgeuzie, únava, hubnutí, alopecie a průjmy. Nebývají příliš závažné, ale přesto mohou, zejména svalové spasmy a dysgeuzie, znamenat pro některé nemocné nepřekonatelné potíže vedoucí k předčasnému ukončení léčby.
Vismodegib je v současné době jedinou dostupnou účinnou cílenou léčbou inoperabilního bazaliomu. V budoucnu se očekávají další data získaná z hodnocení dlouhodobého podávání i pochopení mechanismu vzniku rezistence u některých léčených pacientů. Ve vývoji jsou i další inhibitory signální dráhy HH, jako je například sonidegib, a uvažuje se také o zesílení účinnosti vismodegibu jeho kombinací s inhibitory EGFR (receptor pro epidermální růstový faktor, epidermal growth factor receptor) nebo MEK [9]. V současné době probíhá kategorizace léku a stanovení úhrady. Do ukončení tohoto procesu lze o úhradu přípravku žádat příslušnou pojišťovnu pacienta podle § 16 zákona č. 48/1997 Sb., o veřejném zdravotním pojištění.
Seznam použité literatury
- [1] Mohan SV, Chang ALS. Advanced basal cell carcinoma: epidemiology and therapeutic innovations. Curr Derm Rep 2014; 3; 40–45.
- [2] Xie J, Bartels MC, Barton WS, Gu D. Hedgehog signaling in human cancer. Onco Targets Ther 2013; 6: 1425–1435.
- [3] Axelson M, Liu K, Jiang X, et al. U.S. Food and Drug Administration approval: vismodegib for recurrent, locally advanced or metastatic basal cell carcinoma. Clin Cancer Res 2013; 19: 2289–2293.
- [4] Wysong A, Aasi SZ, Tang JY. Update on metastatic basal cell carcinoma: a summary of published cases from 1981 through 2011. JAMA Dermatol 2013; 149: 615–616.
- [5] Berliny C, Hauschild A, Kölbl O, et al. Basal cell carcinoma – treatments for the commonets skin cancer. Dtsch Arztebl Int 2014; 111: 389–395.
- [6] Von Hoff DD, LoRusso PM, Rudin CM, et al. Inhibition of the hedgehog pathway in advanced basal-cell carcinoma. N Engl J Med 2009; 361: 1164–1172.
- [7] Sekulic A, Midgen MR, Oro EA, et al. Efficacy and safety of vismodegib in advanced basal-cell carcinoma. N Engl J Med 2012; 366: 2171–2179.
- [8] Chang Al, Solomon JA, et al. Expanded access study of patients with advanced basal cell carcinoma treated with the Hedgehog pathway inhibitor, vismodegib. J Am Acad Dermatol 2014; 70: 60–69.
- [9] Dreier J, Dummer R, Felderer L, et al. Emerging drugs and combination strategies for basal cell carcinoma. Expert Opin Emerg Drugs 2014, Apr-29, http://informahealthcare.com/doi/abs/10.1517/14728214.2014.914171