Vortioxetin – nové antidepresivum
Každé rozšíření léčebných možností antidepresivních látek zvyšuje šanci na volbu antidepresiva, které je nejen účinné, ale i dobře tolerované. Nové antidepresivum vortioxetin se vyznačuje kombinovaným antidepresivním a anxiolytickým účinkem. Vortioxetin působí prostřednictvím antagonizace receptorů 5-HT3 a 5-HT7, agonizace receptorů 5-HT1A, částečné agonizace receptorů 5-HT1B a inhibice serotoninového transportéru. Klinické studie ukazují, že vortioxetin je účinný v léčbě deprese, i když neexistuje žádný náznak převahy nad aktivním komparátorem. Jeho použití může přinášet klinicky významné výhody z hlediska snášenlivosti.
Úvod
Deprese je závažné psychické onemocnění a je jednou z hlavních příčin zdravotního postižení v rozvinutém i rozvojovém světě. Celoživotní prevalence je téměř 19 %. Průměrný věk projevu první depresivní epizody je okolo 29 let, v poslední době však věkový průměr klesá [3]. Deprese významně snižuje kvalitu života, produktivitu práce, omezuje sociální fungování, oslabuje fyzické zdraví a vede k podstatným přímým i nepřímým ekonomickým nákladům. Podle Světové zdravotnické organizace se během příštích deseti let stane deprese druhou nejčastější příčinou invalidity na celém světě [1]. Antidepresiva jsou spolu s některými psychoterapeutickými intervencemi důležitou součástí léčby deprese. Jejich účinnost je však poměrně omezená. Kompletní remise po jedné adekvátní kúře antidepresivem dosáhne pouze asi 30 % až 40 % pacientů. Další třetina pacientů vykazuje klinicky významnou odpověď na antidepresivní léčbu, ale má reziduální příznaky, které omezují jejich sociální fungování a zvyšují riziko vzniku relapsu [2]. Ačkoli máme k dispozici řadu účinných antidepresiv, část pacientů léčbu antidepresivy netoleruje kvůli jejich nežádoucím účinkům. Tento článek seznamuje ve stručné formě s mechanismem účinku vortioxetinu, předkládá důkazy o jeho bezpečnosti a účinnosti a podává přehled o potenciálním místě vortioxetinu v léčbě deprese.
Mechanismus účinku
Předpokládá se, že mechanismus působení vortioxetinu je ve vztahu k jeho přímé modulaci aktivity serotoninového receptoru a k inhibici přenašeče serotoninu (5-HT). Údaje z animálních studií naznačují, že vortioxetin je antagonista receptorů 5-HT3, 5-HT7 a 5-HT1D, parciální agonista receptoru 5-HT1B, agonista receptoru 5-HT1A a inhibitor přenašeče 5-HT; to vede k modulaci neurotransmise v několika systémech včetně především serotoninového, ale pravděpodobně také noradrenalinového, dopaminového, histaminového, acetylcholinového, GABA (kyseliny gamma-aminomáselné) a glutamátového [4, 5]. Tato multimodální aktivita se považuje za příčinu antidepresivního a anxiolytického účinku i za příčinu zlepšení kognitivních funkcí, učení a paměti, které byly pozorovány při podávání vortioxetinu ve studiích na zvířatech [6]. Přesný mechanismus antidepresivního působení vortioxetinu není dosud spolehlivě objasněn. Při extrapolaci údajů z animálních studií na člověka je potřeba opatrnost.
Farmakokinetika a metabolismus
Vortioxetin je pomalu a dobře absorbován po perorálním užití, plazmatická hladina dosahuje vrcholu během 7 až 11 hodin. Absolutní biologická dostupnost je 75 %. Farmakokinetika není ovlivněna příjmem potravy. Vortioxetin se na plazmatické bílkoviny váže ve vysoké míře (98–99 %) a vazba je nezávislá na plazmatické koncentraci. Přípravek je extenzivně metabolizován v játrech, primárně oxidací pomocí katalýzy CYP2D6 a v menší míře CYP3A4/5 a CYP2C9 a následnou konjugací s kyselinou glukuronovou. Hlavní metabolit vortioxetinu není farmakologicky aktivní. Přibližně dvě třetiny neaktivních metabolitů vortioxetinu se vylučují do moči a jedna třetina do stolice. Ustáleného stavu plazmatické koncentrace se dosáhne zhruba za dva týdny [7].
Léčba depresivní poruchy
Krátkodobé studie účinnosti
Vortioxetin prokázal svou účinnost v akutní léčbě deprese v dosud šesti placebem kontrolovaných krátkodobých (6–8 týdnů) studiích u dospělých pacientů s těžkou depresí [8–13]. Tři z těchto studií měly také aktivní komparátor (duloxetin nebo venlafaxin) [8, 11, 13]. Jedna studie kontrolovaná placebem byla provedena u starších osob [14]. Vortioxetin byl také podroben randomizovanému kontrolovanému srovnání s agomelatinem [15]. V krátkodobých studiích u pacientů mladších 65 let byl NNT (number needed to treat – počet pacientů, které je třeba léčit, aby právě jeden z nich dosáhl remise) 7 pro reakci na léčbu vortioxetinem ve srovnání s placebem (konfidenční interval – 95% CI: 6–9) a NNT pro remisi ve srovnání s placebem 11 (95% CI: 8–17) [16].
Dlouhodobé studie účinnosti
Dvě dlouhodobější studie prevence relapsu (jedna z nich otevřená [17] a jedna randomizovaná [18] potvrdily účinnost vortioxetinu v prevenci relapsu deprese. Recentní multicentrická otevřená 52týdenní studie [19] s flexibilní dávkou vortioxetinu hodnotila dlouhodobou bezpečnost, snášenlivost a účinnost udržovací léčby u účastníků studie, kteří dokončili jednu ze dvou randomizovaných, dvojitě 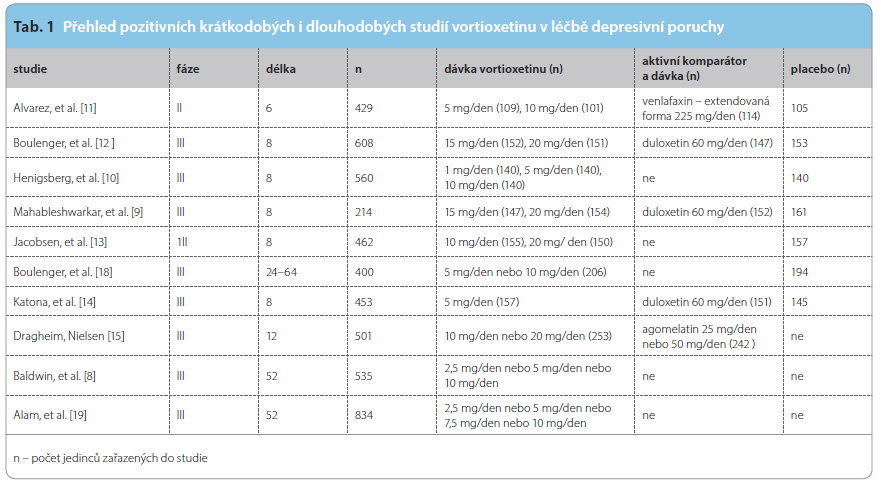 slepých 8týdenních studií kontrolovaných placebem [9, 10]. Na počátku otevřeného sledování byli všichni účastníci studie převedeni na léčbu 5 mg/den vortioxetinu po dobu prvního týdne, s následným přizpůsobením dávky na 2,5–10 mg/den podle klinické odpovědi a snášenlivosti. Po celou dobu studie byla sledována závažnost depresivních a úzkostných příznaků a hodnocena stupnicí HAMD (Hamilton Depression Scale), která má 24 položek; průměrné celkové skóre bylo 8,2 bodu v 52. týdnu proti 17,6 bodu na počátku studie.Přehled pozitivních krátkodobých i dlouhodobých studií vortioxetinu v léčbě depresivní poruchy podává tab. 1.
slepých 8týdenních studií kontrolovaných placebem [9, 10]. Na počátku otevřeného sledování byli všichni účastníci studie převedeni na léčbu 5 mg/den vortioxetinu po dobu prvního týdne, s následným přizpůsobením dávky na 2,5–10 mg/den podle klinické odpovědi a snášenlivosti. Po celou dobu studie byla sledována závažnost depresivních a úzkostných příznaků a hodnocena stupnicí HAMD (Hamilton Depression Scale), která má 24 položek; průměrné celkové skóre bylo 8,2 bodu v 52. týdnu proti 17,6 bodu na počátku studie.Přehled pozitivních krátkodobých i dlouhodobých studií vortioxetinu v léčbě depresivní poruchy podává tab. 1.
Krátkodobé studie bezpečnosti
Klinické studie naznačují, že vortioxetin má dobrou bezpečnost a profil snášenlivosti. Podle nálezů Henigsberga a kolegů [10] je vortioxetin obecně dobře snášen. Nejčastějšími nežádoucími účinky spojenými s léčbou vortioxetinem byly nauzea, bolest hlavy a závratě. Alvarez s kolegy [11] zaznamenal více nežádoucích účinků v souvislosti s přerušením nebo ukončením léčby venlafaxinem (14 %) než při odnětí obou dávek vortioxetinu (při odnětí vortioxetinu podávaného v dávce 5 mg se nežádoucí účinky objevily u 3 % pacientů, při odnětí vortioxetinu 10 mg u 7 % pacientů) nebo placeba (výskyt nežádoucích účinků z odnětí u 4 % pacientů). Sexuální dysfunkce se při léčbě vortioxetinem vyskytly v podobném poměru jako při podávání placeba. V souladu s tím Baldwin a kol. [8] zjistili, že všechny tři studované dávky vortioxetinu byly v porovnání s duloxetinem spojeny s velmi nízkým výskytem sexuálních dysfunkcí (2–4 % vs. 14 %). Při srovnání s agomelatinem bylo zjištěno, že vortioxetin byl celkově lépe tolerován (výskyt nežádoucích účinků: 5,9 % vs. 9,5 % ) [15]. Vortioxetin také dobře tolerují starší lidé. Katona a kol. [14] zjistili, že výskyt nežádoucích událostí souvisejících s vysazením přípravku dosahoval 5,8 % u vortioxetinu ve srovnání s 2,8 % u placeba a s 9,9 % u duloxetinu. Jediným nežádoucím účinkem s významně vyšším výskytem u vortioxetinu oproti placebu byla nevolnost (21,8 % vs. 8,3 %). Naopak výskyt nevolnosti, zácpy, xerostomie, pocení a somnolence byl při podávání duloxetinu oproti placebu vyšší.
Dle systematického přehledu [16] byl NNH (number needed to harm – počet pacientů, který je potřeba daným lékem léčit, aby bylo možné prokázat poškození zdraví u jednoho pacienta) pro přerušení z důvodu nežádoucích účinků 36 (95% CI: 24–70). Mezi nejčastěji pozorovanými nežádoucími účinky (výskyt nižší než 5 % a minimálně dvakrát nižší než při podávání placeba) byly nauzea, zácpa a zvracení se shodným pořadím hodnot NNH: 6 (95% CI: 6–7), 64 (95% CI: 37–240) a 28 (95% CI: 23–38). Změny tělesné hmotnosti nebyly klinicky relevantní a rovněž nedošlo k ovlivnění sexuálních funkcí
Dlouhodobé studie bezpečnosti
Zhodnocení bezpečnosti a snášenlivosti vortioxetinu v dlouhodobé léčbě pacientů s depresivní poruchou bylo primárním cílem otevřené prodloužené studie, která trvala 52 týdnů [17]. Nežádoucí účinky hlášené u více než 10 % pacientů zahrnovaly: nevolnost, bolesti hlavy a zánět nosohltanu. Dohromady šest pacientů (n = 535) mělo osm nežádoucích příhod souvisejících se sexuální dysfunkcí. Nebyly zjištěny žádné klinicky významné nálezy týkající se vitálních funkcí, tělesné hmotnosti, parametrů EKG nebo klinických laboratorních hodnot. Na základě těchto zjištění prokázal vortioxetin (2,5 mg/den; 5 mg/den; 10 mg/den) příznivý bezpečnostní profil i snášenlivost v udržovací léčbě deprese. Podobné závěry přinesla i 52týdenní studie [19] s 834 pacienty. Nežádoucí účinky byly hlášeny nejčastěji při kombinované léčbě a týkaly se všech dávek. Zahrnovaly nevolnost (15,2 %), bolest hlavy (12,4 %), zánět nosohltanu ( 9,8 %), průjem (7,2 %) a závratě (6,8 %). Míra intenzity nežádoucích příhod spojených se sexuální dysfunkcí byla nízká a zvýšení tělesné hmotnosti bylo minimální. Nebyly zaznamenány žádné klinicky významné trendy týkající se suicidiálního chování.
Vliv na kognitivní schopnosti a psychomotoriku
Preklinické studie ukazují, že antagonismus receptorů 5-HT3 a 5-HT7 podobně jako agonismus receptoru 5-HT1A má pozitivní efekt na kognitivní funkce včetně paměti. V animálních pokusech vortioxetin posílil kontextuální a epizodickou paměť potkanů hodnocenou behaviorálním testem [6]. Katona s kolegy [14] prokázal v osmitýdenním tříramenném srovnání s duloxetinem (60 mg) a placebem u pacientů starších 65 let, že vortioxetin (fixní dávka 5 mg), v souladu s nálezy ze studií na zvířatech, významně lépe než placebo upravuje řadu výsledků kognitivních testů (rychlost zpracování, verbální učení a paměť).
Zdá se, že vortioxetin nemá negativní vliv na schopnost řídit motorová vozidla. Theunissen a kol. [20] zkoumali účinky vortioxetinu (v dávce 10 mg/den) na řízení, kognitivní a psychomotorické funkce v randomizovaném kontrolovaném srovnání s mirtazapinem podávaným v dávce 30 mg/den a s placebem. Více než patnáctidenního sledování se zúčastnilo 24 zdravých dobrovolníků. Vortioxetin nepůsobil negativní změny v žádné ze sledovaných funkcí ani v žádném sledovaném časovém úseku (2. den a 16. den – tj. ráno po poslední dávce). Naproti tomu mirtazapin (který je ovšem poměrně sedativní) byl spojen s narušením kognitivních a psychomotorických funkcí ve druhém dni sledování, nicméně toto narušení nebylo již v šestnáctém dni sledování zřejmé.
Dávkování
Při léčbě depresivní poruchy se vortioxetin podává v dávce 5–20 mg v závislosti na individuální odpovědi pacienta. Denní doporučená dávka vortioxetinu je 10 mg, při nedostatečné terapeutické odpovědi je možno ji zvýšit až na 20 mg denně. Užívání vortioxetinu lze ukončit náhle, bez nutnosti postupného snižování dávky. Při ukončování léčby vyšší dávkou vortioxetinu se z důvodu možných bolestí hlavy a svalového napětí doporučuje nejprve snížit dávku na 10 mg denně, podávat ji po dobu jednoho týdne a teprve potom vortioxetin zcela vysadit. Pacientům se sníženou funkcí ledvin není potřeba dávku upravovat.
Užití vortioxetinu nebylo u pacientů s těžkou poruchou funkce jater studováno, při léčbě takových pacientů je zapotřebí opatrnosti. Úprava dávkování by měla být zvážena u pacientů, kterým jsou současně podávány obecné induktory izoenzymů CYP450, jimiž je vortioxetin metabolizován (např. karbamazepin, fenytoin); u těchto pacientů je potřeba zvýšit dávky vortioxetinu až na dvojnásobek. Úprava dávkování je nutná také u pacientů, kteří jsou slabí metabolizéři CYP2D6, a u pacientů, jimž byl k terapii vortioxetinem přidán silný inhibitor CYP2D6 (např. bupropion, fluoxetin, paroxetin). Zvýšenou opatrnost je potřeba dodržovat při současném užívání vortioxetinu s léčivými přípravky, které také mohou snižovat práh pro vznik záchvatů [7].
Lékové interakce
Vzhledem k riziku vzniku serotoninového syndromu je vortioxetin kontraindikován v jakékoli kombinaci s ireverzibilními neselektivními IMAO (inhibitory monoaminooxidázy). Souběžné podávání je možné jen při minimálních dávkách a při pečlivém sledování. Ke vzniku serotoninového syndromu může vést také současné podávání se serotonergně působícími látkami, zejména s antidepresivy SSRI (selektivní inhibitory zpětného vychytávání serotoninu), ale také například s tramadolem nebo sumatriptanem. Ze stejného důvodu je namístě opatrnost také při současném užívání extraktu z třezalky tečkované (Hypericum perforatum) [7]. Při kombinaci s alkoholem nebyl pozorován žádný vliv na farmakokinetiku vortioxetinu nebo ethanolu. Avšak během antidepresivní terapie se nedoporučuje požívat alkohol. Podobně jako u jiných serotonergních léčivých přípravků je zapotřebí opatrnosti v případě kombinace vortioxetinu s perorálními antikoagulancii nebo s antitrombotiky, včetně kyseliny acetylsalicylové, z důvodu možného zvýšení rizika krvácení vlivem farmakodynamické interakce.Nemáme k dispozici žádné klinické poznatky o kombinaci vortioxetinu a elektrokonvulzivní terapie.
Závěr
Vortioxetin je nové antidepresivum působící několika mechanismy, které zvyšují serotonergní aktivitu. Ovlivňuje neurotransmitery, které vyvolávají i udržují depresivní poruchu. Vortioxetin je dobře snášen, a to zřejmě i díky relativně malému potenciálu nežádoucích lékových interakcí. Klinické studie ukazují, že je účinný v léčbě deprese, včetně závažné deprese. Ačkoli nejsou žádné náznaky toho, že by měl být účinnější než jiné antidepresivní látky, většina studií naznačuje, že je klinicky výhodný z hlediska snášenlivosti. Výskyt sexuálních nežádoucích účinků je velmi nízký, tělesná hmotnost není při léčbě vortioxetinem ovlivněna. Starší lidé snášejí léčbu vortioxetinem dobře, částečně máme i důkazy o tom, že tento lék může přinášet kognitivní výhody.
Seznam použité literatury
- [1] World Health Organization. The Global Burden of Disease (2004 update) Geneva: World Health Organization; 2008. Accessed November 20, 2013. Available from: http://www.who.int/healthinfo/global_burden_disease/GBD_report_2004update_full.pdf
- [2] Rozensweig-Lipson S, Beyer CE, Hughes ZA, et al. Differentiating antidepressants of the future: efficacy and safety. Pharmacol Ther 2007; 113: 134–143.
- [3] Kessler RC, Berglund P, Demler O, et al. Lifetime prevalence and age-of-onset distributions of DSM-IV disorders in the National Comorbidity Survey Replication. Arch Gen Psychiatry 2005; 62: 593–602.
- [4] Stenkrona P, Halldin C, Lundberg J. 5-HTT and 5-HT1A receptor occupancy of the novel substance vortioxetine (Lu AA21004). A PET study in control subjects. Eur Neuropsychopharmacol 2013; 23: 1190–1198.
- [5] Bang-Andersen B, Ruhland T, Jorgensen M, et al. Discovery of 1-[2-(2,4-dimethylphenylsulfanyl) phenyl]piperazin (Lu AA21004): A novel multimodal compound for the treatment of major depressive disorder. J Med Chem 2011; 54: 3206–3221.
- [6] Mork A, Montezinho LP, Miller S, et al. Vortioxetine (Lu AA21004), a novel multimodal antidepressant, enhances memory in rats. Pharmacol Biochem Behav 2013; 105: 41–50.
- [7] Brintellix. Souhrn údajů o přípravku, dostupné na online: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_- _Product_Information/human/002717/WC500159449.pdf
- [8] Baldwin DS, Loft H, Dragheim M. A randomised, double-blind, placebo controlled, duloxetine-referenced, fixed-dose study of three dosages of Lu AA21004 in acute treatment of major depressive disorder (MDD). Eur Neuropsychopharmacol 2012; 22: 482–491.
- [9] Mahableshwarkar AR, Jacobsen PL, Chen Y. A randomized, double-blind trial of 2.5 mg and 5 mg vortioxetine (Lu AA21004) versus placebo for 8 weeks in adults with major depressive disorder. Curr Med Res Opin 2013; 29: 217–226.
- [10] Henigsberg N, Mahableshwarkar AR, Jacobsen P, et al. A randomized, double-blind, placebo-controlled 8-week trial of the efficacy and tolerability of multiple doses of Lu AA21004 in adults with major depressive disorder. J Clin Psychiatry 2012; 73: 953–959.
- [11] Alvarez E, Perez V, Dragheim M, et al. A double-blind, randomized, placebo-controlled, active reference study of Lu AA21004 in patients with major depressive disorder. Int J Neuropsychopharmacol 2012; 15: 589–600.
- [12] Boulenger JP, Loft H, Olsen CK. Efficacy and safety of vortioxetine (Lu AA21004), 15 and 20 mg/day: a randomized, double-blind, placebo-controlled, duloxetine-referenced study in the acute treatment of adult patients with major depressive disorder. Int Clin Psychopharmacol 2014; 29: 138–149.
- [13] Jacobsen PL, Mahableshwarkar AR, Serenko M, et al. A randomized, double-blind, placebo-controlled study of the efficacy and safety of vortioxetine 10 mg and 20 mg in adults with major depressive disorder. New Research Poster NR9-06, American Psychiatric Association, 166th Annual Meeting, San Francisco, CA, 18–22 May 2013.
- [14] Katona C, Hansen T, Olsen CK. A randomized, double-blind, placebo-controlled, duloxetine-referenced, fixed-dose study comparing the efficacy and safety of Lu AA21004 in elderly patients with major depressive disorder. Int Clin Psychopharmacol 2012; 27: 215–223.
- [15] Dragheim M, Nielsen RZ. A randomized, double-blind, study of vortioxetine versus agomelatine in adults with major depressive disorder (MDD) switched after inadequate response to SSRI or SNRI treatment. Poster Presentation I-44, 53rd Annual NCDEU Meeting, Hollywood, FL, 28–31 May 2013.
- [16] Citrome L. Vortioxetine for major depressive disorder: a systematic review of the efficacy and safety profile for this newly approved antidepressant – what is the number needed to treat, number needed to harm and likelihood to be helped or harmed? Int J Clin Pract 2014; 68: 60–82.
- [17] Baldwin DS, Hansen T, Florea I. Vortioxetine (Lu AA21004) in the long-term open-label treatment of major depressive disorder. Curr Med Res Opin 2012; 28: 1717–1724.
- [18] Boulenger JP, Loft H, Florea A. A randomized clinical study of Lu AA21004 in the prevention of relapse in patients with major depressive disorder. J Psychopharmacol 2012; 26: 1408–1416.
- [19] Alam MY, Jacobsen PL, Chen Y, et al. Safety, tolerability, and efficacy of vortioxetine (Lu AA21004) in major depressive disorder: results of an open-label, flexible-dose, 52-week extension study. Int Clin Psychopharmacol 2014; 1: 36–44.
- [20] Theunissen EL, Street D, Højer AM, et al. A randomized trial on the acute and steady-state effects of a new antidepressant, vortioxetine (Lu AA21004), on actual driving and cognition. Clin Pharmacol Ther 2013; 93: 493–501.