Zaměřeno na diabetika v revmatologické ordinaci a na axiální postižení u spondyloartritid
Pořadatelem Zimních revmatologických dnů Ostrava 2020, které se konaly 8.−10. ledna v Clarion Congress Hotelu, byla Česká revmatologická společnost ČLS JEP. Sympozium společnosti Novartis dalo prostor tématům i mimo obor revmatologie a zdůraznilo potřebu individuálního, avšak komplexního pohledu na pacienta, nikoliv pouze na určitou orgánovou soustavu. S přehledem novinek v léčbě diabetes mellitus 2. typu seznámil přítomné doc. MUDr. Martin Prázný, CSc., Ph.D., (III. interní klinika 1. LF UK a VFN Praha).
Na diabetes mellitus 2. typu (DM2T) je pohlíženo jako na globální epidemii, odhaduje se, že v současné době je na světě asi 463 milionů osob s diabetem a do roku 2045 se předpokládá nárůst jejich počtu na 700 milionů. Na léčbu pacientů s tímto onemocněním je vynakládáno odhadem zhruba 12 % celkových zdravotních výdajů. Data z Národního registru hrazených zdravotnických služeb ukazují, že v České republice máme asi milion diabetiků. Průměrný věk diabetika je kolem 70 let, jedná se o velmi rizikovou populaci s vysokým rizikem rozvoje komplikací.
Na explozivním nárůstu počtu pacientů s DM2T se podílejí rizikové faktory, jako je genetická dispozice, roli hraje rodinná zátěž a gestační diabetes v anamnéze. Další rizikové faktory představuje nadměrná hmotnost, nevhodná strava, nedostatek pohybu. Citlivost k inzulinu klesá s věkem a narůstá inzulinová rezistence. Rozvoj hyperglykemie ovlivňuje souhra orgánů a tkání. Hlavní roli hraje díky sekreci inzulinu a glukagonu pankreas. Sekreční schopnost B buněk (schopnost pokrýt zvýšené nároky na sekreci v důsledku inzulinové rezistence) je ovlivněna genetikou. Dalšími orgány jsou svaly (v aktivních svalech probíhá utilizace glukózy, při nedostatečné pohybové aktivitě se spotřeba glukózy snižuje), játra a v nich probíhající glukoneogeneze, dále ledviny, kde se vedle glukoneogeneze uskutečňuje také reabsorpce glukózy. Rozvoje hyperglykemie se účastní také střevo (změněná sekrece GLP 1) a tuková tkáň. V současnosti se pozornost obrací rovněž k mozku a jeho vlivu na onemocnění.
Změna životního stylu od dob lovu a sběračství k získání dostačujícího množství stravy k dnešní éře hyperkalorické stravy se snadnou dostupností a nedostatkem pohybu (ať už jde o sedavé zaměstnání, nebo dopravní prostředky) má zásadní vliv na rozvoj onemocnění. Bylo doloženo, že fyzická aktivita a úprava diety vedou u pacientů s prediabetem k významné prevenci rozvoje DM2T [1]. U nemocných s DM2T už ale úprava životosprávy k dlouhodobému udržení optimální glykemie nestačí [2]. Zhruba 80 % pacientů s diabetem vyžaduje od stanovení diagnózy farmakoterapii.
Významným problémem spojeným s tímto onemocněním jsou diabetické komplikace, které rovněž znamenají ekonomickou zátěž pro zdravotní systém. Potěšující je, že přes narůstající počet diabetiků má výskyt závažných komplikací, kterými jsou terminální stadia renální insuficience a proliferativní retinopatie, spíše klesající tendenci. Ačkoliv se v poslední době daří snížit i výskyt kardiovaskulárních komplikací, jako je infarkt myokardu a cévní mozková příhoda, představují stále nejčastější příčinu mortality pacientů s diabetem.
Docent Prázný demonstroval rizikovost onemocnění na očekávaném přežití muže ve věku 60 let – jeho přežití je při současné diagnóze DM2T zkráceno o šest let a při kombinaci DM2T a kardiovaskulárního onemocnění (infarkt myokardu nebo cévní mozková příhoda) o 12 let. Z tohoto důvodu jsou dnes vítána antidiabetika, která vedle ovlivnění glykemie působí svými neglykemickými účinky na snížení kardiovaskulárního rizika.
Pokrok v léčbě diabetu znamená více léčebných možností a léky s výhodnějšími vlastnostmi. Lékové třídy antidiabetik se významně rozšířily, vedle mikrovaskulárních komplikací jsou schopny ovlivnit i makrovaskulární komplikace.
Základem léčby DM2T je stále metformin, měli by ho užívat od stanovení diagnózy všichni diabetici, kteří nemají kontraindikace a lék tolerují. Metformin zvyšuje inzulinovou senzitivitu, utilizaci glukózy ve svalech, ovlivňuje produkci glukózy v játrech a snižuje vstřebávání glukózy ve střevě. V poslední době stoupá zájem také o jeho doložené, ač ne úplně osvětlené antikancerogenní působení.
Jedenadvacáté století obohatilo
farmakoterapii DM2T o nové možnosti. Pozornost se obrátila
k inkretinům a jejich fyziologickým účinkům. Jedním
z nich je glukagonu podobný peptid 1 (GLP 1), který je
produkován střevním buňkami po příjmu potravy, u diabetiků
se tvoří ve sníženém (nedostatečném) množství.
Inkretiny podporují tvorbu a sekreci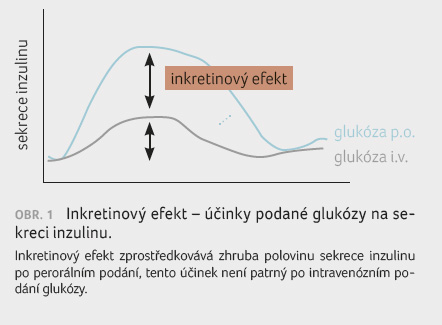 inzulinu v pankreatu
(viz obr. 1),
inhibují sekreci glukagonu, snižují novotvorbu glukózy v játrech,
zpomalují vyprazdňování žaludku a zvyšují pocit sytosti.
Tyto účinky zprostředkovávají agonisté receptoru pro GLP 1
exenatid, liraglutid, semaglutid, dulaglutid, chemicky připravené
molekuly odolnější vůči degradaci enzymem dipeptidyl peptidáza
4 (DPP 4). Snižují hyperglykemii a hodnoty glykovaného
hemoglobinu. Pozitivem léčby je pokles hmotnosti pacientů,
nevýhodou je nutnost injekčního podávání podobně jako
u inzulinu. Do klinické praxe byly zavedeny přípravky
s prodlouženým uvolňováním, které umožňují méně
frekventní aplikaci.
inzulinu v pankreatu
(viz obr. 1),
inhibují sekreci glukagonu, snižují novotvorbu glukózy v játrech,
zpomalují vyprazdňování žaludku a zvyšují pocit sytosti.
Tyto účinky zprostředkovávají agonisté receptoru pro GLP 1
exenatid, liraglutid, semaglutid, dulaglutid, chemicky připravené
molekuly odolnější vůči degradaci enzymem dipeptidyl peptidáza
4 (DPP 4). Snižují hyperglykemii a hodnoty glykovaného
hemoglobinu. Pozitivem léčby je pokles hmotnosti pacientů,
nevýhodou je nutnost injekčního podávání podobně jako
u inzulinu. Do klinické praxe byly zavedeny přípravky
s prodlouženým uvolňováním, které umožňují méně
frekventní aplikaci.
Druhou skupinou léků podporujících účinky inkretinů jsou inhibitory DPP 4 (gliptiny), které blokádou odbourávání fyziologických inkretinů umožňují dosáhnout jejich zhruba fyziologických hodnot. Gliptiny – sitagliptin, vildagliptin, saxagliptin, linagliptin, alogliptin – jsou hmotnostně neutrální, výhodou této léčby je perorální podání. Přednosti léčiv založených na inkretinovém efektu oproti starším přípravkům typu deriváty sulfonylurey představují výrazné snížení rizika hypoglykemie, neutrální vliv na hmotnost a kardiovaskulární bezpečnost.
Další moderní lékovou skupinou určenou k léčbě DM2T jsou inhibitory transportéru pro zpětné vychytávání glukózy a sodíku v ledvinách (SGLT2), které navozují terapeutickou glykosurii. Glifloziny působí nefroprotektivně, vedou k poklesu tělesné hmotnosti a krevního tlaku. Osmotický efekt je zodpovědný za jejich mimoAřádné neglykemické účinky, které pravděpodobně brzy etablují tuto lékovou skupinu ve farmakoterapii srdečního selhání. Tato léčba prokázala vliv na snížení počtu rehospitalizací pro srdeční selhání a snížení kardiovaskulární mortality.
Tyto nové skupiny léčiv jsou zkoumány v řadě klinických hodnocení, kde je sledována jejich kardiovaskulární bezpečnost. Při léčbě glifloziny byla doložena výrazná nefroprotektivita (EMPA REG OUTCOME, CANVAS, RECLARE TIMI 58) a přínos u pacientů se srdečním selháním (DAPA HF). Skupina agonistů receptoru pro GLP 1 má pozitivní vliv na progresi aterosklerózy a výskyt aterosklerotických komplikací. Z těchto důvodů jsou tyto lékové skupiny v algoritmu léčby diabetu upřednostňovány u pacientů v sekundární prevenci kardiovaskulárních příhod, objevují se i data pro prevenci primární.
Docent Prázný v závěru svého vystoupení shrnul, že pacienti s DM2T umírají předčasně, stále dominují kardiovaskulární příčiny úmrtí. Prevencí vzniku mikrovaskulárních komplikací je výborná kompenzace. Důraz je dnes kladen na bezpečnost léčby, zejména na riziko hypoglykemie. Nové, moderní skupiny léčiv nabízejí vedle snížení glykemie navíc také neglykemické účinky – snížení krevního tlaku, hmotnosti, nefroprotektivní působení či snížení kardiovaskulárního rizika.
Axiální postižení u pacientů se spondyloartritidami
S druhým sdělením již z oboru revmatologie, které bylo zaměřeno na axiální projevy spondyloartritid a účinnost sekukinumabu u pacientů s psoriatickou artritidou (PsA), předstoupila před auditorium MUDr. Mária Filková (Revmatologický ústav a Klinika revmatologie 1. LF UK v Praze). Přednášející v úvodu upozornila, že většina dat o axiálních projevech spondyloartritid pochází od pacientů s ankylozující spondylitidou (AS), a zaměřila své sdělení na méně diskutované téma, a to axiální postižení u nemocných s PsA.
Spondyloartritidy představují skupinu
různých onemocnění, která mají některé společné příznaky
s dominujícím axiálním nebo periferním postižením [3]
(obr. 2). 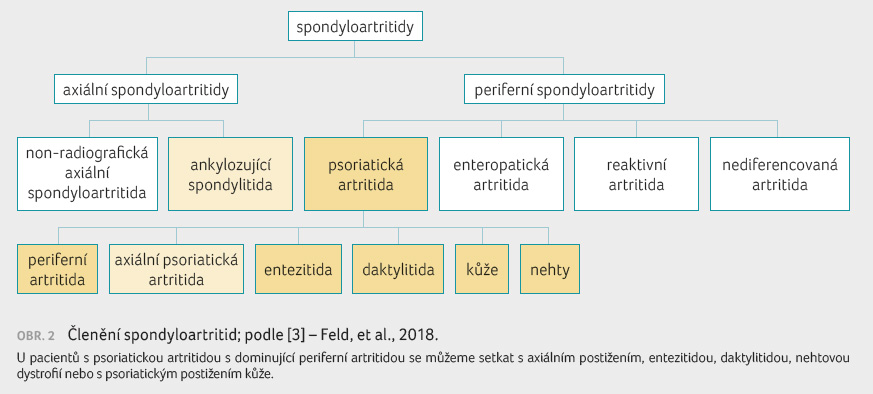 Mezi typické
axiální spondyloartritidy řadíme AS, typické periferní, mnohdy
velmi závažné postižení vidíme například u pacientů
s PsA. Prevalence axiálního postižení u nemocných
s PsA se signifikantně liší, u časné PsA postihuje asi
5 % pacientů, s délkou trvání PsA jeho výskyt stoupá
a v pozdním stadiu je axiální postižení zaznamenáno
až u 75 % nemocných. Bylo zjištěno, že 2–5 % pacientů
má pouze axiální postižení a přibližně 15 % nemocných
s PsA vyvine axiální postižení v průběhu prvních 10
let onemocnění. Rizikovými faktory časné axiální PsA jsou
počet postižených kloubů (prokázáno radiologicky), zvýšená
sedimentace erytrocytů a pozitivita HLA B27. U pozdní
axiální PsA představují rizikové a negativní prognostické
faktory počet postižených kloubů, zvýšená sedimentace,
psoriatické postižení nehtů a periostitida [4].
Mezi typické
axiální spondyloartritidy řadíme AS, typické periferní, mnohdy
velmi závažné postižení vidíme například u pacientů
s PsA. Prevalence axiálního postižení u nemocných
s PsA se signifikantně liší, u časné PsA postihuje asi
5 % pacientů, s délkou trvání PsA jeho výskyt stoupá
a v pozdním stadiu je axiální postižení zaznamenáno
až u 75 % nemocných. Bylo zjištěno, že 2–5 % pacientů
má pouze axiální postižení a přibližně 15 % nemocných
s PsA vyvine axiální postižení v průběhu prvních 10
let onemocnění. Rizikovými faktory časné axiální PsA jsou
počet postižených kloubů (prokázáno radiologicky), zvýšená
sedimentace erytrocytů a pozitivita HLA B27. U pozdní
axiální PsA představují rizikové a negativní prognostické
faktory počet postižených kloubů, zvýšená sedimentace,
psoriatické postižení nehtů a periostitida [4].
Ankylozující spondylitida a PsA jsou různá onemocnění s některými společnými projevy. Klinické hodnocení [5], které se zaměřilo na porovnání modifikovaných newyorských kritérií pro AS a kritérií CASPAR pro PsA, vyhodnotilo, že přibližně 24 % pacientů s PSA a AS splňuje kritéria pro obě diagnostické jednotky.
Doktorka Filková se dále zaměřila na screening a objektivní hodnocení axiálního postižení. Typickým projevem axiálního postižení u nemocných se spondyloartritidou je zánětlivá bolest zad, v případě PsA je přítomna u 45 % pacientů s radiografickou formou axiální PsA. Kritéria pro definici axiálního postižení u PsA nejsou jednotná. V některých publikacích jsou uváděna pouze klinická kritéria, u jiných je vyžadováno zhodnocení minimálního radiografického postižení, u jiných splnění všech modifikovaných newyorských kritérií pro AS; v souladu s klasifikačními kritérii ASAS je přínosná detekce sakroiliitidy pomocí magnetické rezonance. Diskutovaným tématem je také hodnocení axiálního postižení prostřednictvím parametrů aktivity onemocnění. Problémem v případě axiálního postižení u PsA je fakt, že většina indexů, které běžně používáme (např. BASDAI), je „vypůjčena“ od pacientů s AS a může způsobit zkreslení hodnocení. Mease a kol. [6] sledovali, jak se odlišují klinické charakteristiky nemocných s PsA, kteří mají zároveň axiální postižení, oproti pacientům s pouze periferním postižením. Axiální postižení u PsA je spojeno s vyšší pravděpodobností středně těžké/těžké psoriázy, vyšší aktivitou onemocnění a s omezením kvality života.
Cílem léčby PsA, jak je uvedeno v doporučení [7], je dosažení co nejnižší možné aktivity onemocnění ve všech aspektech nemoci, zlepšení funkčního statusu, kvality života, zmírnění radiografického postižení na nejnižší možnou úroveň a zamezení/minimalizování komplikací plynoucích z terapie případně neléčeného onemocnění. Terapie by měla být přizpůsobena nejtěžšímu typu postižení, pro zahájení biologické léčby je u axiálního postižení „dostačující“ předchozí selhání dvou nesteroidních antiflogistik (NSAID), u nemocných s periferním postižením je podmínkou selhání terapie pomocí chorobu modifikujících léčiv.
Axiální postižení u PsA odráží závažnější formu tohoto onemocnění s výraznějším dopadem na kvalitu života. Doktorka Filková vyzdvihla anamnestický problém a otázku zánětlivé bolesti zad, která je přítomna u méně než 50 % pacientů s axiálním postižením a zhruba u 33 % nemocných s PsA bez axiálního postižení, a diskrepanci v hodnocení axiálního postižení i odlišnosti v terapeutickém přístupu oproti perifernímu postižení. Vybídla přítomné kolegy k aktivnímu pátrání po axiálním postižení u PsA bez ohledu na bolest zad s následnou adjustací léčby.
Sekukinumab v léčbě spondyloartritid
Přednášející se dále věnovala účinnosti sekukinumabu v terapii spondyloartritid a zejména jeho účinkům na axiální projevy. Sekukinumab představuje monoklonální protilátku proti interleukinu (IL) 17A, která je registrována pro léčbu pacientů s psoriázou, PsA a AS. Jak doložily klinické studie MEASURE, sekukinumab signifikantně ovlivňuje axiální projevy u pacientů s AS, snižuje aktivitu nemoci a přidružených symptomů a zpomaluje radiografickou progresi, a to i v dlouhodobém horizontu sledování čtyř let.
U pacientů s PsA bylo v klinických hodnoceních FUTURE prokázáno, že léčba sekukinumabem snižuje aktivitu onemocnění (hodnoceno pomocí ACR20), inhibuje radiografickou progresi, rozvoj daktylitid a entezitid. Data zaměřená přímo na pacienty s axiálními projevy u PsA po selhání léčby NSAID přináší studie MAXIMISE. Primární analýza této randomizované dvojitě zaslepené studie fáze III byla prezentována na kongresu American College of Rheumatology 2019 [8]. Do studie byli zařazeni dospělí pacienti s diagnózou PsA klasifikovaní podle kritérií CASPAR, kteří trpěli aktivním onemocněním páteře (definovaným lékařem a se skóre BASDAI ≥ 4), se skóre bolesti páteře ≥ 40 dle VAS a s nedostatečnou odpovědí na nejméně dvě NSAID během čtyřtýdenního období. Zařazení nesměli být dříve léčeni jiným inhibitorem IL 17 nebo IL 23. Primárním cílovým ukazatelem byla změna aktivity axiálního postižení po 12 týdnech hodnocené odpovědí ASAS20 při terapii sekukinumabem v dávce 300 mg oproti placebu. U sledovaných pacientů byla průměrná délka trvání příznaků periferní artritidy zhruba sedm let, asi u třetiny nemocných byla prokázána pozitivita HLA B27.
Výsledky sledování po 12
týdnech ukazují (graf 1)
významné zlepšení četnosti odpovědí ASAS20 v aktivní
větvi (terapie sekukinumabem v dávce 300 mg nebo 150 mg
s nasycovacím režimem). U pacientů s PsA lze
předpokládat současnou léčbu metotrexátem (MTX), z tohoto
důvodu byla hodnocena možná závislost efektu léčby při
konkomitantním podávání MTX nebo bez něj. Ve skupině
nemocných léčených sekukinumabem (300 mg a 150 mg)
dosáhlo odpovědi ASAS20 65,1 % a 67,3 % zároveň léčených
MTX a 60,5 % a 64,4 % sledovaných, kteří MTX
neužívali, rozdíl nebyl signifikantní.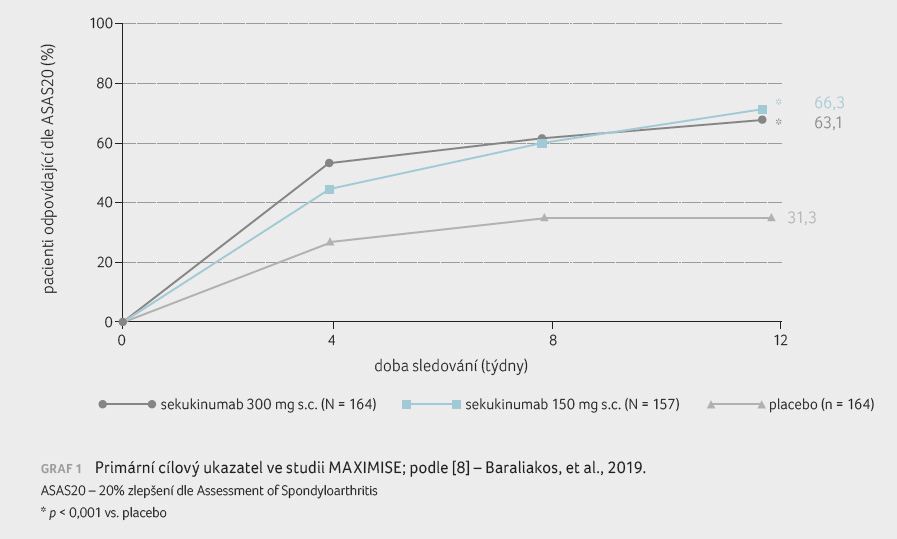
Doktorka Filková shrnula, že klinické
hodnocení MAXIMISE je prvním randomizovaným klinickým
hodnocením, které se specificky zaměřilo na účinnost
a bezpečnost biologického léku u nemocných s PsA
s axiálními projevy. Data potvrzují rychlé a významné
zlepšení dle odpovědi ASAS20 ve 12. týdnu při terapii
sekukinumabem, nezávisle na současném podávání MTX. Profil
bezpečnosti sekukinumabu odpovídal předchozím zjištěním.
Redakčně zpracovala PharmDr. Kateřina
Viktorová
Seznam použité literatury
- [1] Orozco LJ, Buchleitner AM, Gimenez‑Perez G, et al. Exercise or exercise and diet for preventing type 2 diabetes mellitus. Cochrane Database Syst Rev 2008; 3: CD003054.
- [2] Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009; 32: 193–203.
- [3] Feld J, Chandran, V, Haroon N, et al. Axial disease in psoriatic arthritis and ankylosing spondylitis: A critical comparison. Nat Rev Rheumatol 2018; 14: 363–371.
- [4] Chandran V, Tolusso DC, Cook RJ, Gladman DD. Risk factors for axial inflammatory arthritis in patients with psoriatic arthritis. J Rheumatol 2010; 37: 809–815.
- [5] Jadon DR, Sengupta R, Nightingale A, et al. Axial Disease in Psoriatic Arthritis study: defining the clinical and radiographic phenotype of psoriatic spondyloarthritis. Ann Rheum Dis 2017; 76: 701–707.
- [6] Mease P, Palmer JB, Liu M. et al. Influence of Axial Involvement on Clinical Characteristics of Psoriatic Arthritis: Analysis from the Corrona Psoriatic Arthritis/Spondyloarthritis Registry. J Rheumatol 2018; 45: 1389–1396.
- [7] Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheumatol 2016; 68: 1060–1071.
- [8] Baraliakos X, Coates L, Gossec L, et al. Secukinumab Improves Axial Manifestations in Patients with Psoriatic Arthritis and Inadequate Response to NSAIDs: Primary Analysis of Phase 3 Trial. 2019 ACR/ARP Annual Meeting, Abstr. Nr. 2880.