Dostarlimab
Souhrn
Zikán M. Dostarlimab. Remedia 2024; 34: 156–160.
Dostarlimab je humanizovaná monoklonální protilátka izotypu IgG4, která se váže na receptory programované buněčné smrti 1 (PD‑1), a blokuje tak jejich vazebné interakce s ligandy PD‑L1 a PD‑L2. Výsledkem inhibice dráhy PD‑1/PD-L1 dostarlimabem je zesílení reakce T lymfocytů včetně protinádorové imunitní odpovědi. Dostarlimab patří do skupiny tzv. checkpoint inhibitorů a je indikován v kombinaci s karboplatinou a paklitaxelem k léčbě dospělých pacientek s primárně pokročilým nebo rekurentním karcinomem endometria s deficitní opravou chybného párování bazí (dMMR) či s vysokou mikrosatelitovou nestabilitou (MSI‑H), které jsou indikovány k systémové léčbě, a dále jako monoterapie k léčbě dospělých pacientek s rekurentním nebo pokročilým karcinomem endometria s dMMR/MSI‑H, u něhož došlo k progresi v průběhu předchozí léčby režimem obsahujícím platinu nebo po ní. Účinnost a bezpečnost dostarlimabu byly potvrzeny v klinických studiích RUBY a GARNET.
Klíčová slova: dostarlimab – karcinom endometria – checkpoint inhibitory – studie RUBY – studie GARNET.
Summary
Zikan M. Dostarlimab. Remedia 2024; 34: 156–160.
Dostarlimab is a humanized monoclonal antibody of the IgG4 isotype binding to the receptors of programmed cell death 1 (PD‑1), thus blocking their interactions with ligands PD‑L1 and PD‑L2. The inhibition of the PD‑1/PD-L1 pathway by dostarlimab enhances the reaction of T‑lymphocytes including the antitumor immune response. Dostarlimab belongs to the checkpoint inhibitor group. Combined with carboplatin and paclitaxel, it is used for treatment of patients suffering from primarily advanced or recurrent endometrial carcinoma with deficient mismatch repair (dMMR) or high microsatellite instability (MSI‑H) in whom systemic treatment is indicated. It may also be used in monotherapy for adult patients with recurrent or advanced endometrial carcinoma characterized by dMMR/MSI‑H experiencing disease progression during previous therapy, no matter whether it included platinum or not. Both effectiveness and safety of dostarlimab were confirmed in the RUBY and GARNET trials.
Key words: dostarlimab – endometrial carcinoma – checkpoint inhibitors – RUBY trial – GARNET trial.
Úvod
Cílená – nebo biologická – léčba je pojmem užívaným v klinické onkologii již dlouhou dobu. Jednou z oblastí cílené léčby je imunoterapie, oblast využívající látky a postupy, které vstupují do imunitních procesů ovlivňujících zhoubný nádor. Jedná se o přístup známý již delší dobu, do léčby gynekologických malignit však začal pronikat teprve nedávno a nová dostupná data o účinnosti zejména checkpoint inhibitorů přinášejí průlom do terapie pokročilého a recidivujícího karcinomu endometria [1].
Checkpoint inhibitory (inhibitory kontrolních bodů imunitní reakce) jsou v tuto chvíli nejrozšířenějším typem imunoterapie v léčbě zhoubných nádorů. Když efektorová T buňka naváže specifický ligand na nádorovou buňku, imunitní kontrolní body (checkpointy, lze si je představovat také jako signalizační cesty) mohou posílit nebo potlačit imunitní odpověď. Imunitní kontrolní body fungují jako mechanismus negativní zpětné vazby, který moduluje odpověď efektorových buněk, aby chránil hostitele před autoimunitou a udržoval autotoleranci. Tyto dráhy hrají důležitou roli během nádorového bujení, protože jsou hlavním mechanismem imunitní rezistence nádorových buněk, v podstatě tlumí útok vlastní imunity proti nádoru. Součástí nejprozkoumanějších a nejrozšířenějších kontrolních bodů jsou povrchové molekuly T buněk, jako jsou cytotoxický T lymfocytární antigen 4 (cytotoxic T‑lymphocyte antigen 4, CTLA‑4) a receptor programované buněčné smrti 1 (programmed cell death 1, PD‑1).
Nádorově specifická imunitní odpověď se aktivuje po rozpoznání antigenů specifických pro nádorové buňky. Antigen prezentující buňky (antigen presenting cells, APCs), podobně jako dendritické buňky, migrují do lymfatických uzlin a prezentují antigeny T lymfocytům, které jsou pak následně zodpovědné za útok na nádor. Kontrolní body imunitního systému upravují odpověď T buněk, potlačují nebo stimulují imunitu během prezentace antigenu. Tyto imunitní mechanismy jsou přítomny i v nádorovém mikroprostředí. Interakce proteinu PD‑1 na T lymfocytech a proteinu PD‑L1 (programmed cell death ligand 1) na nádorových buňkách tlumí působení T lymfocytů. U pacientek s gynekologickými nádory je exprese PD‑L1 spojena s horší prognózou a koreluje s útlumem lokální imunitní odpovědi. Mechanismus tohoto typu imunoterapie (checkpoint inhibitorů) je založen na blokování cest potlačení přirozené imunitní odpovědi, což umožňuje T lymfocytům zůstat aktivními a likvidovat nádorové buňky (tedy inhibujeme inhibici). Odpověď na léčbu přípravky anti‑PD‑1/anti‑PD‑L1 závisí na heterogenitě nádorového mikroprostředí, především na počtu infiltrujících T lymfocytů a úrovni jejich aktivity.
U karcinomu endometria můžeme v současné době na základě molekulárního profilu rozpoznat čtyři typy nádorů, které se liší svým biologickým chováním i odpovědí na případnou cílenou léčbu imunoterapií: nádory s mutací polymerázy epsilon (POLE mutované), nádory s aberantní expresí p53 (p53 aberantní), nádory s defektem opravy DNA nástrojem mismatch repair (deficient mismatch repair, dMMR) a nádory s nespecifickým molekulárním profilem (no specific molecular profile, NSMP). Tento molekulární profil (typ) nemusí korelovat s histomorfologickým obrazem nádoru [1]. Nádory dMMR reprezentují zhruba čtvrtinu všech karcinomů endometria [2]. Defekt opravy chybného párování bazí (mismatch repair) se může v dalších molekulárních vyšetřeních projevovat také tzv. mikrosatelitovou nestabilitou, tedy variabilitou repetitivních sekvencí DNA – nekódujících úseků DNA, v nichž se tandemově, mnohokrát za sebou, opakuje krátký motiv sekvence několika bazí (repetice). Defekt mismatch repair jako jednoho ze systémů opravy DNA vede k jejich chybnému řazení, respektive chybám v jejich počtu, což generuje fragmenty DNA s různým počtem repetic. Pak mluvíme o nádoru s vysokou mikrosatelitovou nestabilitou (microsatellite instability‑high, MSI‑H). Oba pojmy (dMMR a MSI‑H) jsou z klinického pohledu zaměnitelné. Defekt mismatch repair dále generuje v důsledku kumulace chyb (mutací) při replikaci DNA řadu nových bílkovinných struktur (tvořených na základě defektních genů), které mohou potencovat imunitní odpověď vůči nádoru. Proto jsou karcinomy tohoto molekulárního typu nejvhodnějšími kandidáty pro léčbu checkpoint inhibitory [1].
Dostarlimab je indikován v kombinaci s karboplatinou a paklitaxelem k léčbě dospělých pacientek s primárně pokročilým nebo rekurentním karcinomem endometria s dMMR či MSI‑H, které jsou indikovány k systémové léčbě (tzn. nejsou kandidátkami pro kurativní chirurgickou léčbu nebo radioterapii).
Dále je indikován jako monoterapie k léčbě dospělých pacientek s rekurentním nebo pokročilým karcinomem endometria s dMMR/MSI‑H, u něhož došlo k progresi v průběhu předchozí léčby režimem obsahujícím platinu nebo po ní (tedy pacientky již předléčené chemoterapií, které opět nejsou kandidátkami pro chirurgickou léčbu nebo radioterapii) [3].
Mechanismus účinku
Dostarlimab je humanizovaná monoklonální protilátka izotypu IgG4, která se váže na receptory PD‑1, a blokuje tak jejich vazebné interakce s ligandy PD‑L1 a PD‑L2. Aktivace dráhy PD‑1/PD‑L vede k inhibici funkce T lymfocytů (jako je např. inhibice proliferace, produkce cytokinů a cytotoxické aktivity) – nádor se tímto způsobem (expresí PD‑1 nebo častěji tvorbou PD‑L1) brání útoku imunitního systému. Výsledkem inhibice dráhy PD‑1 dostarlimabem (inhibice interakce mezi receptorem a ligandem obsazením receptoru protilátkou) je zesílení reakce T lymfocytů, včetně protinádorové imunitní odpovědi. Na modelech syngenních nádorových buněk u myší vedlo blokování aktivity PD‑1 ke zpomalení růstu nádoru [3].
Farmakologické vlastnosti a lékové interakce
Farmakokinetika dostarlimabu byla hodnocena při podávání v monoterapii a v kombinaci s karboplatinou a paklitaxelem. Při dávkování v doporučené terapeutické dávce pro monoterapii (500 mg podáváno intravenózně každé 3 týdny ve 4 cyklech, poté 1 000 mg každých 6 týdnů) nebo v doporučené terapeutické dávce pro kombinaci s karboplatinou a paklitaxelem (500 mg podáváno intravenózně každé 3 týdny v 6 dávkách, poté 1 000 mg každých 6 týdnů) vykazoval dostarlimab přibližně dvojnásobnou akumulaci (cmin), což odpovídá eliminačnímu poločasu (t1/2). Expozice dostarlimabu byla obdobná při podávání v monoterapii i v kombinaci s karboplatinou a paklitaxelem. Průměrný distribuční objem dostarlimabu v ustáleném stavu je přibližně 5,8 l (variační koeficient 14,9 %) [3].
Dostarlimab je terapeutická monoklonální protilátka izotypu IgG4, u níž se očekává, že bude procesem endocytózy (pinocytózy nebo endocytózy zprostředkované receptorem) rozkládána lysozomy na oligopeptidy, aminokyseliny a oligosacharidy. Produkty rozpadu jsou eliminovány renální exkrecí nebo vraceny do zásobárny živin, aniž by vykazovaly biologické účinky.
Průměrná clearance je 0,007 l/h (variační koeficient 30,2 %) v ustáleném stavu. Hodnota t1/2 v ustáleném stavu je 23,2 dne (variační koeficient 20,8 %). Clearance dostarlimabu při podávání v kombinaci s karboplatinou a paklitaxelem byla dle odhadu o 7,8 % nižší. Neprojevil se žádný významný dopad na expozici dostarlimabu.
Na základě vztahů mezi účinností a bezpečností při expozici nebyly zjištěny žádné klinicky významné rozdíly v účinnosti a bezpečnosti při dvojnásobné expozici dostarlimabu. Při doporučeném terapeutickém dávkování vydržela úplná obsazenost receptoru, měřená přímou vazbou na PD‑1 a funkčním testem produkce interleukinu 2 (IL‑2), během celého dávkovacího intervalu.
Populační farmakokinetická analýza údajů pacientek ukazuje, že věk (rozmezí 24–86 let), pohlaví nebo rasa, etnický původ nebo typ nádoru nemají žádné klinicky významné účinky na clearance dostarlimabu [3].
Pro dostarlimab nebyly provedeny žádné studie lékových interakcí. Monoklonální protilátky, jako je dostarlimab, nejsou substrátem cytochromu P450 ani transportérů léčivých látek. Dostarlimab není cytokin a není pravděpodobné, že by byl modulátorem cytokinů. Farmakokinetické interakce dostarlimabu s léčivými látkami s malou molekulou se nepředpokládají. Pro protilátky nejsou k dispozici žádné důkazy dokládající interakci zprostředkovanou nespecifickou clearance degradace lysozomů.
Údaje o podávání dostarlimabu těhotným ženám jsou omezené nebo nejsou k dispozici. Pokud je dostarlimab podáván v průběhu těhotenství, může mít na základě svého mechanismu působení škodlivé farmakologické účinky na plod. Reprodukční studie na zvířatech nebyly s dostarlimabem provedeny, nicméně předpokládá se, že inhibice cesty PD‑1/PD‑L1 může vést ke zvýšenému riziku imunitně zprostředkovaného odmítnutí vyvíjejícího se plodu s následkem jeho úmrtí. Je známo, že lidské imunoglobuliny (IgG4) procházejí placentární bariérou, a vzhledem k tomu, že dostarlimab je IgG4, může potenciálně přecházet z matky na vyvíjející se plod.
Ženy ve fertilním věku musejí během léčby dostarlimabem a ještě čtyři měsíce po podání poslední dávky používat účinnou antikoncepci. V klinické praxi se nicméně pouze raritně setkáme s premenopauzálními pacientkami s ponechanou dělohou [3].
Klinické studie
Aktuální indikační spektrum dostarlimabu u žen s karcinomem endometria je definováno na základě dvou klinických studií.
První linie léčby, dostarlimab v kombinaci s chemoterapií
RUBY byla multicentrická randomizovaná, dvojitě zaslepená, placebem kontrolovaná klinická studie fáze III zkoumající účinnost a bezpečnost dostarlimabu v kombinaci s karboplatinou a paklitaxelem u pacientek s primárně pokročilým nebo rekurentním karcinomem endometria [4].
Do studie byly zahrnuty pacientky s primárním nádorem ve stadiu III nebo IV dle klasifikace podle Mezinárodní federace gynekologie a porodnictví (International Federation of Gynecology and Obstetrics, FIGO), včetně stadia IIIA–IIIC1 s přítomností hodnotitelného nebo měřitelného onemocnění podle kritérií RECIST (Response Evaluation Criteria in Solid Tumors) 1.1, pacientky ve stadiu IIIC1 s karcinosarkomem, světlobuněčným karcinomem, serózním karcinomem či s karcinomem se smíšenou histologií (obsahujícím histologicky z ≥ 10 % karcinosarkom, světlobuněčný karcinom nebo serózní karcinom) bez ohledu na přítomnost hodnotitelného nebo měřitelného onemocnění při zobrazení, onemocnění ve stadiu IIIC2 nebo ve stadiu IV bez ohledu na přítomnost hodnotitelného nebo měřitelného onemocnění. Do studie byly dále zařazeny pacientky s karcinomem endometria s první recidivou s nemožností kurativní radioterapie či chirurgického výkonu samostatně nebo v kombinaci, včetně pacientek s první rekurencí onemocnění, jimž dosud nebyla podávána systémová protinádorová léčba nebo kterým byla dříve podávána neoadjuvantní/adjuvantní systémová protinádorová léčba, po níž došlo k recidivě či progresi onemocnění za šest a více měsíců po skončení terapie. Pacientky nesměly podstoupit radioterapii v období 21 dní před zahájením studijní léčby s výjimkou paliativní radioterapie, která byla přípustná až do jednoho týdne před zahájením zkoušené léčby.
Pacientky byly randomizovány (1 : 1) do skupiny, které byl podáván dostarlimab v dávce 500 mg plus karboplatina AUC 5 a paklitaxel v dávce 175 mg/m2 každé tři týdny v prvních šesti cyklech a následně dostarlimab 1 000 mg každých šest týdnů, nebo do skupiny, které bylo podáváno placebo plus karboplatina AUC 5 a paklitaxel 175 mg/m2 každé tři týdny v šesti cyklech a následně placebo každých šest týdnů. Stratifikace při randomizaci zahrnovala status MMR/MSI, předchozí externí radioterapii pánve a stav onemocnění (rekurentní, primární stadium III nebo primární stadium IV). Léčba pokračovala maximálně tři roky nebo do nepřijatelné toxicity, progrese onemocnění nebo rozhodnutí zkoušejícího lékaře. Vyhodnocení odpovědi nádoru se provádělo do 25. týdne vždy po šesti týdnech, do 52. týdne vždy po devíti týdnech a následně vždy po 12 týdnech [4].
Primárním cílem studie bylo hodnocení jak přežití bez progrese (progression‑free survival, PFS), které zkoušející posuzovali podle kritérií RECIST 1.1 u subjektů s primárně pokročilým či rekurentním karcinomem endometria s dMMR/MSI‑H a u všech subjektů (celková populace – intention‑to‑treat, ITT) s primárně pokročilým či rekurentním karcinomem endometria, tak celkového přežití (overall survival, OS) u všech pacientek (celková populace ITT) s primárně pokročilým či rekurentním karcinomem endometria.
Molekulární typ nádoru (dMMR/MSI‑H) byl stanovován prospektivně na základě výsledků lokálních testů (IHC – imunohistochemie, PCR – polymerázová řetězová reakce, nebo NGS – sekvenování nové generace), případně na základě výsledku centrálního testování (IHC) v případě absence lokálního vyšetření.
Ze 494 pacientek randomizovaných ve studii mělo 118 (23,9 %) nádor s dMMR nebo MSI‑H. Výchozí demografické parametry a charakteristiky byly následující: medián věku 64 let; 85 % bělošky, 9 % černošky, 2 % Asiatky; performance status (PS) dle ECOG (Eastern Cooperative Oncology Group) 0 (57 %) nebo 1 (43 %); primární karcinom ve stadiu III 21 %, primární karcinom ve stadiu IV 30 %, rekurentní karcinom endometria 49 %; endometroidní karcinom 85 %, smíšený karcinom 5 %, karcinosarkom 4 %, serózní karcinom 2 %, jiné 4 %; předchozí chirurgická léčba 92 %, předchozí radioterapie 35 %, předchozí protinádorová léčba 14 %.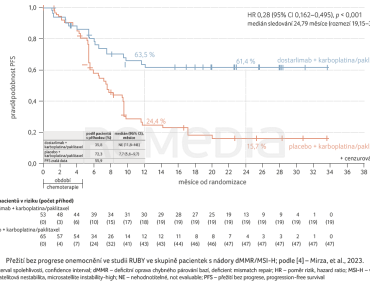
U pacientek s dMMR/MSI‑H nádory bylo PFS po 24 měsících 61,4 % (95% interval spolehlivosti [CI] 46,3–73,4) ve skupině s dostarlimabem a 15,7 % (95% CI 7,2–27,0) ve skupině s placebem (poměr rizik [HR] pro progresi nebo úmrtí 0,28; 95% CI 0,16–0,50; p < 0,001), graf 1 [4]. V celkové populaci bylo PFS po 24 měsících 36,1 % (95% CI 29,3–42,9) ve skupině s dostarlimabem a 18,1 % (95% CI 13,0–23,9) ve skupině s placebem (HR 0,64; 95% CI 0,51–0,80; p < 0,001). U pacientek s dMMR/MSI‑H nádory bylo OS po 24 měsících 83,3 % (95% CI 66,8–92,0) ve skupině s dostarlimabem a 58,7 % (95% CI 43,4–71,2) ve skupině s placebem (HR pro progresi nebo úmrtí 0,30; 95% CI 0,13–0,70), graf 2 [4]. Celkové přežití po 24 měsících bylo 71,3 % (95% CI 64,5–77,1) ve skupině s dostarlimabem a 56,0 % (95% CI 48,9–62,5) ve skupině s placebem (HR pro úmrtí 0,64; 95% CI 0,46–0,87). Nejčastějšími nežádoucími účinky byly nevolnost (53,9 % pacientů ve skupině s dostarlimabem a 45,9 % pacientů ve skupině s placebem), alopecie (53,5 % a 50,0 %) a únava (51,9 % a 54,5 %).
Studie RUBY tak prokázala statisticky významné zlepšení PFS u pacientek randomizovaných do skupiny s dostarlimabem v kombinaci s karboplatinou a paklitaxelem oproti skupině s placebem v kombinaci s karboplatinou a paklitaxelem.
Na letošním výročním sjezdu americké Společnosti gynekologických onkologů (SGO Annual Meeting on Women’s Cancer) byly prezentovány výsledky druhé průběžné analýzy studie RUBY. U pacientek s dMMR/MSI‑H nádory byla pravděpodobnost OS při mediánu sledování 36,6 měsíce ve skupině s dostarlimabem 78,0 % a ve skupině s placebem 46,0 % (HR 0,32; 95% CI 0,17–0,63; p = 0,0002). Pravděpodobnost OS pro celkovou skupinu pacientek ve studii (ITT) při mediánu sledování 37,2 měsíce byla 54,9 % ve skupině s dostarlimabem a 42,9 % ve skupině s placebem (HR 0,69; 95% CI 0,54–0,89; p = 0,002) [5]. Snížení rizika úmrtí ve skupině s dostarlimabem dosáhlo statistické signifikance.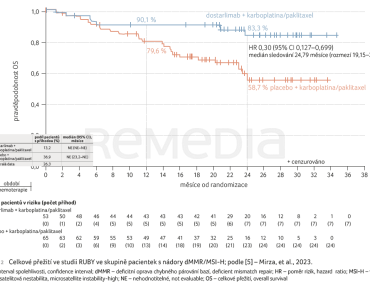
Další linie léčby, dostarlimab v monoterapii
Účinnost a bezpečnost dostarlimabu v monoterapii byla hodnocena ve studii GARNET (dospělé pacientky s rekurentním nebo pokročilým karcinomem endometria s dMMR/MSI‑H, u nichž došlo k progresi v průběhu léčby režimem obsahujícím platinu nebo po ní) [6]. Jednalo se o multicentrickou nekontrolovanou, otevřenou studii s více paralelními kohortami. Studie zahrnovala expanzní kohorty pacientek s recidivujícími nebo pokročilými solidními nádory, které mají omezené možnosti léčby. Kohorta A1 zahrnovala pacientky s dMMR/MSI‑H karcinomem endometria, které progredovaly na chemoterapii na bázi platiny nebo podstoupily chemoterapii obsahující platinu a progredovaly po jejím skončení.
Pacientkám byl aplikován dostarlimab v dávce 500 mg každé tři týdny, a to ve čtyřech cyklech, poté v dávce 1 000 mg každých šest týdnů. Léčba pokračovala až do nepřijatelné toxicity nebo progrese onemocnění po dobu až dvou let.
Hlavními kritérii hodnocení účinnosti byly výskyt objektivní léčebné odpovědi (objective response rate, ORR) a trvání odpovědi (duration of response, DOR) stanovené na základě zaslepeného nezávislého centrálního radiologického hodnocení za využití kritérií pro hodnocení odpovědi u solidních nádorů (RECIST v 1.1). Pro stanovení účinnosti byla populace definována jako pacientky, které měly před zahájením léčby měřitelné onemocnění a byly sledovány po dobu alespoň 24 týdnů nebo byly sledovány po dobu kratší než 24 týdnů a léčbu ukončily kvůli nežádoucím účinkům nebo progresi onemocnění [6].
Účinnost byla ve studii GARNET hodnocena celkem u 143 pacientek s karcinomem endometria s dMMR/MSI‑H a s populačními charakteristikami: medián věku 65 let (52 % pacientek bylo starších 65 let); 77 % bělošky, 3,5 % Asiatky, 2,8 % černošky; PS dle ECOG 0 (39 %) nebo 1 (61 %). V době stanovení diagnózy byl u 21 % pacientek s dMMR/MSI‑H karcinomem endometria nádor ve stadiu IV dle klasifikace FIGO. Medián počtu předchozích linií terapie byl jedna – 63 % pacientek absolvovalo jednu předchozí linii terapie a 37 % pacientek absolvovalo dvě a více předchozích linií terapie. Čtyřicet devět pacientek (34 %) bylo před vstupem do studie léčeno pouze v neoadjuvantním nebo adjuvantním režimu.
Dvacet čtyři procent pacientek, kterým bylo podáno jakékoliv množství dostarlimabu, bylo léčeno déle než dva roky.
Molekulární typ nádoru (dMMR/MSI‑H) byl stanovován prospektivně na základě výsledků lokálních testů (IHC, PCR, nebo NGS), nejčastěji se jednalo o IHC jako o nejdostupnější způsob vyšetření.
Výstupem studie byl průkaz významného klinického účinku – ORR 45,5 % (95% CI 37,1–54,0) u dMMR nádorů a 15,4 % (95% CI 10,1–22,0) u MMR procifientních nádorů. Souhrn kompletní a parciální odpovědi nádoru na léčbu a stabilního onemocnění (disease control rate, DCR) byl 60,1 % (dMMR) a 34,0 %. Nežádoucí účinky byly zaznamenány u 63,5 % žen s dMMR a 71,7 % pacientek s MMR proficientním nádorem, z toho 13,5 %, resp. 19,3 % představovaly závažné nežádoucí účinky [6,7].
Nežádoucí účinky
Nejčastějšími nežádoucími účinky ve studii RUBY byly nevolnost (53,9 % pacientů ve skupině s dostarlimabem a 45,9 % pacientů ve skupině s placebem), alopecie (53,5 % a 50,0 %) a únava (51,9 % a 54,5 %) [4].
U pacientek léčených checkpoint inhibitory, resp. protilátkami proti PD‑1 nebo PD‑L1 včetně dostarlimabu se mohou také často vyskytovat imunitně podmíněné nežádoucí účinky, a to jak v průběhu, tak i po ukončení léčby. Imunitně podmíněné nežádoucí účinky mohou postihnout jakýkoliv orgán nebo tkáň a více než jeden systém v organismu současně. Nejčastěji se setkáváme s hypo‑ nebo hypertyreózou, hypofyzitidou, diabetes mellitus 1. typu nebo adrenální insuficiencí. Mohou se však vyskytnout také imunitně podmíněná pneumonie, kolitida či hepatitida.
Pro zajištění bezpečného používání protilátek blokujících PD‑1/PD‑L1 je nutné imunitně podmíněné nežádoucí účinky včas identifikovat a léčit. Na začátku léčby a následně pravidelně v jejím průběhu je nutné provádět laboratorní monitorování včetně jaterních testů, vyšetření renálních funkcí a funkce štítné žlázy.
Podle závažnosti nežádoucího účinku je nutné léčbu dostarlimabem přerušit nebo trvale ukončit a zahájit podávání kortikosteroidů (1–2 mg/kg/den prednisonu nebo ekvivalentu), ev. zahájit substituční léčbu v případě endokrinních hypofunkcí. Po zlepšení na stupeň ≤ 1 je nutné zahájit snižování dávky kortikosteroidů, jejichž podávání má pokračovat ještě po dobu jednoho měsíce nebo déle [3].
Praktické aspekty léčby
Léčba dostarlimabem je zpravidla velmi dobře tolerována, rozdíl mezi nežádoucími účinky při podání v monoterapii nebo v kombinaci s chemoterapií není výrazný. Rozvoj endokrinopatií patří mezi nejčastější nežádoucí účinky, je však většinou dobře kontrolovatelný.
Dostarlimab nemá dosud ani v jedné ze dvou indikací úhradu, je nutné podat žádost příslušné zdravotní pojišťovně. Jedná se však jednoznačně o léčbu nejúčinnější a v Evropě schválenou indikaci.
Závěr
Dostarlimab je checkpoint inhibitorem, který vnáší do léčby závažného pokročilého nebo recidivujícího karcinomu endometria nový rozměr nejen s ohledem na účinnost a prodloužení jak přežití bez progrese onemocnění, tak celkového přežití pacientek, ale také s ohledem na zachování kvality života v souvislosti s příznivým bezpečnostním profilem. Nezbývá než doufat, že výše uvedená data budou rovněž reflektována v úhradě přípravku.
Prof. MUDr. Michal Zikán, Ph.D.
Gynekologicko-porodnická klinika 1. LF UK a FN Bulovka
Budínova 67/2, 180 81 Praha 8
e-mail: michal.zikan@bulovka.cz
Literatura
[1] Zikán M, et al. Onkogynekologie. Praha: Maxdorf, 2024, 334 s.
[2] Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, [2005], [cit. 2024‑4‑21]. Dostupné na: http://www.svod.cz. Verze 7.0 [2007], ISSN 1802–8861.
[3] SPC Jemperli. SÚKL. Dostupné na: https://www.ema.europa.eu/cs/documents/product‑information/jemperli‑epar‑product‑information_cs.pdf
[4] Mirza MR, Chase DM, Slomovitz BM, et al.; RUBY Investigators. Dostarlimab for Primary Advanced or Recurrent Endometrial Cancer. N Engl J Med 2023; 388: 2145–2158.
[5] Powell MA, Auranen A, Willmott L, et al. Overall survival in patients with primary advanced or recurrent endometrial cancer treated with dostarlimab plus chemotherapy in Part 1 of the ENGOT‑EN6‑NSGO/GOG‑3031/RUBY trial. SGO Annual Meeting on Women’s Cancer, San Diego, 16‑18 March, 2024.
[6] Oaknin A, Gilbert L, Tinker AV, et al. Safety and antitumor activity of dostarlimab in patients with advanced or recurrent DNA mismatch repair deficient/microsatellite instability‑high (dMMR/MSI‑H) or proficient/stable (MMRp/MSS) endometrial cancer: interim results from GARNET‑a phase I, single‑arm study. J Immunother Cancer 2022; 10: e003777.
[7] Oaknin A, Pothuri B, Gilbert L, et al. Safety, Efficacy, and Biomarker Analyses of Dostarlimab in Patients with Endometrial Cancer: Interim Results of the Phase I GARNET Study. Clin Cancer Res 2023; 29: 4564–4574.