Aktualizace doporučení pro léčbu psoriatické artritidy EULAR 2023 a postavení bimekizumabu
Příchod léčiv s novým mechanismem účinku a nová data o účinnosti a bezpečnosti stávajících léků podnítily Evropskou alianci revmatologických asociací (European Alliance of Associations for Rheumatology, EULAR) k aktualizaci doporučení pro farmakoterapii psoriatické artritidy (PsA) z roku 2019. Na základě přezkoumání dostupné evidence a konsenzu odborníků na mezinárodní úrovni byly na počátku tohoto roku publikovány nové guidelines [1].
 Aktualizované doporučené postupy, které obsahují sedm zastřešujících principů a jedenáct doporučení, by měly poskytnout podklad pro léčebnou strategii. Tento update se věnuje PsA v celém spektru projevů; zahrnuty jsou lehké formy onemocnění, algoritmus farmakoterapie při převažující muskuloskeletální manifestaci, v případě psoriatického postižení i přítomnosti komorbidit. Výběr kokrétního léčiva pro pacienta by měl být založen na údajích o jeho účinnosti, klinickém fenotypu onemocnění, profilu nežádoucích účinků, snášenlivosti, se zohledněním nákladů na léčbu a dostupnosti. Řešena je otázka přechodu mezi léčivy (switch) i cílené redukce podávané terapie (tzv. tapering).
Aktualizované doporučené postupy, které obsahují sedm zastřešujících principů a jedenáct doporučení, by měly poskytnout podklad pro léčebnou strategii. Tento update se věnuje PsA v celém spektru projevů; zahrnuty jsou lehké formy onemocnění, algoritmus farmakoterapie při převažující muskuloskeletální manifestaci, v případě psoriatického postižení i přítomnosti komorbidit. Výběr kokrétního léčiva pro pacienta by měl být založen na údajích o jeho účinnosti, klinickém fenotypu onemocnění, profilu nežádoucích účinků, snášenlivosti, se zohledněním nákladů na léčbu a dostupnosti. Řešena je otázka přechodu mezi léčivy (switch) i cílené redukce podávané terapie (tzv. tapering).
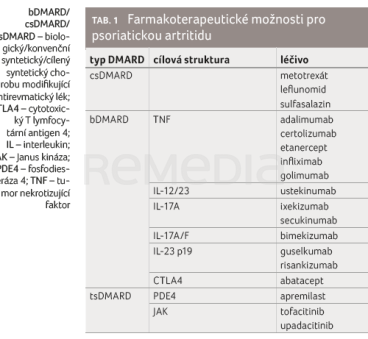
V terapii PsA jsou využívány konvenční syntetické chorobu modifikující antirevmatické léky (csDMARDs), jako je metotrexát (MTX), sulfasalazin a leflunomid; biologické přípravky (bDMARDs) cílící na tumor nekrotizující faktor (TNF), dráhu interleukinu (IL) 12/23 nebo IL‑23 a dráhu IL‑17A a IL‑17A/F; a cílené syntetické léky (tsDMARDs), které inhibují Janus kinázy (JAK) nebo fosfodiesterázu 4 (PDE4). Dostupné možnosti farmakoterapie schválené pro léčbu PsA k datu vydání doporučení (prosinec 2023) shrnuje tabulka 1.
Shrnutí doporučení
Psoariatická artritida je považována za heterogenní onemocnění, které může vyžadovat multidisciplinární přístup (muskuloskeletální projevy PsA jsou primárně v gesci revmatologa, ale například při postižení kůže by měl revmatolog spolupracovat s dermatologem).
Léčba by měla být založena na společném rozhodnutí pacienta a lékaře s ohledem na účinnost, bezpečnost léčby, pacientovy preference a v potaz by měly být brány i náklady na léčbu.
Primárním cílem léčby pacientů s PsA je maximalizace kvality života související se zdravím prostřednictvím kontroly symptomů, prevence strukturálního poškození, normalizace funkce a sociální participace.
Zásadní součástí opatření k dosažení těchto cílů je potlačení zánětu. Jednotlivé projevy onemocnění by měly být posuzovány samostatně, vedle muskuloskeletálních manifestací PsA je třeba vzít dále v úvahu projevy zejména v oblasti kůže, očí a gastrointestinálního traktu a zaměřit se také na komorbidity (obezita, metabolický syndrom, kardiovaskulární onemocnění nebo deprese).
Léčba by měla být zaměřena na dosažení remise, případně minimální/nízké aktivity onemocnění s pravidelným sledováním a vhodnou úpravou terapie v případě potřeby.
Nově je v doporučení zdůrazněn výběr terapie dle mechanismu účinku, který by měl zohlednit její bezpečnost s cílem optimálního profilu přínosu a rizika.
K úlevě od muskuloskeletálních projevů lze použít nesteroidní protizánětlivé léky (NSA), lokální injekce s glukokortikoidy lze zvážit jako doplňkovou léčbu.
U nemocných s polyartritidou nebo s monoartritidou/oligoartritidou a špatnými prognostickými faktory (např. strukturální poškození, zvýšené reaktanty akutní fáze, daktylitida nebo postižení nehtů) by měla být léčba csDMARD zahájena rychle, přičemž u pacientů s klinicky relevantním kožním postižením by měl být upřednostněn metotrexát.
U pacientů s periferní artritidou a nedostatečnou odpovědí na alespoň jeden csDMARD by měla být zahájena terapie bDMARD.
U pacientů s periferní artritidou a nedostatečnou odpovědí na alespoň jeden bDMARD nebo tam, kde léčba bDMARD není vhodná, může být (se zohledněním bezpečnostních rizik) zvážena terapie inhibitory JAK.
U pacientů s mírným onemocněním a neadekvátní odpovědí na alespoň jeden csDMARD a při nevhodnosti podání bDMARD i inhibitoru JAK lze zvážit použití inhibitoru PDE4.
U pacientů s jednoznačnou entezitidou a nedostatečnou odpovědí na NSA nebo lokální injekce glukokortikoidů je třeba zvážit léčbu bDMARD.
U pacientů s klinicky relevantním axiálním onemocněním s nedostatečnou odpovědí na NSA by měla být zvážena léčba inhibitory IL‑17A, TNF, IL‑17A/F nebo JAK.
Nově je v doporučeních deklarováno, že výběr mechanismu účinku indikované léčby by měl odrážet extramuskuloskeletální manifestace PsA; při postižení kůže by měl být upřednostněn inhibitor IL‑17A nebo IL‑17A/F nebo IL‑23 nebo IL‑12/23; v případě uveitidy anti‑TNF monoklonální protilátka; a u zánětlivého onemocnění střev (IBD) anti‑TNF monoklonální protilátka nebo inhibitor IL‑23 nebo inhibitor IL‑12/23 nebo inhibitor JAK.
U pacientů s nedostatečnou odpovědí nebo s intolerancí jednoho bDMARD nebo inhibitoru JAK by měl být zvážen přechod (switch) na jiný bDMARD nebo inhibitor JAK, včetně změny léčby v rámci lékové skupiny. V současné době nejsou dostupná silná data, na základě nichž by se měl upřednostnit switch na léčbu s jiným mechanismem účinku před léčivem se stejným mechanismem působení. Za pozornost také stojí, že guidelines neomezují celkový počet změn léčby pro daného pacienta.
U pacientů v setrvalé remisi může být zváženo snižování dávek (tapering) DMARD.
V aktualizaci doporučení jsou zahrnuta všechna dostupná léčiva schválená pro terapii PsA. Management léčby a výběr léčiva by měly zohledňovat muskuloskeletální a extramuskuloskeletální projevy onemocnění. Tyto pilíře léčby by měly být užitečné v léčbě jednotlivého pacienta, ale také v prosazování lepší dosažitelnosti péče a pro výzkum.
Postavení bimekizumabu v nových doporučeních
Humanizovaná monoklonální protilátka bimekizumab představuje léčivo s unikátním mechanismem účinku, které rozšířilo možnosti terapie PsA. Díky duální inhibici IL‑17A a IL‑17F (tedy inhibici homodimerů IL‑17A/IL‑17A, IL‑17F/IL‑17F i heterodimerů IL‑17A/IL‑17F) dosahuje výraznější efektivity v potlačení zánětlivého procesu než samotná inhibice IL‑17A [2]. Protilátky proti IL‑17 se již etablovaly v léčbě psoriázy, PsA a axiální spondyloartritidy. Bimekizumab prokázal výbornou účinnost u pacientů s psoriázou, kde jsou již dostupná data o jeho účinnosti v dlouhodobém časovém horizontu [3,4]. S výhodou ho proto můžeme využít zejména v léčbě PsA u pacientů s kožní manifestací onemocnění. Efekt léčby byl potvrzen u pacientů trpících PsA tzv. TNF‑naivních i již léčených anti‑TNF terapií [5,6]. Mezi nesporné výhody bimekizumabu patří rychlý nástup účinku a subkutánní forma podávání.
Závěr
Aktualizace doporučení EULAR pro farmakoterapii PsA 2023 vychází ze současného stavu poznání. Bere v potaz nově dostupná léčiva pro léčbu PsA a zohledňuje je v léčebném algoritmu. Rozšiřující se léčebné možnosti mohou být složitější pro lékaře při jejich rozhodování o léčbě, na druhou stranu povedou k individualizaci terapie dle fenotypu onemocnění i charakteristik pacientů a zcela jistě přispějí ke zlepšení kvality jejich života.
Literatura
[1] Gossec L, Kerschbaumer A, Ferreira RJO. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2023 update. Ann Rheum Dis 2024; 83: 706–719.
[2] Souhrn údajů o přípravku Bimzelx. Dostupné na: https://www.sukl.cz
[3] Thaçi D, Armstrong A, Gordon KB, et al. Bimekizumab 3‑year maintenance of response in Week 16 responders with moderate to severe plaque psoriasis: Results from five phase 3/3b trials. 32nd European Academy of Dermatology and Venerology Congress. Berlin, 11‑14 October 2023; Poster 2540.
[4] Merola JF, Conrad C, Hampton P, et al. Bimekizumab 3‑year in high‑impact areas in moderate to severe plaque psoriasis: Pooled results from five phase 3/3B trials. 32nd European Academy of Dermatology and Venerology Congress. Berlin, 11‑14 October 2023; Poster 2547.
[5] McInnes IB, Asahina A, Coates LC, et al. Bimekizumab in patients with psoriatic arthritis, naive to biologic treatment: a randomised, double‑blind, placebo‑controlled, phase 3 trial (BE OPTIMAL). Lancet 2023; 401: 25–37.
[6] Merola JF, Landewé R, McInnes IB, et al. Bimekizumab in patients with active psoriatic arthritis and previous inadequate response or intolerance to tumour necrosis factor‑Α inhibitors: a randomised. Lancet 2023; 401: 38–48.