Abemaciklib v terapii metastatického HR pozitivního/HER2 negativního karcinomu prsu – praktické zkušenosti
Souhrn:
Palácová M. Abemaciklib v terapii metastatického HR pozitivního/HER2 negativního karcinomu prsu − praktické zkušenosti. Remedia 2021; 31: 251–254.
Metastatický karcinom prsu je stále nevyléčitelným onemocněním. Doba přežití se liší u jednotlivých fenotypů nádoru, stejně tak i typ terapie a jednotlivé sekvence. V případě HR pozitivního/HER2 negativního metastatického karcinomu prsu lze využít v systémové terapii hormonální léčbu, cílenou léčbu a chemoterapii. V posledních letech dominuje úvodním liniím systémové léčby hormonoterapie, aktuálně v kombinaci s inhibitory CDK4/6 – palbociklibem, ribociklibem a abemaciklibem. Abemaciklib lze kombinovat s inhibitorem aromatáz nebo s fulvestrantem – to závisí na předchozím předléčení a okamžiku, kdy dojde k progresi nemoci. Kombinace abemaciklibu s hormonoterapií výrazně prodlužuje dobu do progrese onemocnění, v kombinaci s fulvestrantem již prokázala i prospěch v přežití. Tolerance terapie je dobrá, nejčastěji se vyskytující nežádoucí účinek, jímž je průjem, lze ovlivnit podáním loperamidu nebo redukcí dávky, která nesnižuje efektivitu léčebné kombinace.
Summary:
Palacova M. Abemaciclib in the therapy of metastatic HR‑positive/HER2‑negative breast cancer – practical experience. Remedia 2021; 31: 251–254.
Metastatic breast cancer is still an untreatable disease. Overall survival is different in the individual phenotypes of the carcinoma as well as with the type of therapy and individual sequence. In case of HR‑positive/HER2‑negative metastatic breast cancer, it is possible to use systemic therapy, hormonal treatment, targeted therapy and chemotherapy. In recent years, the initial lines of systemic therapy are dominated by hormonal treatment, at the moment combined with CDK4/6 inhibitors – palbociclib, ribociclib and abemaciclib. Abemaciclib can be combined with aromatase inhibitor or fulvestrant – that depends on the previous pre‑treatment and the time of disease progression. The combination of abemaciclib with hormonal therapy significantly prolongs time to disease progression, confirming benefit for survival in combination with fulvestrant. The therapy is well‑tolerated, the most common side effect is diarrhoea that can be managed by loperamid or dose reduction without lowering the efficacy of treatment combination.
Key words: metastatic breast cancer, HR‑positive/HER2‑negative, hormonal therapy, abemaciclib
Úvod
Karcinom prsu představuje nejčastější malignitu u ženské populace. Jedná se o karcinom, který je senzitivní na hormonální terapii i chemoterapii a cílenou léčbu. Intenzita a léčebná modalita jsou voleny na základě fenotypu nádoru a klinického stadia onemocnění. Fenotyp nádoru se stanovuje na základě exprese hormonálních receptorů (HR) – estrogenového a progesteronového - a HER2 (humánní epidermální receptor 2). Na základě těchto parametrů rozlišujeme nádory prsu triple negativní (negativní HR i HER2), HER2 pozitivní (HER2 pozitivní, HR negativní nebo pozitivní) a luminální A a B (HR pozitivní, HER2 negativní). Prognóza karcinomů prsu se liší nejen na základě fenotypu nádoru, ale i na základě klinického stadia. Adjuvantní hormonální léčba je vysoce efektivní pro většinu žen s nádorem hormonálně pozitivním a HER2 negativním (HR+/HER2-), nicméně u 25-30 % pacientek dojde k recidivě onemocnění, které zůstává i nadále nevyléčitelné. Příčinou progrese nemoci je často primární nebo sekundární hormonální rezistence. I v dnešní době je 6–10 % případů onemocnění diagnostikováno ve čtvrtém klinickém stadiu. Medián přežití pro všechny skupiny je kolem dvou let, 26 % pacientek přežívá pět let, 2–3 % žen přežívají dlouhodobě. V terapii metastatického HR+/HER2- karcinomu prsu využíváme z léčebných modalit hormonální terapii (HT), cílenou (biologickou) léčbu a chemoterapii (CHT). V posledních letech se upřednostňuje úvodní HT, popř. kombinace HT s terapií cílenou, a až při jejím selhání se doporučuje podávat CHT. Jednou z cest, jak překonat hormonální rezistenci, je kombinace HT s jiným přípravkem – buď s dalším hormonálním lékem, nebo kombinace s cílenou léčbou, která se vzhledem k výraznému efektu stala standardem úvodních linií terapie metastatického HR+/HER2– karcinomu prsu [1,2].
Kombinovaná léčba s abemaciklibem
Většina současných doporučení pro léčbu HR+/HER2– metastatického karcinomu prsu upřednostňuje kombinaci HT a inhibitoru cyklin dependentní kinázy 4/6 (CDK4/6) v první nebo ve druhé léčebné linii pro metastatické HR+/HER2– onemocnění. Inhibitory CDK4/6 - palbociklib, ribociklib nebo abemaciklib - lze kombinovat s inhibitorem aromatázy nebo s fulvestrantem. Kombinaci inhibitoru CDK4/6 s inhibitorem aromatázy je možné uplatnit tam, kde došlo k progresi onemocnění při adjuvantní HT s tamoxifenem, nebo při progresi za více než 12 měsíců po ukončení adjuvantní HT s inhibitorem aromatázy nebo u nově diagnostikovaného doposud neléčeného karcinomu prsu již ve čtvrtém klinickém stadiu. Kombinaci inhibitoru CDK4/6 s fulvestrantem lze využít u pacientek progredujících při první linii HT metastatického karcinomu prsu nebo u těch, u nichž došlo k progresi onemocnění do 12 měsíců od ukončení adjuvantní HT.
Abemaciklib je dalším z inhibitorů CDK4/6, který je součástí terapie karcinomu prsu. Indikován je na základě klinické studie MONARCH 3 v kombinaci s nesteroidním inhibitorem aromatázy (anastrozolem nebo letrozolem) v první léčebné linii lokálně pokročilého/inoperabilního a metastatického HR+/HER2– karcinomu prsu [3,4]. Dále je na základě výsledků klinické studie MONARCH 2 indikován v kombinaci s fulvestrantem u pacientek progredujících při první linii HT metastatického karcinomu prsu nebo u těch, u nichž došlo k progresi onemocnění do 12 měsíců od ukončení adjuvantní HT [5,6].
Použití inhibitorů CDK4/6 je spojeno i s výskytem nežádoucích účinků (NÚ). Bezpečnostní profil je u jednotlivých přípravků podobný. Nejčastěji se vyskytujícím NÚ je myelotoxicita – resp. neutropenie všech stupňů, která je u palbociklibu a ribociklibu popisována až v 80 %, u abemaciklibu se vyskytuje s frekvencí kolem 45 %. Anémie a trombocytopenie se vyskytují vzácně. K dalším nejčastěji se vyskytujícím NÚ patří průjem, který se naopak vyskytuje převážně při léčbě abemaciklibem (84,6 %), stupeň 3 je zaznamenán u 11,7-14,5 % pacientek. V žádné z klinických studií nebyl pozorován průjem stupně 4. Z dalších nehematologických NÚ jsou nejčastěji popisovány únava, nevolnost, abdominální bolesti, zvracení, nechutenství, alopecie, elevace aktivity aspartátaminotransferázy a alaninaminotransferázy, infekce. Většina těchto NÚ je pouze střední intenzity a terapii většinou neovlivní. Možný výskyt hepatotoxicity je doporučeno sledovat v průběhu terapie kontrolou jaterních testů u ribociklibu a abemaciklibu. V případě ribociklibu je potřebná v úvodu terapie kontrola EKG pro riziko vzniku prodloužení intervalu QTc. U abemaciklibu byl popisován výskyt trombózy kolem 5 % a elevace hodnot kreatininu, která vzniká v důsledku inhibice některých transportních míst ovlivňujících tubulární sekreci. Glomerulární filtrace ovlivněna není, a tudíž nedochází k poškození ledvin. Proto je také vhodné při terapii monitorovat renální parametry (kreatinin, urea) [3-6].
Kazuistika 1
U pacientky byl diagnostikován karcinom prsu ve třetím klinickém stadiu v lednu 2019 ve věku 72 let. V úvodu byla indikována operace v rozsahu parciální mastektomie s disekcí axily – s nálezem pT1c N3a (19 pozitivních uzlin z 21 vyšetřených). Vzhledem k vysokému riziku relapsu onemocnění byla indikována adjuvantní CHT založená na antracyklinech a taxanech, dále adjuvantní HT - inhibitor aromatázy s eventuální změnou na tamoxifen. Délka adjuvantní HT byla doporučena na dobu minimálně 10 let, ev. na dobu 15 let. Dále byla indikována adjuvantní radioterapie a podání kyseliny zoledronové s cílem další redukce rizika relapsu onemocnění. Nicméně podání adjuvantní CHT bylo limitováno závažnými komorbiditami – dlouhodobě trvající leukopenií a neutropenií a nutričním marasmem, jehož příčina nebyla objasněna. Pacientka měla při úvodní návštěvě onkologa body mass index (BMI) 17,6. Adjuvantní CHT jsme museli modifikovat – pacientka absolvovala monoterapii s antracyklinem v týdenních dávkách s opakovanou nutnou podporou filgrastimem. Následně rovněž paklitaxel byl podáván v týdenních dávkách s nutností podpory filgrastimem.
Po ukončení adjuvantní CHT v září 2019 absolvovala žena adjuvantní radioterapii a zahájena byla adjuvantní HT. Progrese onemocnění byla zjištěna při pravidelné ambulantní kontrole v květnu 2020, kdy jsme na základě elevace nádorových markerů doplňovali došetření. Byly odhaleny mnohočetné jaterní metastázy u klinicky asymptomatického nálezu včetně normálních hodnot jaterních testů. Z důvodu progrese při adjuvantní HT anastrozolem byla indikována systémová léčba první linie metastatického onemocnění kombinací fulvestrantu a inhibitoru CDK4/6.
Problematický byl výběr přípravku,
neboť dominujícím nežádoucím účinkem léčby palbociklibem
a ribociklibem je neutropenie, která byla u pacientky
trvale stupně 2 i bez léčby (hodnoty neutrofilů
1,0-1,5 109/l), a léčba
abemaciklibem znamenala riziko průjmu. Nakonec jsme zvolili
abemaciklib.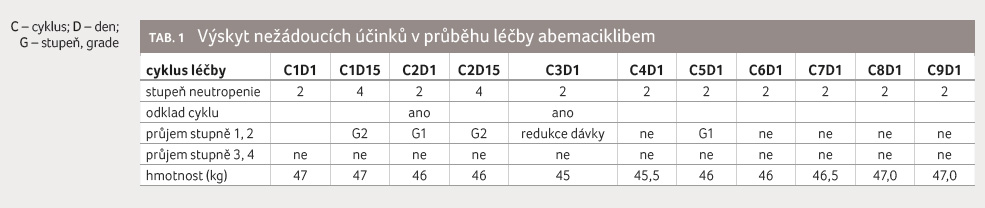
Žena byla uvedenou kombinací léčena
v období od června 2020 do února 2021, kdy došlo
po předchozí stabilizaci onemocnění k progresi. Terapie
byla provázena očekávanou toxicitou v podobě průjmu. Pro
zvládnutí postačovala pouze jedna redukce dávky abemaciklibu
a sporadické užití loperamidu (tab. 1). Dávku
jsme redukovali dle doporučení souhrnu údajů o přípravku
(SPC) [7]. Přes úvodní hmotnostní úbytek 1,5 kg se pacientka
dokázala během terapie při redukované dávce abemaciklibu 100 mg
2 denně dostat na původní
tělesnou hmotnost (tab. 2). Při léčbě standardní dávkou
byla zaznamenána také neutropenie stupně 4, avšak po redukci
dávky odpovídala hodnota neutrofilů neutropenii stupně 2, což
představuje u pacientky dlouhodobě setrvalý stav.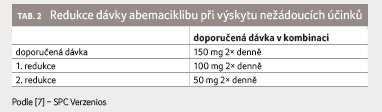
Kazuistika 2
Naše další pacientka je léčena od června 2018, kdy u ní byl diagnostikován bilaterální karcinom prsu již ve čtvrtém klinickém stadiu. Jednalo se o lobulární HR+/HER2- karcinom s hodnotu proliferace (Ki67) 30 %. Při vstupním došetření byly zjištěny vzdálené metastázy ve skeletu – v počtu tří ložisek v oblasti hrudní a bederní páteře, klinicky asymptomatické. Indikována byla pro první linii metastatického onemocnění u doposud neléčené pacientky HT – inhibitor aromatázy. Žena byla léčena od července 2018 do ledna 2020. Dlouhodobě bylo dosaženo stabilizace onemocnění, HT pacientka tolerovala dobře, s nevýraznými artralgiemi stupně 1. Při pravidelném přešetření v lednu 2020 došlo k progresi onemocnění – i nadále byla nemoc omezena pouze na skelet, kde přibyla ložiska aktivity v oblasti žeberních oblouků a v oblasti pánve. Stále se jednalo o klinicky asymptomatické onemocnění. U pacientky byla indikována ve druhé linii pro metastatický HR+/HER2– karcinom prsu kombinace fulvestrant a abemaciklib. Terapie byla zahájena v lednu 2020 a trvá doposud. Pravidelné kontroly proběhly v úvodu terapie první dva měsíce po 14 dnech, jak je doporučeno dle SPC [7]. Kontrola laboratorních hodnot je doporučena nejen vždy v den 1 nového cyklu, ale rovněž v prvních dvou cyklech i v den 15 – monitorují se hodnoty v krevním obrazu a jaterní testy. Jsou standardně sledovány také další možné NÚ, u abemaciklibu především možný výskyt průjmů. U pacientky po celou dobu léčby prakticky nebyla zaznamenána jakákoliv toxicita. Aktuálně je žena léčena již 16 měsíců s efektem parciální remise onemocnění, s výbornou tolerancí a nulovým výskytem NÚ.
Shrnutí
Efekt abemaciklibu v kombinaci s fulvestrantem byl prokázán ve studii MONARCH 2, kde byly pacientky randomizovány do ramene s fulvestrantem nebo do ramene s fulvestrantem a abemaciklibem [5,6]. V parametru doby do progrese onemocnění byl prokázán statisticky signifikantní prospěch u kombinace fulvestrant s abemaciklibem oproti fulvestrantu a placebu – 16,9 měsíce vs. 9,3 měsíce (poměr rizik [HR] 0,53; 95% interval spolehlivosti [CI] 0,049-0,681; p < 0,001). Přidáním abemaciklibu k fulvestrantu došlo ke statisticky signifikantnímu zlepšení celkového přežití (OS) o 9,4 měsíce – s mediánem OS 46,7 měsíce v rameni s abemaciklibem oproti 37,3 měsíce v rameni s placebem. Zlepšení OS bylo konzistentní napříč všemi sledovanými podskupinami pacientek. V poslední době se u efektu HT posuzuje v souvislosti s kvalitou života doba do zahájení CHT, která zde činila 25,5 měsíce v rameni s abemaciklibem a 18,2 měsíce v rameni s placebem. Výskyt toxicity zůstal konzistentní s předchozími publikovanými daty. Nejčastěji se vyskytujícím NÚ léčby abemaciklibem je průjem. Z tohoto důvodu muselo ve studii terapii ukončit pouze 1,4 % pacientek. Z hematologické toxicity se nejčastěji vyskytovala neutropenie, nebyl pozorován výskyt febrilní neutropenie.
Jak již bylo zmíněno, profil NÚ léčby abemaciklibem se mírně liší od ostatních inhibitorů CDK4/6. Nejčastější NÚ - průjem - se vyskytuje až v 84,6 % případů, průjem stupně 3 pak u 14,5 % pacientek. V žádné z klinických studií však nebyl pozorován průjem stupně 4. Terapie je symptomatická. Nejčastěji se průjem objevuje v prvních čtyřech týdnech terapie a je dobře ovlivnitelný podáním loperamidu nebo redukcí dávky. Medián doby do výskytu průjmu představoval ve studiích MONARCH 2 a 3 přibližně sedm dní a medián trvání průjmu stupně 2 zhruba 9-12 dní, stupně 3 pak 6-8 dní [3-6].
Závěr
Inhibitory CDK4/6 přinesly výrazné zlepšení efektivity paliativní terapie u metastatického HR+/HER2- karcinomu prsu. V kombinaci s HR (inhibitory aromatázy, popř. fulvestrantem) se staly novým standardem v terapii HR+/HER2- karcinomu prsu. Abemaciklib je indikován na základě klinické studie MONARCH 3 v kombinaci s nesteroidním inhibitorem aromatázy (anastrozolem nebo letrozolem) v první linii lokálně pokročilého/inoperabilního a metastatického HR+/HER2– karcinomu prsu. Dále je na základě výsledků klinické studie MONARCH 2 indikován v kombinaci s fulvestrantem u pacientek progredujících při první linii HT metastatického karcinomu prsu nebo u těch, u nichž došlo k progresi onemocnění do 12 měsíců od ukončení adjuvantní HT. Kombinace abemaciklibu s fulvestrantem rovněž prodlužuje přežití pacientek. V současné době i přes řadu stále nezodpovězených otázek jsou inhibitory CDK4/6 v kombinaci s HT průlomem v terapii luminálního metastatického karcinomu prsu.
Seznam použité literatury
- [1] Kennecke H, Yerushalmi R, Woods R, et al. Metastatic behaviour of breast cancer subtypes. J Clin Oncol 2010; 28: 3271−3277.
- [2] Cardoso F, Senkus E, Costa A, et al. 4rd ESO‑ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC4). Ann Oncol 2018; 29: 1634−1657.
- [3] Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer 2019; 5: 1−8.
- [4] Goetz MP, Toi M, Campone M, et al. MONARCH 3: Abemaciclib As Initial Therapy for Advanced Breast Cancer. J Clin Oncol 2017; 17: 3638−3646.
- [5] Sledge GW, Toi M, Neven P, et al. MONARCH 2: Abemaciclib in Combination With Fulvestrant in Women With HR+/HER2– Advanced Breast Cancer Who Had Progressed While Receiving Endocrine Therapy. J Clin Oncol 2017; 25: 2875−2886.
- [6] Sledge GW, Toi M, Neven P, et al. The Effect of Abemaciclib Plus Fulvestrant on Overall Survival in Hormone Receptor‑Positive, HER2‑Negative Breast Cancer That Progressed on Endocrine Therapy − MONARCH 2: A Randomized Clinical Trial. JAMA Oncol 2019; 6: 116−124.
- [7] SPC Verzenios. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/verzenios‑epar‑product‑information_cs.pdf