Afatinib – zkušenosti z klinické praxe
Souhrn:
Koubková L. Afatinib – zkušenosti z klinické praxe. Remedia 2018; 28: 346–349.
Receptor pro epidermální růstový faktor (EGFR) hraje důležitou roli ve vývoji a progresi lidských epiteliálních karcinomů, včetně nemalobuněčného karcinomu plic (NSCLC). Aktivace dráhy EGFR podporuje růst a progresi nádoru, stimuluje proliferaci nádorových buněk, produkci angiogenních faktorů, invazi a metastazování a tlumí apoptózu. Cílenou léčbou se snažíme tyto změněné signální dráhy narušit. Inhibitory tyrozinkinázy EGFR prokázaly svoji účinnost při přítomnosti aktivačních mutací především v exonu 19 a 21 genu EGFR u NSCLC. Afatinib je inhibitor tyrozinkinázy druhé generace, který ireverzibilně blokuje celou rodinu ErbB.
Summary:
Koubkova L. Afatinib – clinical practice experience. Remedia 2018; 28: 346–349.
The epidermal growth factor receptor (EGFR) plays an important role in the development and progression of human epithelial carcinomas, including NSCLC (non‑small cell lung carcinoma). EGFR pathway activation supports tumor growth and progression, stimulates tumor cell proliferation, angiogenic factors, invasion and metastasis, and suppresses apoptosis. With targeted therapy, we try to disrupt these altered signaling pathways. EGFR tyrosine kinase inhibitors have shown their efficacy in the presence of activation mutations, particularly in EGFR gene exons 19 and 21 of the NSCLC. Afatinib is a second generation tyrosine kinase inhibitor that irreversibly blocks the entire ErbB family.
Key words: non‑small cell lung carcinoma, epidermal growth factor receptor mutation, afatinib
Úvod
Bronchogenní karcinom je onemocněním s vysokou incidencí a je nejčastější příčinou úmrtí způsobeného zhoubnými nádory. V době stanovení diagnózy se v 75−80 % případů jedná o onemocnění lokálně pokročilé či generalizované. Na základě lepšího porozumění molekulární biologii nádorů došlo v posledních letech k rozšíření léčebných možností pokročilého nemalobuněčného karcinomu plic (non small cell lung carcinoma, NSCLC). Identifikace genetických změn vedla k vývoji řady malých molekul tyrozinkinázových inhibitorů (TKI), jejichž cílem je narušit změněné signální dráhy u nádorů s těmito genetickými změnami. Nejlepším příkladem tohoto léčebného přístupu jsou nádory plic nesoucí genetické alterace v genech receptoru pro epidermální růstový faktor (epidermal growth factor receptor, EGFR) a pro anaplastickou lymfomovou kinázu (ALK). Tyto nádory se vyznačují citlivostí na léčbu genotypově specifickými TKI.
Již v roce 2004 byly publikovány informace o NSCLC s aktivačními somatickými mutacemi genu EGFR, kde bylo dosaženo objektivní odpovědi, když byly léčeny EGFR TKI. Od té doby proběhla řada studií, které potvrdily prediktivní úlohu mutací především v exonu 19 a 21 genu EGFR. Testování mutačního stavu genu EGFR je dnes již běžnou klinickou praxí u NSCLC a dle konsenzu Mutation Day 2016 je v České republice prováděno rutinně u všech nemocných s diagnózou adenokarcinomu, NSCLC spíše adenokarcinomu, adenoskvamózního karcinomu a NSCLC NOS (blíže nespecifikovaného). Testování EGFR u skvamózního karcinomu je prováděno na vyžádání klinika. I u této léčby však musíme počítat se vznikem rezistence v průměru během 12 měsíců. Nejčastější příčinou této rezistence je vznik sekundární mutace T790M, a to asi v 60 %. Proto použitá metoda musí detekovat jak aktivační, tak i rezistentní mutace.
Afatinib
Afatinib je selektivní ireverzibilní blokátor receptorové rodiny ErbB, který se na tyto receptory kovalentně váže a tím ireverzibilně blokuje signalizaci zprostředkovanou všemi homo a heterodimery, které vytvářejí jednotliví členové rodiny receptorů ErbB – EGFR (ErbB1), HER2 (ErbB2), ErbB3 a ErbB4.
S afatinibem proběhla řada
klinických studií u pacientů s NSCLC − LUX Lung
1−8. Základní studií hodnotící účinnost a bezpečnost
afatinibu je LUX Lung 3 [1]. V tomto klinickém hodnocení
byl afatinib podáván v první linii léčby NSCLC (stadium
IIIb/IV) v dávce 40 mg denně pacientům s EGFR
pozitivními mutacemi. Byla porovnávána jeho účinnost
s chemoterapií cisplatina/pemetrexed, která byla podávána
jednou za tři týdny do progrese onemocnění, maximálně
však po dobu šesti cyklů. Z celkového počtu
1 269 hodnocených byla přítomnost EGFR mutací potvrzena
u 452 pacientů, z nich bylo 345 následně
randomizováno v poměru 2 : 1. Studie byla nezaslepená.
V rámci randomizace byli pacienti stratifikováni podle typu
mutací (delece exonu 19, L858R a další). Studie
prokázala v hodnocení nezávislou komisí signifikantní
prodl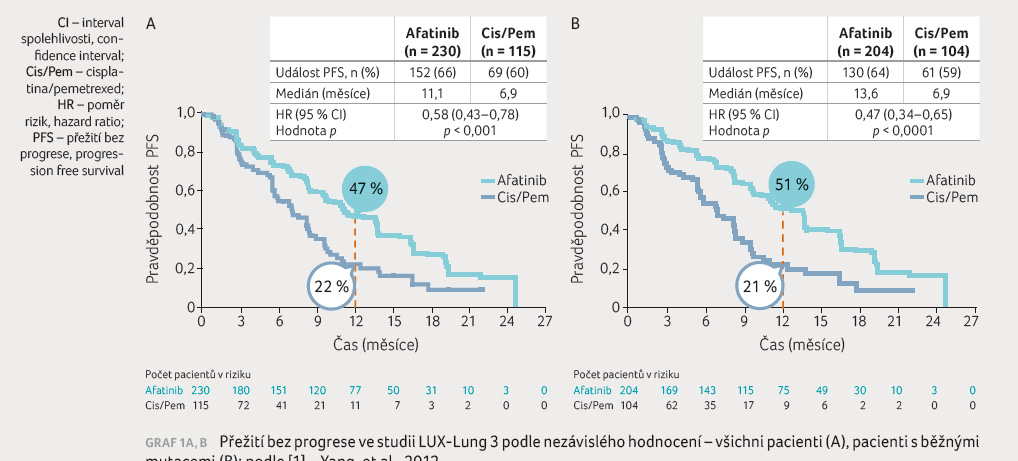 oužení doby do progrese onemocnění (progression free
survival, PFS) ve skupině léčené afatinibem oproti kontrolní
skupině cisplatina/pemetrexed 11,1 měsíce vs. 6,9 měsíce
(poměr rizik [HR] 0,58; 95% interval spolehlivosti [CI] 0,43–0,78;
p = 0,0004),
u pacientů s obvyklými mutacemi EGFR (delece exonu 19,
L858R) byl výsledek ještě příznivější, a to 13,6 měsíce
vs. 6,9 měsíce (HR = 0,47; 95% CI, 0,34−0,65;
p < 0,0001),
viz graf 1A, B.
oužení doby do progrese onemocnění (progression free
survival, PFS) ve skupině léčené afatinibem oproti kontrolní
skupině cisplatina/pemetrexed 11,1 měsíce vs. 6,9 měsíce
(poměr rizik [HR] 0,58; 95% interval spolehlivosti [CI] 0,43–0,78;
p = 0,0004),
u pacientů s obvyklými mutacemi EGFR (delece exonu 19,
L858R) byl výsledek ještě příznivější, a to 13,6 měsíce
vs. 6,9 měsíce (HR = 0,47; 95% CI, 0,34−0,65;
p < 0,0001),
viz graf 1A, B.
Pravděpodobnost ročního přežití bez progrese byla 47 % vs. 22 %. Ve skupinách pacientů s obvyklými mutacemi EGFR (delece exonu 19, L858R) byla pravděpodobnost ročního přežití bez progrese 51 % vs. 21 %. V době hodnocení a publikace výsledků nebyly pozorovány rozdíly v sekundárním parametru – celkovém přežití (overall survival, OS). Tato skutečnost je však dána nezralostí dat v době hodnocení a publikace.
Studie fáze IIb LUX Lung 7 [2] jako první porovnávala účinnost a bezpečnost dvou EGFR TKI − afatinibu a gefitinibu (EGFR TKI 1. generace) v první linii léčby u pacientů s NSCLC s nejčastějšími mutacemi EGFR (delece exonu 19 a L858R exonu 21). Při randomizaci byli pacienti stratifikováni podle typu mutace a přítomnosti mozkových metastáz. Primárními cílovými ukazateli studie byly PFS, čas do selhání léčby (time to treatment failure, TTF) a OS. K léčbě afatinibem v dávce 40 mg podávané 1× denně bylo randomizováno 160 pacientů, do ramene s gefitinibem v dávce 250 mg 1× denně 159 pacientů. Výsledky primární analýzy publikované v roce 2015 ukázaly statisticky významné snížení rizika progrese o 27 % v rameni s afatinibem (HR = 0,73; 95% Cl 0,57−0,95; p = 0,0165, medián PFS 11,0 měsíce vs. 10,9 měsíce) a snížení rizika selhání léčby rovněž o 27 % (HR = 0,73; 95% Cl 0,58–0,92; p = 0,0073, medián 13,7 měsíce oproti 11,5 měsíce). Po dvou letech léčby žilo v rameni s léčbou afatinibem a zůstávalo bez progrese onemocnění dvakrát více pacientů než v rameni s gefitinibem (po 18 měsících 27 % vs. 15 %, po 24 měsících 18 % vs. 8 %). Na kongresu European Society of Medical Oncology (ESMO) 2016 byly prezentovány aktualizované výsledky sledování OS, které ukázaly jeho prodloužení o 3,4 měsíce v rameni s afatinibem (27,9 měsíce vs. 24,5 měsíce, HR = 0,86; 95% Cl 0,66−1,12; p = 0,258), které však nebylo statisticky významné. Trend k prodloužení OS vykázal afatinib u obou běžných mutací. Nebyl zaznamenán signifikantní rozdíl v kvalitě života pacientů při léčbě. Léčba afatinibem i gefitinibem byla obecně dobře tolerovaná. Nejčastějšími nežádoucími účinky stupně 3 a 4 byly průjem (13 % v rameni s afatinibem vs. 1 % v rameni s gefitinibem), rash (9 % vs. 3 %), elevace hodnot jaterních enzymů (0 % vs. 9 %). Závažný nežádoucí účinek byl zaznamenán u 11 % vs. 4 % pacientů. V obou ramenech ukončilo léčbu 6 % pacientů z důvodů nežádoucích účinků spojených s léčbou.
Na základě výsledků studie LUX Lung 2 [3] a LUX Lung 3 byl afatinib registrován Evropskou lékovou agenturou (EMA) v roce 2013. Afatinib (Giotrif) je indikován jako monoterapie k léčbě pacientů s lokálně pokročilým nebo metastatickým NSCLC s aktivačními mutacemi EGFR, kteří dosud nebyli léčeni EGFR TKI. Doporučená dávka je 40 mg 1× denně. Nejčastějšími nežádoucími účinky při léčbě afatinibem jsou kožní rush, průjem, stomatitida a paronychie. Tyto lze však poměrně dobře zvládnout snížením dávky obvykle na 30 mg a lokální léčbou, ev. podáváním loperamidu [4].
Zkušenosti z klinické praxe
Od roku 2015 bylo na Pneumologické klinice FN Motol afatinibem léčeno 12 pacientů, u šesti z nich bylo dosaženo alespoň na přechodnou dobu kompletní regrese nálezu, kdy na zobrazení pozitronovou emisní a výpočetní tomografií (PET/CT) nebyla popsána žádná viabilní léze. Jedním z prvních pacientů léčených afatinibem byl v době diagnózy 67letý nemocný, u kterého byl v červnu 2015 diagnostikován z hrudního výpotku adenokarcinom pravé plíce s delecí v exonu 19 genu EGFR. U pacienta bylo nutno provést hrudní drenáž s talkopleurodézou, po níž byla zahájena léčba afatinibem. Vyšetření pomocí PET/CT od října 2016 opakovaně prokazovalo nález bez viabilní neoplazie. Léčba byla ukončena pro progresi v játrech a ve skeletu po 33 měsících v březnu 2018. Při progresi byla z tekuté biopsie detekována přítomnost původní aktivační mutace a nově rezistentní mutace T790M a zahájena léčba osimertinibem. Mutace T790M byla detekována při progresi i u dalších tří pacientů.
Je důležité si uvědomit, že i když
tato rezistentní mutace není potvrzena z plazmy při vyšetření
ctDNA (cirkulující nádorové DNA), je nutné, pokud je to možné,
zvážit rebiopsii nádoru, která je pro vyšší senzitivitu
preferována. Z výsledku bronchoskopického vyšetření
a transtorakální biopsie jsme sekundární mutaci T790M
detekovali u dvou pacientů, z hrudního výpotku u jednoho
pacienta. U nejmladšího pacienta léčeného afatinibem,
kterému v době diagnózy bylo 23 let, jsme pomocí
transtorakální biopsie při progresi detekovali vzácnou
malobuněčnou transformaci, která vedla k následnému podání
chemoterapie.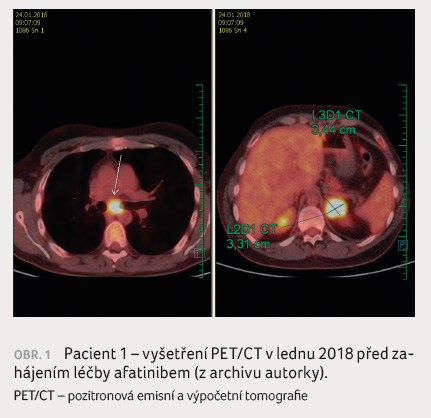
Rovněž anamnestické údaje včetně kouření jsou důležité. O tom svědčí kazuistika 33letého pacienta, který byl odeslán na naše pracoviště po horní pravostranné lobektomii v prosinci 2017 pro histologicky středně diferencovaný dlaždicobuněčný karcinom. V resekátu byla zastižena angioinvaze a v uzlině skupiny 7 metastáza karcinomu šířící se do adventicie jícnu. V lednu 2018 jsme doplnili vyšetření PET/CT (obr. 1), kde byla popsána viabilní neoplazie nejen v lymfatické uzlině pod karinou trachey, ale také v levé nadledvině. Následně byla na magnetické rezonanci mozku, která byla indikována pro náhle vzniklé závratě, detekována čtyři ložiska, která byla v únoru 2018 ošetřena Leksellovým gama nožem. Vzhledem k tomu, že pacient je nekuřák, žádali jsme vyšetření EGFR mutace z resekátu a byla zjištěna delece v exonu 19 genu EGFR. V únoru 2018 byla zahájena léčba afatinibem, na PET/CT provedeném v květnu 2018 nebyla viabilní neoplazie popsána (obr. 2).
Další z pacientů, v době
stanovení diagnózy 59letý, je v současné době léčen bez
známek viabilní neoplazie. V lednu 2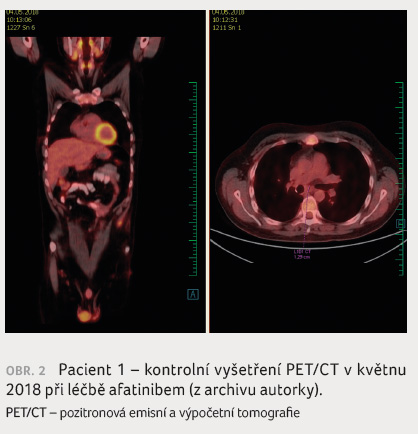 012 byla u nemocného
provedena dolní pravostranná lobektomie pro adenokarcinom pT1pN2,
pacient ale odmítl adjuvantní onkologickou léčbu. Do naší
ambulance byl poprvé odeslán pro CT progresi v srpnu 2016
(tumor nasedající na pravý hilus, mnohočetné metastázy
v obou plicních křídlech). Bylo provedeno bronchoskopické
vyšetření včetně endobronchiální ultrasonografie, kdy byla
potvrzena recidiva adenokarcinomu v pravém horním laloku
s metastázou do mediastinálních uzlin a současně
prokázána delece v exonu 19 genu EGFR. V září 2016
byla zahájena léčba afatinibem, od dubna 2017 je výsledek
vyšetření PET/CT bez viabilní neoplazie (obr. 3). Pacient léčbu až na nevelký rush v obličeji
a mírný intermitentní průjem toleruje velmi dobře, zvládá
všechny aktivity.
012 byla u nemocného
provedena dolní pravostranná lobektomie pro adenokarcinom pT1pN2,
pacient ale odmítl adjuvantní onkologickou léčbu. Do naší
ambulance byl poprvé odeslán pro CT progresi v srpnu 2016
(tumor nasedající na pravý hilus, mnohočetné metastázy
v obou plicních křídlech). Bylo provedeno bronchoskopické
vyšetření včetně endobronchiální ultrasonografie, kdy byla
potvrzena recidiva adenokarcinomu v pravém horním laloku
s metastázou do mediastinálních uzlin a současně
prokázána delece v exonu 19 genu EGFR. V září 2016
byla zahájena léčba afatinibem, od dubna 2017 je výsledek
vyšetření PET/CT bez viabilní neoplazie (obr. 3). Pacient léčbu až na nevelký rush v obličeji
a mírný intermitentní průjem toleruje velmi dobře, zvládá
všechny aktivity.
Na naší klinice jsme z důvodu
nežádoucích účinků snížili s efektem dávku afatinibu
na 30 mg u čtyř z celkového počtu léčených
pacientů.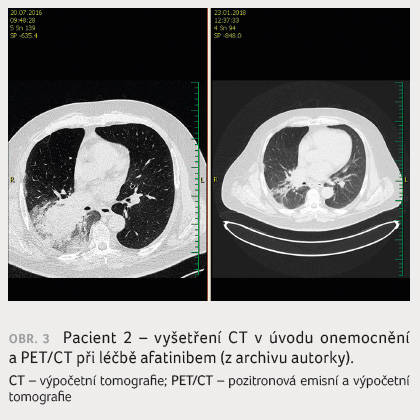
Závěr
Afatinib je účinný EGFR TKI druhé generace a při jeho zařazení do palety léčiv u pacientů s aktivačními mutacemi genu EGFR může být dosaženo dlouhodobé léčebné odpovědi při velmi dobré kvalitě života pacientů. Nežádoucí účinky lze dobře zvládnout snížením dávky. Při progresi onemocnění je nutno myslet na detekci rezistentní mutace T790M, aby pacienti mohli být léčeni TKI třetí generace, který je u této mutace účinný.
Seznam použité literatury
- [1] Yang JChH, Schuler MH, Yamamoto N, et al. 89504e470d0a1a0a0000000d494844520000000100000001010300000025db56ca00000003734249540101017c2e778200000006504c5445ffffffffffff557cf56c0000000274524e53ff00e5b7304a00000001624b47440088051d480000000467494667010000143eeab7550000000c636d50504a436d7030373132000000074f6db7a50000000a4944415418d36368000000820081a701ba100000000049454e44ae426082LUX‑Lung 3: A randomized, open‑label, phase III study of afatinib versus pemetrexed and cisplatin as first‑line treatment for patients with advanced adenocarcinoma of the lung harboring EGFR‑activating mutations. J Clin Oncol 2012; 30(Suppl): abstrakt LBA7500.
- [2] Park K, Tan EH, MD, O’Byrne K, et al. Afatinib versus gefitinib as first‑line treatment of patients with EGFR mutation‑positive non‑small‑cell lung cancer (LUX‑Lung 7): a phase 2B, open‑label, randomised controlled trial. Lancet 2016; 17: 599−589.
- [3] Yang JC, Shih JY, Su WC, et al. Afatinib for patiens with lung adenocarcinoma and epidermal growth factor receptor mutations (LUX‑Lung 2): a phase 2 trial. Lancet Oncol 2012; 13: 539–548.
- [4] Souhrn údajů o přípravku Giotrif. Revize textu 7/2017. Dostupné na http://www.sukl.cz