Biologická léčba obézního pacienta s psoriázou
Souhrn
Horažďovský J. Biologická léčba obézního pacienta s psoriázou. Remedia 2023; 33: 286–291.
Obezita je hlavním rizikovým faktorem pro rozvoj psoriázy a kardiovaskulárních komorbidit. Secukinumab v dávce 300 mg podávané jednou za dva týdny představuje optimální možnost v léčbě obézních pacientů s psoriázou, jak dokládají prezentované příklady z praxe.
Klíčová slova: obezita – psoriáza – secukinumab.
Summary
Horazdovsky J. Biological treatment of an obese patient with psoriasis. Remedia 2023; 33: 286–291.
Obesity is the most important risk factor for the development of psoriasis and cardiovascular comorbidities. As shown by relevant and herewith presented case studies, 300mg of secukinumab administered once every two weeks represent the optimal therapy of obese patients suffering from psoriasis.
Key words: obesity – psoriasis – secukinumab.
Úvod
Obezita ovlivňuje psoriázu i kardiovaskulární (KV) komorbidity a je považována za hlavní rizikový faktor jejich rozvoje. Obézní pacient s indexem tělesné hmotnosti (body mass index, BMI) > 30 kg/m2 vykazuje dvakrát vyšší riziko vzniku psoriázy. Tuková tkáň (zejména viscerální tuk) představuje aktivní imunitní a endokrinní orgán. Obezita je uváděna do souvislosti s chronickým zánětem, neboť u ní byly prokázány zvýšené hodnoty prozánětlivých cytokinů (tumor nekrotizující faktor alfa, TNFα; interleukin 6, IL‑6) a také prozánětlivých adipokinů (leptin, resistin, visfatin), zatímco koncentrace protizánětlivých adipokinů (adiponektin) byly snížené. Obezitou spouštěný zánět je tak odpovědný za vznik nebo zhoršení psoriázy a rozvoj KV onemocnění [1–3].
Existuje vzájemné ovlivnění provokačních faktorů a psoriázy s 1,66× vyšším rizikem vzniku obezity u pacientů s psoriázou oproti pacientům bez psoriázy. Míra rizika rozvoje obezity se zvyšuje s tíží psoriázy. Riziko obezity je u lehké psoriázy 1,46 (95% interval spolehlivosti [Cl] 1,47–1,82), u těžké psoriázy potom vzrůstá na 2,23 (95% Cl 1,63–3,05) [4].
Sledovaným parametrem v případě obezity je epikardiální tuková tkáň (epicardial adipose tissue, EAT). Psoriáza je spojována s vyšším objemem EAT v závislosti na viscerálním abdominálním tuku. EAT se potom jeví jako další důležitý faktor vyššího KV rizika u psoriázy. Urychluje se proces rozvoje koronární aterosklerózy a klinickými projevy jsou fibrilace síní či srdeční selhání se sníženou ejekční frakcí. Etiopatogeneze onemocnění je pravděpodobně multifaktoriální: podílejí se na ní faktory genetické, imunitní a vlivy zevního prostředí [5].
Psoriáza a ateroskleróza mají společné imunologické mechanismy. Aktivují se imunitní procesy jako zvýšená T lymfocytární aktivace, zvýšená adheze a migrace T lymfocytů, vytváří se lokální prozánětlivé prostředí a aktivuje se angiogeneze. Cílovými buňkami jsou keratinocyty, buňky hladké svaloviny a endoteliální buňky za účasti buněk zánětu. V cílových tkáních byly prokázány zvýšené koncentrace těchto buněk: lymfocytů Th1/17, neutrofilů, dendritických buněk, makrofágů, mastocytů. Na aktivaci zánětu se podílejí četné prozánětlivé cytokiny jako IL‑2, IL‑8, IL‑17, IL‑22, IL‑23, TNFα, interferon alfa (IFNα), vaskulární endoteliální růstový faktor (vascular endothelial growth factor, VEGF) [6].
Secukinumab
Secukinumab je plně humánní monoklonální protilátka IgG1/κ, která se selektivně váže na IL‑17A a inhibuje jeho interakci s receptorem pro IL‑17.
Úhradová vyhláška Státního ústavu pro kontrolu léčiv (SÚKL) uvádí podmínky úhrady pro léčbu secukinumabem. Lék je určen pro léčbu středně těžké až těžké psoriázy s hodnotou skóre rozsahu a závažnosti onemocnění (Psoriasis Area and Severity Index, PASI) více než 10 u dospělých pacientů, u nichž nelze použít dva z následujících způsobů konvenční systémové léčby: acitretin, metotrexát, cyklosporin, apremilast nebo fototerapii (PUVA či NB-UVB) z důvodů nedostatečné účinnosti, intolerance či kontraindikace, nebo u pacientů, kteří mají současně aktivní psoriatickou artropatii, kde nelze použít metotrexát z důvodů nedostatečné účinnosti, intolerance či kontraindikace. Dále je secukinumab indikován pro léčbu středně těžké až těžké psoriázy s PASI více než 10 u dospělých pacientů, u kterých je zároveň splněno alespoň jedno z následujících kritérií: a) nedošlo k dosažení odpovědi PASI 50 (50% zlepšení dle PASI) po třech, resp. čtyřech měsících (podle druhu přípravku) předchozí biologické léčby; b) došlo k poklesu účinnosti zavedené biologické léčby pod PASI 50 nebo při účinnosti v intervalu PASI 50–75, je‑li současně hodnota dermatologického indexu kvality života (Dermatology Life Quality Index, DLQI) ≥ 5; c) je kontraindikována jiná biologická léčba nebo je předchozí biologická léčba ukončena z důvodu nežádoucích účinků [7].
Podle Souhrnu údajů o přípravku (SPC) může na základě klinické odpovědi udržovací dávka secukinumabu 300 mg každé dva týdny (Q2W) přinést další prospěch pacientům s tělesnou hmotností 90 kg nebo vyšší. U pacientů, kteří nereagovali odpovědí PASI 90 v 16. týdnu a u nichž byla dávka titrována na 300 mg Q2W, se míra odpovědi PASI 90 zlepšila v porovnání s těmi, kteří setrvali na dávkovacím režimu 300 mg každé čtyři týdny (Q4W) [8].
V podkladech pro tato doporučení nacházíme dvě klíčové klinické studie. Do studie OPTIMISE bylo zařazeno 1 647 obézních pacientů s hmotností více než 100 kg a s těžkou psoriázou. Léčba secukinumabem probíhala od počátku sledování do 24. týdne v dávkování Q4W, následovala randomizace, kdy rameno pacientů „non‑respondérů“ s odpovědí v rozmezí PASI 75–90 bylo rozděleno na dávkování secukinumab 300 mg Q2W a Q4W do 52. týdne léčby. V tomto týdnu dosáhlo PASI 90 celkem 57 % pacientů v intenzifikované dávce Q2W oproti 46,5 % pacientů v dávkování Q4W, což bylo statisticky významné (p = 0,10) [9].
Další randomizovaná studie prokázala superioritu dávkování secukinumabu 300 mg Q2W v porovnání s Q4W u obézních pacientů s psoriázou s hmotností vyšší než 90 kg. Pacienti byli opět randomizováni do několika ramen: s intenzifikovanou dávkou Q2W od počátku sledování do 52. týdne, s dávkou Q4W od počátku sledování do 16. týdne léčby, kdy došlo k rozdělení na dvě skupiny dle dosažení nebo nedosažení PASI 90 a bylo pokračováno v klasickém dávkování Q4W. Klinické ukazatele byly hodnoceny v 52. týdnu ve všech ramenech.
![GRAF 1A–D Účinnost secukinumabu v dávce 300 mg Q2W oproti Q4W u pacientů s psoriázou s hmotností ≥ 90 kg; podle [10] – Augustin, et al., 2022. IGA – globální hodnocení lékařem, Investigator Global Assessment; n – počet pacientů; PASI 75/90/100 – 75%/90%/100% zlepšení dle skóre Psoriasis Area and Severity Index; Q2W/Q4W – jednou za dva/čtyři týdny GRAF 1A–D Účinnost secukinumabu v dávce 300 mg Q2W oproti Q4W u pacientů s psoriázou s hmotností ≥ 90 kg; podle [10] – Augustin, et al., 2022. IGA – globální hodnocení lékařem, Investigator Global Assessment; n – počet pacientů; PASI 75/90/100 – 75%/90%/100% zlepšení dle skóre Psoriasis Area and Severity Index; Q2W/Q4W – jednou za dva/čtyři týdny](https://www.remedia.cz/photo-pg-1123---.jpg) Superiorita dávkování secukinumabu 300 mg Q2W v 52. týdnu byla prokázána jak v parametru PASI 75/90/100, globálním hodnocením lékařem (Investigator Global Assessment, IGA), tak i v parametru DLQI (graf 1A–D, graf 2) [10].
Superiorita dávkování secukinumabu 300 mg Q2W v 52. týdnu byla prokázána jak v parametru PASI 75/90/100, globálním hodnocením lékařem (Investigator Global Assessment, IGA), tak i v parametru DLQI (graf 1A–D, graf 2) [10].
![GRAF 2 Parametr kvality života při léčbě secukinumabem v dávce 300 mg Q2W oproti Q4W u pacientů s psoriázou s hmotností ≥ 90 kg; podle [10] – Augustin, et al., 2022. DLQI – dermatologický index kvality života, Dermatology Life Quality Index; n – počet pacientů; Q2W/Q4W – jednou za dva/čtyři týdny GRAF 2 Parametr kvality života při léčbě secukinumabem v dávce 300 mg Q2W oproti Q4W u pacientů s psoriázou s hmotností ≥ 90 kg; podle [10] – Augustin, et al., 2022. DLQI – dermatologický index kvality života, Dermatology Life Quality Index; n – počet pacientů; Q2W/Q4W – jednou za dva/čtyři týdny](https://www.remedia.cz/photo-pg-1124---.jpg) V této studii byly kromě ukazatelů klinických hodnoceny také sérové koncentrace secukinumabu, které v týdnech 4, 16, 24, 52 vykazovaly pokles, avšak ve skupině pacientů s dávkováním Q2W byly signifikantně vyšší než ve skupině Q4W. Výsledek lze tedy hodnotit jako přímou úměru mezi výsledky laboratorními a klinickými. Pokud jde o bezpečnost podávání intenzifikované dávky, ve všech ramenech byl výskyt nežádoucích účinků nízký (hodnoceno na 100 pacientoroků), tento trend se týkal rovněž střevních zánětů a kandidových infekcí. Zásadní je zjištění, že nedocházelo ke statisticky významnému nárůstu výskytu nežádoucích příhod u intenzifikovaného podávání secukinumabu [10].
V této studii byly kromě ukazatelů klinických hodnoceny také sérové koncentrace secukinumabu, které v týdnech 4, 16, 24, 52 vykazovaly pokles, avšak ve skupině pacientů s dávkováním Q2W byly signifikantně vyšší než ve skupině Q4W. Výsledek lze tedy hodnotit jako přímou úměru mezi výsledky laboratorními a klinickými. Pokud jde o bezpečnost podávání intenzifikované dávky, ve všech ramenech byl výskyt nežádoucích účinků nízký (hodnoceno na 100 pacientoroků), tento trend se týkal rovněž střevních zánětů a kandidových infekcí. Zásadní je zjištění, že nedocházelo ke statisticky významnému nárůstu výskytu nežádoucích příhod u intenzifikovaného podávání secukinumabu [10].
Kazuistika 1
Pacient (ročník 1980) trpí obezitou a dalšími komorbiditami v podobě opakovaných tromboflebitid a hyperlipidemie s trvalou medikací. Dle anamnestických údajů se psoriáza v rodině nevyskytuje. Chronická ložisková psoriáza u pacienta trvá od roku 2014, má trvale progresivní charakter a nemocný nebyl nikdy zhojen. Revmatolog neprokázal kloubní postižení, přítomnost lidského leukocytárního antigenu B27 (HLA‑B27) byla negativní, gastroenterologické vyšetření neprokázalo zánětlivé střevní onemocnění. Pacient absolvoval klasickou systémovou terapii, která neměla efekt. Tato léčba zahrnovala metotrexát v dávce 10–20–30 mg/týden, acitretin 35–50 mg/den a celotělovou UVB 31 nm fototerapii.
Klinický nález před zahájením biologické léčby byl PASI 24,4; skóre postižení povrchu těla (Body Surface Area, BSA) 64 % a DLQI 30/30 (maximální ovlivnění kvality života). Pacient absolvoval postupně léčbu těmito přípravky: adalimumab po dobu pěti měsíců, brodalumab čtyři měsíce, risankizumab čtyři měsíce. Změna terapie splňovala kritéria úhradové vyhlášky SÚKL pro selhávání efektu přípravku v monoterapii i v kombinaci s metotrexátem.
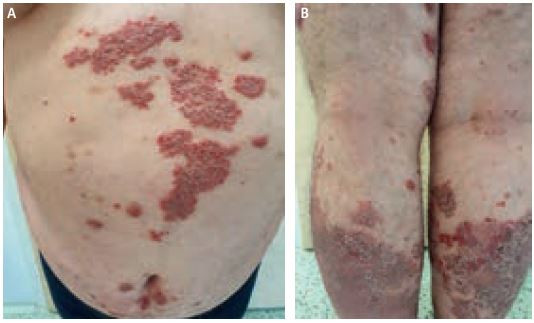 Systémová terapie secukinumabem byla zahájena 30. listopadu 2021. Vstupní kritéria před zahájením biologické léčby byla PASI 22,5, BSA 34 %, DLQI 30/30, BMI 40,5. Dávkování léčiva bylo klasické: 300 mg subkutánně v týdnu 0, 1, 2, 3, 4, poté jednou měsíčně (Q4W). Po indukční dávce došlo u pacienta ke zlepšení: PASI 7,8, BSA 20 %, DLQI 7/30. Po zahájení podávání udržovací dávky jednou měsíčně však efekt léčby stagnoval, od ledna 2022 byla u pacienta zaznamenána pomalá progrese nálezu. Navíc v březnu 2022 pacient prodělal poměrně těžkou ataku infekce covid‑19. V uvedeném období bylo PASI 17,1 a BSA 30 %. Od 9. srpna 2022 byl do medikace přidán metotrexát v dávce 20 mg/týden, potřebný účinek se však nedostavil. Pacient vystřídal biologická léčiva různých skupin bez efektu, proto jsme hledali další možnosti léčebného postupu (obr. 1A, B).
Systémová terapie secukinumabem byla zahájena 30. listopadu 2021. Vstupní kritéria před zahájením biologické léčby byla PASI 22,5, BSA 34 %, DLQI 30/30, BMI 40,5. Dávkování léčiva bylo klasické: 300 mg subkutánně v týdnu 0, 1, 2, 3, 4, poté jednou měsíčně (Q4W). Po indukční dávce došlo u pacienta ke zlepšení: PASI 7,8, BSA 20 %, DLQI 7/30. Po zahájení podávání udržovací dávky jednou měsíčně však efekt léčby stagnoval, od ledna 2022 byla u pacienta zaznamenána pomalá progrese nálezu. Navíc v březnu 2022 pacient prodělal poměrně těžkou ataku infekce covid‑19. V uvedeném období bylo PASI 17,1 a BSA 30 %. Od 9. srpna 2022 byl do medikace přidán metotrexát v dávce 20 mg/týden, potřebný účinek se však nedostavil. Pacient vystřídal biologická léčiva různých skupin bez efektu, proto jsme hledali další možnosti léčebného postupu (obr. 1A, B).
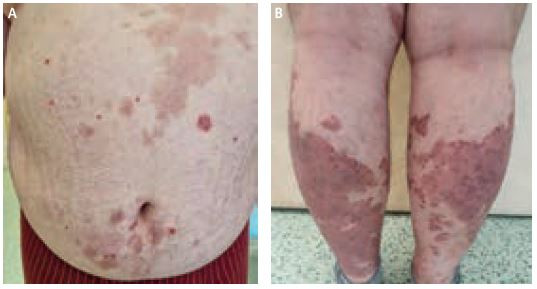 Podávání secukinumabu 300 mg Q2W bylo zahájeno 1. prosince 2022 po schválení revizním lékařem pojišťovny. Hodnota PASI byla 14,4, BSA 38 %. Dále bylo rozhodnuto o ukončení podávání metotrexátu z důvodu přesnějšího zhodnocení efektu akcentované dávky secukinumabu. Kontrola pacienta byla provedena jeden měsíc po zahájení podávání secukinumabu 300 mg Q2W (obr. 2A, B). Subjektivně pacient udával toleranci bez komplikací, ale s mírným zhoršením nálezu, na němž se s velkou pravděpodobností podílelo vysazení metotrexátu. Objektivně lékař zaznamenal hodnotu PASI 10,9 (původně 14,4), BSA 28 % (dříve 38 %), DLQI 4 – tedy významné zlepšení kvality života.
Podávání secukinumabu 300 mg Q2W bylo zahájeno 1. prosince 2022 po schválení revizním lékařem pojišťovny. Hodnota PASI byla 14,4, BSA 38 %. Dále bylo rozhodnuto o ukončení podávání metotrexátu z důvodu přesnějšího zhodnocení efektu akcentované dávky secukinumabu. Kontrola pacienta byla provedena jeden měsíc po zahájení podávání secukinumabu 300 mg Q2W (obr. 2A, B). Subjektivně pacient udával toleranci bez komplikací, ale s mírným zhoršením nálezu, na němž se s velkou pravděpodobností podílelo vysazení metotrexátu. Objektivně lékař zaznamenal hodnotu PASI 10,9 (původně 14,4), BSA 28 % (dříve 38 %), DLQI 4 – tedy významné zlepšení kvality života.
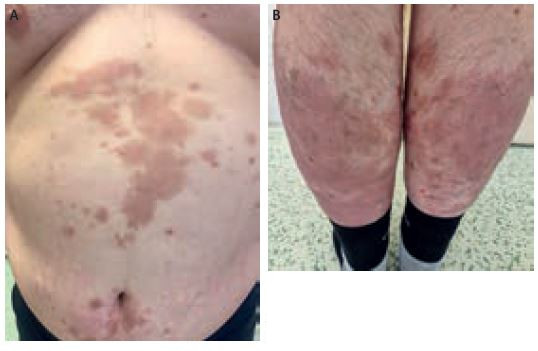 Při kontrole pacienta po pěti měsících léčba nadále probíhá bez komplikací (obr. 3A, B), nedaří se však dosáhnout redukce hmotnosti (140 kg). Hodnota PASI je 7,8, BSA 18 %, DLQI 4. Pacient je nadále sledován a účinek secukinumabu v dávce 300 mg Q2W přetrvává.
Při kontrole pacienta po pěti měsících léčba nadále probíhá bez komplikací (obr. 3A, B), nedaří se však dosáhnout redukce hmotnosti (140 kg). Hodnota PASI je 7,8, BSA 18 %, DLQI 4. Pacient je nadále sledován a účinek secukinumabu v dávce 300 mg Q2W přetrvává.
Kazuistika 2
V druhém případu popisujeme pacientku narozenou v roce 1967. Dle anamnestických údajů měla matka psoriázu po menopauze. Pacientka je obézní a trpí dalšími komorbiditami – hyperlipidemií, hyperurikemií a diabetes mellitus s trvalou medikací. První projevy chronické ložiskové psoriázy se objevily v roce 2014. Žena nikdy nebyla zhojena a onemocnění má tendenci k trvalému zhoršování. Revmatolog neprokázal kloubní postižení, výsledek testu na přítomnost antigenu HLA‑B27 byl negativní, gastroenterolog neprokázal zánětlivé střevní onemocnění. Pacientka absolvovala klasickou systémovou terapii, avšak bez efektu. Léčba zahrnovala metotrexát v dávce 25–30 mg/týden, celotělovou a lokální UVB 31 nm fototerapii.
Klinický nález před zahájením biologické léčby byl PASI 22,5, BSA 11 %, DLQI 21/30, BMI 40,5. Onemocněním byly zasaženy lokty a kolena, poslední články a nehtové ploténky tří prstů na rukou byly postiženy acrodermatitis suppurativa Hallopeau a palmoplantární pustulózou, jednalo se tedy o psoriázu lokalizovanou v tzv. obtížně léčitelných partiích.
Pacientka podstoupila léčbu adalimumabem po dobu 16 měsíců. Změna terapie splňovala kritéria úhradové vyhlášky SÚKL pro selhávání efektu přípravku v monoterapii i v kombinaci s metotrexátem.
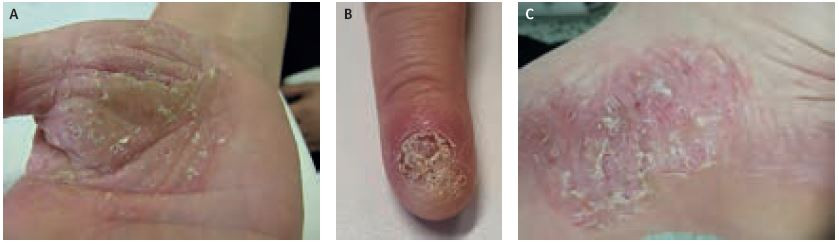 Systémová terapie secukinumabem byla zahájena 2. dubna 2019. Vstupní kritéria před zahájením biologické léčby byla PASI 22,5, BSA 11 %, DLQI 21/30, BMI 40,88. Lék byl podáván v dávce 300 mg subkutánně v týdnu 0, 1, 2, 3, 4 a poté jednou měsíčně. Po indukční dávce došlo k mírnému zlepšení na hodnoty PASI 12,0, BSA 6 %, přetrvávalo postižení dlaní, plosek a tří prstů rukou (DLQI 21/30). Od ledna 2023 byla zaznamenána pomalá progrese nálezu ve všech partiích. Pacientka v listopadu 2021 prodělala velmi těžkou infekci covid‑19, byly podány monoklonální protilátky (REGN‑COV2) kasirivimab a imdevimab intravenózně. Došlo ke zhoršení na PASI 17,1, BSA 30 % a DLQI 22/30. U pacientky se jedná o kombinované postižení několika typy psoriázy, z tohoto důvodu byla hledána možnost dalšího postupu léčby (obr. 4A–C).
Systémová terapie secukinumabem byla zahájena 2. dubna 2019. Vstupní kritéria před zahájením biologické léčby byla PASI 22,5, BSA 11 %, DLQI 21/30, BMI 40,88. Lék byl podáván v dávce 300 mg subkutánně v týdnu 0, 1, 2, 3, 4 a poté jednou měsíčně. Po indukční dávce došlo k mírnému zlepšení na hodnoty PASI 12,0, BSA 6 %, přetrvávalo postižení dlaní, plosek a tří prstů rukou (DLQI 21/30). Od ledna 2023 byla zaznamenána pomalá progrese nálezu ve všech partiích. Pacientka v listopadu 2021 prodělala velmi těžkou infekci covid‑19, byly podány monoklonální protilátky (REGN‑COV2) kasirivimab a imdevimab intravenózně. Došlo ke zhoršení na PASI 17,1, BSA 30 % a DLQI 22/30. U pacientky se jedná o kombinované postižení několika typy psoriázy, z tohoto důvodu byla hledána možnost dalšího postupu léčby (obr. 4A–C).
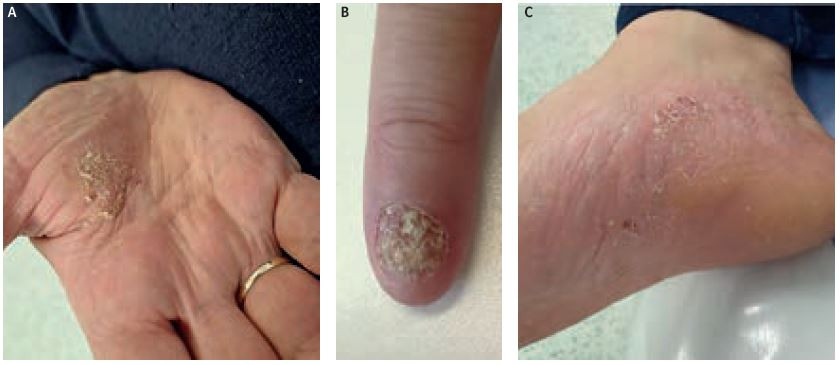 Podávání secukinumabu v dávce 300 mg Q2W bylo zahájeno 14. března 2023 po schválení revizním lékařem pojišťovny. První kontrola byla provedena po jednom měsíci od začátku léčby (obr. 5A–C). Pacientka udávala dobrou toleranci léčby, jako vedlejší projev byl zaznamenán soor v dutině ústní, dle kultivace Candida albicans. Pacientka byla léčena flukonazolem, neboť citlivost vůči itrakonazolu nebyla dostatečná. Infekce byla zvládnuta a zatím se neopakovala. Kožní nález se nezměnil, přetrvávalo postižení loktů, kolen, dlaní, plosek a tří prstů rukou.
Podávání secukinumabu v dávce 300 mg Q2W bylo zahájeno 14. března 2023 po schválení revizním lékařem pojišťovny. První kontrola byla provedena po jednom měsíci od začátku léčby (obr. 5A–C). Pacientka udávala dobrou toleranci léčby, jako vedlejší projev byl zaznamenán soor v dutině ústní, dle kultivace Candida albicans. Pacientka byla léčena flukonazolem, neboť citlivost vůči itrakonazolu nebyla dostatečná. Infekce byla zvládnuta a zatím se neopakovala. Kožní nález se nezměnil, přetrvávalo postižení loktů, kolen, dlaní, plosek a tří prstů rukou.
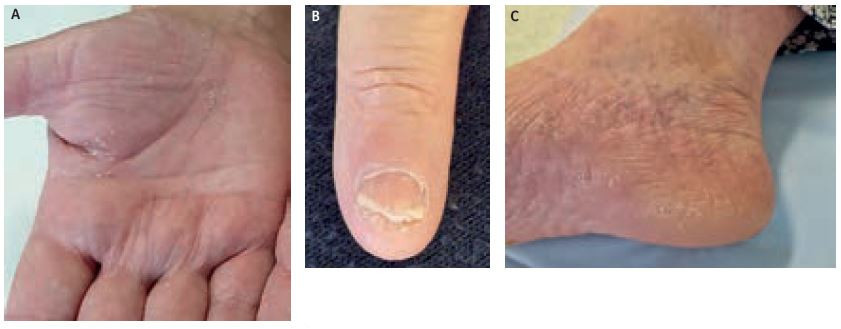 Další kontrola byla provedena po třech měsících od zahájení podávání secukinumabu 300 mg Q2W (obr. 6A–C). Pacientka je nadále bez komplikací, nedaří se však redukce hmotnosti (111 kg). Patrné je zlepšení kožního nálezu: PASI 1,0 (původně 17,1), BSA 1 % (původně 30 %), DLQI 9/30 (původně 22/30) – tedy významné zlepšení kvality života. Nadále pokračují pravidelné kontroly, zhoršení kožního nálezu nebylo zaznamenáno.
Další kontrola byla provedena po třech měsících od zahájení podávání secukinumabu 300 mg Q2W (obr. 6A–C). Pacientka je nadále bez komplikací, nedaří se však redukce hmotnosti (111 kg). Patrné je zlepšení kožního nálezu: PASI 1,0 (původně 17,1), BSA 1 % (původně 30 %), DLQI 9/30 (původně 22/30) – tedy významné zlepšení kvality života. Nadále pokračují pravidelné kontroly, zhoršení kožního nálezu nebylo zaznamenáno.
Závěrečné shrnutí
Režim podávání secukinumabu v dávce 300 mg subkutánně jednou za dva týdny je v souladu se SPC přípravku, ale výslovně se o tomto dávkování nehovoří v podmínkách úhrady SÚKL. Oficiálně tedy uvedené dávkování nepodléhá schválení revizním lékařem, nicméně doporučuje se je i v tomto případě konzultovat se zdravotní pojišťovnou.
Pro podávání secukinumabu 300 mg jednou za dva týdny existuje několik důvodů. Efekt léčby secukinumabem u konkrétních nemocných byl prokázán ve standardní dávce, postupně však účinek této terapie oslabuje vlivem nadváhy a obezity léčených pacientů. Změna dávkování na režim jednou za dva týdny pak přináší zintenzivnění efektu terapie. Rovněž u přípravků stejné lékové skupiny nelze podobný propad účinnosti při udržovací terapii předem vyloučit. Jak dokládají výše uvedené kazuistiky, jedná se o komorbidní, komplikované pacienty, u nichž selhala předchozí biologická léčba. Navíc u pacientů s psoriázou, případně s psoriatickou artritidou je žádoucí spíše udržet účinnou léčbu, než je převádět na jiný přípravek, který nemusí mít vždy mít dostatečnou účinnost na kloubní postižení. Secukinumab poskytuje lékaři možnost flexibilně reagovat na aktuální stav pacienta, což bylo též potvrzeno u prezentovaných případů.
Literatura
[1] Snekvik I, Smith CH, Nilsen TIL, et al. Obesity, Waist Circumference, Weight Chan and Risk of Incident Psoriasis: Prospective Data from the HUNT Study. Br J Invest Dermatol 2017; 137: 2484–2490.
[2] Snekvik I, Nilsen TIL, Romundstad PR, Saunes M. Metabolic Syndrome and Risk of Incident Psoriasis: Prospective data from the HUNT study, Norway. Br J Dermatol 2019; 180: 94–99.
[3] Gustafson B, Hammarstedt A, Andersson CX, Smith U. Inflamed Adipose Tissue: A Culprit Underlying the Metabolic Syndrome and Atherosclerosis. Arterioscler Thromb Vasc Biol 2007; 27: 2276–2283.
[4] Armstrong AW, Harskamp CT, Armstrong EJ. The association between psoriasis and obesity: a systematic review and meta‑analysis of observational studies. Nutr Diabetes 2012; 2: e54.
[5] Torres T, Bettencourt N, Mendonça, et al. Epicardial Adipose Tissue and Coronary Artery Calcification in Psoriatic Patients. J Eur Acad Dermatol Venereol 2015; 29: 270–277.
[6] Armstrong AW, Voyles SV, Armstrong EJ, et al. A Tale of Two Plaques: Convergent Mechanism of T‑Cell Mediated Inflammation In Psoriasis and Atherosclerosis. Exp Dermatol 2011; 20: 544–549.
[7] https://prehledy.sukl.cz/prehled_leciv.html#/leciva/0250236
[8] SPC Cosentyx. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/cosentyx‑epar‑product‑information_cs.pdf
[9] Reich K, Puig L, Szepietowski JC, et al. Secukinumab Dosing Optimization in Patients With Moderate to Severe Psoriasis: Results From The Randomized, Open‑label OPTIMISE Study. Br J Dermatol 2020; 182: 304–315.
[10] Augustin M, Reich K, Yamauchi P, et al. Secukinumab dosing every 2 weeks demonstrated superior efficacy compared with dosing every 4 weeks in patients with psoriasis weighing 90 kg or more: results of a randomized controlled trial. British J Dermatol 2022; 186: 942–954.