Cetuximab a jeho přínos ke zlepšení radikální resekability a přežití pacientů s jaterními metastázami kolorektálního karcinomu: aktualizované výsledky
Cílem neoadjuvantní, respektive konverzní systémové léčby u pacientů s výlučně jaterními metastázami kolorektálního karcinomu je zmenšení primárně inoperabilních metastáz tak, aby následně bylo možné provést kurativní resekci a zvýšit šanci pacientů na dlouhodobé přežití. Studie CELIM byla prospektivní, multicentrická, randomizovaná, nezaslepená klinická studie fáze II, která hodnotila účinnost cetuximabu v kombinaci s chemoterapií (FOLFOX6 nebo FOLFIRI) v neoadjuvantní, respektive konverzní léčbě primárně neoperovatelných jaterních metastáz kolorektálního karcinomu. Ve studii bylo randomizováno celkem 111 pacientů, 56 bylo zařazeno do skupiny s léčbou kombinací cetuximab + FOLFOX6, 55 do skupiny s léčebnou kombinací cetuximab + FOLFIRI. Studii dokončilo 106 pacientů (95,5 %), shodně 53 v obou skupinách. Primárním cílem hodnocení byla četnost léčebných odpovědí. Sekundární cíle zahrnovaly četnost radikálních jaterních resekcí R0, dobu přežití bez progrese nádoru, celkovou dobu přežití a bezpečnost léčby.
Kombinovaná léčba cetuximab + chemoterapie dosáhla vysoké četnosti léčebných odpovědí (62 %), zvýšila možnost provedení jaterních resekcí na 60 % a umožnila provedení radikální resekce jaterních metastáz (R0) u 34 % léčených pacientů. U pacientů s nemutovanou formou genu KRAS umožnila kombinace cetuximab + chemoterapie dosáhnout střední doby přežití bez progrese v délce 11,9 měsíce a střední celkové doby přežití v délce 36,1 měsíce. Provedení R0 resekce zvýšilo medián přežití bez progrese na hodnotu 16,7 měsíce a medián celkové doby přežití na hodnotu 48,1 měsíce.
Tři roky přežívá zhruba 64 % a 4 roky přibližně 49 % pacientů, u kterých byla po předcházející konverzní léčbě cetuximabem v kombinaci s chemoterapií provedena R0 resekce. Z hlediska účinnosti v léčbě jaterních metastáz nebyl zjištěn statisticky významný rozdíl mezi kombinací cetuximab + FOLFOX a cetuximab + FOLFIRI. Cetuximab lze jako přínosný pro léčbu primárně neoperovatelných jaterních metastáz kolorektálního karcinomu doporučit jak v kombinaci s režimem FOLFIRI, tak v kombinaci s režimem FOLFOX.
Úvod
Málokdo bude v současné době pochybovat o tom, že u více než poloviny pacientů s kolorektálním karcinomem jsou pro jejich další prognózu a šanci na dlouhodobé přežití rozhodující jaterní metastázy. Zatímco u synchronně se vyskytujících jaterních metastáz (přítomných již v době stanovení primární diagnózy nádoru) může být jako primárně operabilní hodnoceno i více než 70 % případů, v případě metachronních jaterních metastáz (vznikajících později v průběhu onemocnění) klesá relativní počet primárně operovatelných případů na hodnoty 20–25 %. U pacientů s metastazujícím kolorektálním karcinomem se jaterní metastázy objevují ve více než 80 % případů, většinou společně s metastatickým postižením jiných orgánů, nejčastěji plic nebo lymfatických uzlin. Výlučně jaterní metastázy jsou zjistitelné přibližně ve 20 % případů. Relativní četnost výlučně jaterních metastáz je obdobná jak u pacientů s nádory s nemutovanou alelou genu KRAS (Wt-KRAS), tak s mutovanou alelou (M-KRAS).
Zatímco u primárně operabilních jaterních metastáz adjuvantní systémová léčba (chemoterapie nebo kombinace chemoterapie a biologické léčby) dosud neprokázala jednoznačný terapeutický přínos, je situace u primárně neoperovatelných jaterních metastáz odlišná. V těchto případech má neoadjuvantní, respektive konverzní systémová léčba (jak chemoterapie samotná, tak její kombinace s biologickou léčbou) značný význam. Výsledky mnoha studií svědčí o tom, že předoperační použití systémové léčby s následnou resekcí jater významně prodlužuje dobu přežití bez recidivy po provedené resekci, dobu přežití bez progrese i celkovou dobu přežití ve srovnání s resekcí samotnou [1–3].
K aktuálně schváleným biologickým přípravkům použitelným v České republice k neoadjuvantní léčbě metastazujícího kolorektálního karcinomu patří:
- bevacizumab, humanizovaná monoklonální protilátka typu IgG namířená proti vaskulárnímu endoteliálnímu růstovému faktoru (VEGF),
- cetuximab, chimérická monoklonální protilátka typu IgG1 namířená proti receptoru pro epidermální růstový faktor (EGFR),
- panitumumab, humánní monoklonální protilátka typu IgG2 namířená rovněž proti EGFR.
Všechny uvedené protilátky jsou používány v kombinaci s chemoterapií, nejčastěji s kombinovanými režimy, které zahrnují fluoropyrimidiny, irinotekan či oxaliplatinu.
Zhodnocení přínosu těchto biologik ke zlepšení radikální resekability jaterních metastáz bylo v rozhodujících kontrolovaných klinických studiích obtížné s ohledem na to, že takovéto hodnocení nebylo v žádné z těchto studií
primárním cílem konečného hodnocení a že většina pacientů v těchto studiích měla multiorgánové metastatické postižení, zatímco výlučně jaterní metastázy mělo zhruba jen 20 % z celkového počtu pacientů ve studii [4–8].
Studií zaměřenou na hodnocení účinnosti konverzní léčby zahrnující biologickou léčbu (cetuximab) v kombinaci s chemoterapií u pacientů s výlučně jaterními metastázami kolorektálního karcinomu byla studie CELIM, jejíž výsledky byly poprvé publikovány v roce 2010 [9].
Metodika studie CELIM
CELIM byla prospektivní, multicentrická, randomizovaná, nezaslepená klinická studie fáze II, která hodnotila účinnost cetuximabu v kombinaci s chemoterapií (FOLFOX6 nebo FOLFIRI) v neoadjuvantní, respektive konverzní léčbě primárně neoperovatelných jaterních metastáz kolorektálního karcinomu. V období od 4. 12. 2004 do 27. 3. 2008 bylo do studie zařazeno celkem 114 pacientů ze 17 center v Německu a Rakousku. Do studie byli zařaditelní pacienti s neresekovatelnými, histologicky potvrzenými jaterními metastázami, bez prokazatelného extrahepatálního metastatického postižení. Neoperovatelnost jaterních metastáz byla definována jako přítomnost více než 4 metastatických ložisek nebo jako nález technicky, biologicky či klinicky inoperabilní. Do studie tedy byli zařaditelní i pacienti s difuzním jaterním postižením. Pacienti se synchronními jaterními metastázami byli zařaditelní za předpokladu, že primární nádor bude resekován před zahájením neoadjuvantní léčby. Ve studii byla použita stratifikovaná randomizace. Stratifikační kritéria pro randomizaci byla následující: počet metastáz, technická resekabilita a použití pozitronové emisní tomografie (PET) pro specifikaci klinického stadia onemocnění.
Vyšetření mutace genu KRAS nebylo jako stratifikační kritérium randomizace použito. Analýza stavu alely KRAS a jejího klinického významu byla provedena dodatečně. Celkem byl stav alely KRAS vyšetřen u 89 % pacien-
tů a nemutovaná forma alely KRAS byla zjištěna u 71 % vyšetřených nádorů.
Primárním cílem hodnocení byla četnost léčebných odpovědí (overall response rate, ORR). Sekundární cíle zahrnovaly četnost radikálních jaterních resekcí R0 (kdy nejsou histopatologicky prokazatelné ani mikroskopické známky nádoru), dobu přežití bez progrese nádoru (progression free survival, PFS), celkovou dobu přežití (overall survival, OS), bezpečnost léčby a hodnocení prediktivních molekulárních ukazatelů.
V roce 2010 byly publikovány výsledky týkající se primárního cíle hodnocení, četnosti léčebných odpovědí a také výsledky týkající se četnosti radikálních resekcí R0 [9]. Na podzim roku 2011 prezentoval Folprecht a kol. na evropské konferenci ve Stockholmu (European Multidisciplinary Cancer Congress) aktualizované výsledky ze studie CELIM, jež se týkaly přežití [10].
Výsledky
Randomizováno bylo celkem 111 pacientů, z nichž 56 bylo zařazeno do skupiny s léčbou kombinací cetuximab + FOLFOX6, 55 k léčbě kombinací cetuximab + FOLFIRI. Léčbu absolvovalo a studii dokončilo 106 pacientů (95,5 %), shodně 53 v obou skupinách. Střední délka léčby do resekce činila 5,1 měsíce (rozpětí 2,5–14,7 měsíce), medián počtu aplikovaných cyklů kombinované léčby byl 8 (rozpětí 4–27).
Četnost léčebných odpovědí – primární cíl konečného hodnocení
Četnost léčebných odpovědí zahrnujících kompletní nebo částečnou odpověď (podle kritérií RECIST) v celé populaci pacientů zařazených do studie činila 62,3 %. Nebyl zjištěn významný rozdíl v četnosti odpovědí při kombinaci cetuximabu s režimem FOLFOX6 (68 %) nebo FOLFIRI (57 %; p = 0,23).
Při dodatečném hodnocení četnosti léčebných odpovědí v závislosti na stavu mutace KRAS se potvrdilo, že účinnost kombinované léčby cetuximab + chemoterapie je významně vyšší u nádorů s nemutovanou než s mutovanou formou alely KRAS (70 % vs. 41 %; p = 0,008). Oproti tomu imunohistochemicky prokazovaná pozitivita EGFR neměla z hlediska četnosti léčebných odpovědí prokazatelný prediktivní význam (p = 0,38) [9].
Operabilita jaterních metastáz
Hodnocení vlivu léčebné kombinace cetuximab + chemoterapie na operabilitu jaterních metastáz ukázalo, že neoadjuvantní kombinovaná terapie zvýšila operabilitu ze 32 % před jejím zahájením na 60 % po skončení léčby, tedy o 28 % [9].
Četnost radikálních resekcí R0
Radikální resekce R0 byly provedeny u 34 % léčených pacientů. Při podávání kombinace cetuximab + FOLFOX6 byla četnost R0 resekcí 38 %, při podávání kombinace cetuximab + FOLFIRI 30 %. Tento rozdíl představoval celkem 4 pacienty a nebyl statisticky významný. U pacientů s 5 a více metastatickými jaterními ložisky byly R0 resekce provedeny celkem ve 40 % případů [9].
Výsledky byly podrobeny regresní analýze, která neprokázala statisticky významný vliv typu léčby ani důvodů primární inoperability na konečnou četnost R0 resekcí, ale potvrdila statisticky významný vliv kombinované systémové léčby na celkové zlepšení operability jaterních metastáz (p = 0,039) [9].
Přežití
Význam testování mutace genu KRAS z hlediska přežití
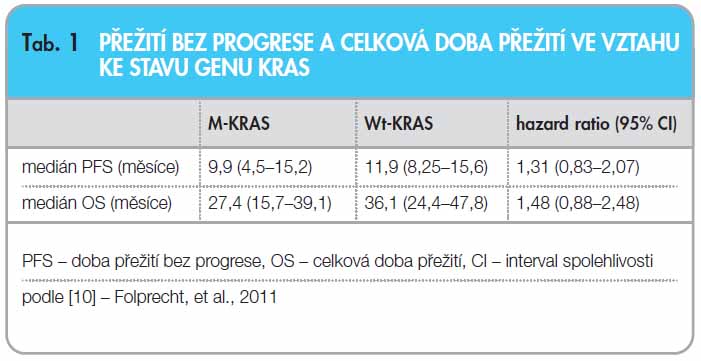 Výsledky hodnocení přežití ve studii CELIM podporují prognostický význam mutace genu KRAS u pacientů s výlučně jaterními a primárně inoperabilními metastázami kolorektálního karcinomu. Pacienti s nádory nesoucími mutaci genu KRAS mají kratší PFS a výrazně kratší OS, i když zjištěné rozdíly vzhledem k malému počtu srovnávaných pacientů nedosáhly statistické významnosti (tab. 1).
Výsledky hodnocení přežití ve studii CELIM podporují prognostický význam mutace genu KRAS u pacientů s výlučně jaterními a primárně inoperabilními metastázami kolorektálního karcinomu. Pacienti s nádory nesoucími mutaci genu KRAS mají kratší PFS a výrazně kratší OS, i když zjištěné rozdíly vzhledem k malému počtu srovnávaných pacientů nedosáhly statistické významnosti (tab. 1).
Srovnání účinnosti cetuximabu v kombinaci s režimem FOLFIRI nebo s režimem FOLFOX6 z hlediska přežití
Hodnocení PFS a OS v populaci pacientů bez rozlišení stavu mutace KRAS neprokázalo rozdíl mezi kohortou pacientů léčených kombinací cetuximab + FOLFOX a kohortou léčenou kombinací cetuximab + FOLFIRI (tab. 2). Přestože medián OS v kohortě pacientů léčených režimem FOLFOX6 je ve srovnání s kohortou léčenou režimem FOLFIRI výrazně vyšší (35,7 měsíce vs. 29,0 měsíců), nedosáhl tento rozdíl vzhledem k malým počtům srovnávaných pacientů statistické významnosti. 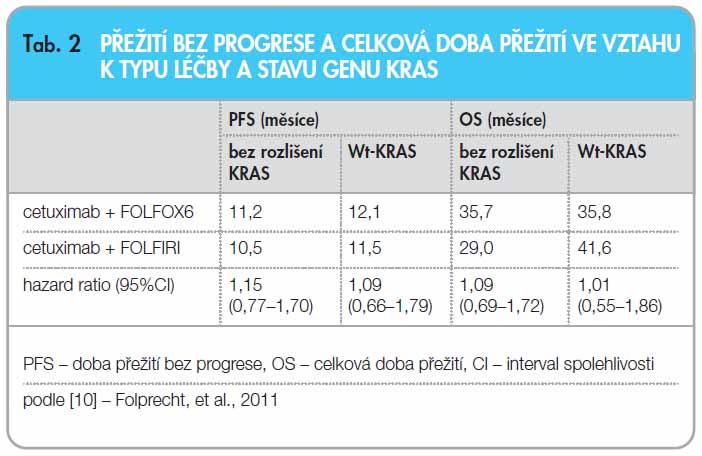
Obdobně ani při analýze v populaci pacientů s nádory nesoucími nemutovanou formu alely KRAS (Wt-KRAS) nebyl, přes existující rozdíl v mediánu OS mezi kohortou pacientů léčených kombinací cetuximab + FOLFOX a kohortou léčenou kombinací cetuximab + FOLFIRI (tab. 2), zjištěn statisticky významný rozdíl v účinnosti obou režimů chemoterapie při kombinaci s cetuximabem.
Význam R0 resekcí jaterních metastáz z hlediska přežití
![Graf 1 PFS a OS ve vztahu k R0 resekci; podle [10] – Folprecht, et al., 2011. PFS – doba přežití bez progrese, OS – celková doba přežití, HR – hazard ratio](https://www.remedia.cz/photo-a-28962---.jpg) Cetuximab podávaný v kombinaci s chemoterapií (FOLFOX6 nebo FOLFIRI) umožnil u původně neresekovatelných jaterních metastáz provedení radikálních R0 resekcí u 34 % pacientů [9]. Výsledky hodnocení PFS a OS ve vztahu k provedené R0 resekci ve studii CELIM jednoznačně potvrzují rozhodující vliv radikální resekce jaterních metastáz na zlepšení přežití (graf 1).
Cetuximab podávaný v kombinaci s chemoterapií (FOLFOX6 nebo FOLFIRI) umožnil u původně neresekovatelných jaterních metastáz provedení radikálních R0 resekcí u 34 % pacientů [9]. Výsledky hodnocení PFS a OS ve vztahu k provedené R0 resekci ve studii CELIM jednoznačně potvrzují rozhodující vliv radikální resekce jaterních metastáz na zlepšení přežití (graf 1).
Pokud byla po předcházející konverzní léčbě provedena radikální R0 resekce jater, dosáhl medián PFS hodnoty 16,7 měsíce a medián OS hodnoty 48,1 měsíce. Pokud po předcházející konverzní léčbě kombinací cetuximab + chemoterapie nelze provést radikální resekci jaterních metastáz (R > 0), je riziko progrese dvojnásobné a riziko úmrtí více než dvojnásobné ve srovnání s kohortou pacientů, u nichž byla radikální resekce (R0) provedena. Zjištěné rozdíly jsou statisticky vysoce významné. Tři roky přežívá zhruba 64 % a 4 roky přibližně 49 % pacientů, u kterých byla provedena R0 resekce po předcházející konverzní léčbě cetuximabem v kombinaci s chemoterapií [10].
Délka přežití bez známek nádorového onemocnění po provedení R0 resekce a její vztah k výchozímu rozsahu metastatického postižení
Resekce R0 byla po léčbě provedena celkem u 36 ze 106 léčených pacientů (34 %). U 11 pacientů (30,6 %) po resekci R0 byl výchozí počet metastatických ložisek < 5 (technicky inoperabilní metastázy), u 22 pacientů (61,1 %) se počet ložisek pohyboval v rozmezí 5–10 a u 3 pacientů (8,3 %) byl počet ložisek > 10 [9].
Střední doba přežití bez známek nádorového onemocnění (DFS) u pacientů po provedené resekci R0 byla 9,9 měsíce. Analýza vztahu výchozího rozsahu metastatického postižení jater ukázala, že u pacientů s méně než 5 metastatickými ložisky vedlo podávání kombinované léčby cetuximab + chemoterapie s následnou R0 resekcí zbytkového metastatického postižení jater k dosažení střední délky přežití bez známek nádorového postižení (medián DFS) v délce 16,8 měsíce, při výchozím počtu 5–10 metastatických ložisek se medián DFS snížil na 8,2 měsíce a při výchozím počtu > 10 ložisek byl medián DFS pouze 2 měsíce (graf 2).
Z těchto výsledků můžeme odvozovat, že největší prospěch z kombinované léčby cetuximab + chemoterapie a z následné radikální resekce R0 mají pacienti s primárně technicky inoperabilními metastázami, u nichž je výchozí počet metastatických ložisek v játrech menší než 5.
Přínos má tato konverzní léčba i u pacientů s celkovým počtem 5–10 metastatických ložisek v játrech. Při počtu více než 10 metastatických ložisek se terapeutický přínos konverzní léčby ztrácí.
Bezpečnost léčby a nežádoucí příhody
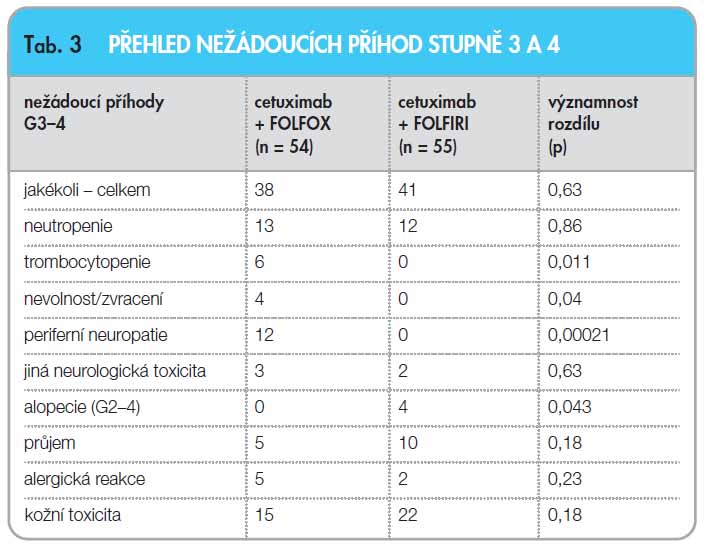 Z hlediska bezpečnosti bylo hodnoceno 109 pacientů, 54 ve skupině cetuximab + FOLFOX6 a 55 ve skupině cetuximab + FOLFIRI. V období předoperační systémové léčby zemřeli 2 pacienti, v každé skupině jeden. Ve skupině cetuximab + FOLFIRI pacient zemřel v důsledku plicní embolizace (bez prokazatelně přímého vztahu k systémové léčbě), ve skupině cetuximab + FOLFOX6 pacient zemřel v důsledku progrese onemocnění, jež bylo komplikováno průjmem vyvolaným léčbou. Přehled nežádoucích účinků stupně 3 a 4 je uveden v tab. 3. Z přehledu vyplývá, že při použití režimu FOLFOX6 se významně častěji vyskytla nevolnost a zvracení, trombocytopenie a především periferní neurotoxicita. Režim FOLFIRI vykazoval významně častěji alopecii, častější byl též výskyt průjmu. Souhrnný výskyt alergické reakce G3 na infuzi cetuximabu představoval 6,4 %. Souhrnný výskyt kožní reakce G3 po podání cetuximabu dosahoval 34 %. Tato zjištění jsou ve shodě s toxicitou a nežádoucími příhodami obou režimů, jež byly zaznamenány v předchozích klinických studiích s cetuximabem v léčbě metastazujícího kolorektálního karcinomu [9].
Z hlediska bezpečnosti bylo hodnoceno 109 pacientů, 54 ve skupině cetuximab + FOLFOX6 a 55 ve skupině cetuximab + FOLFIRI. V období předoperační systémové léčby zemřeli 2 pacienti, v každé skupině jeden. Ve skupině cetuximab + FOLFIRI pacient zemřel v důsledku plicní embolizace (bez prokazatelně přímého vztahu k systémové léčbě), ve skupině cetuximab + FOLFOX6 pacient zemřel v důsledku progrese onemocnění, jež bylo komplikováno průjmem vyvolaným léčbou. Přehled nežádoucích účinků stupně 3 a 4 je uveden v tab. 3. Z přehledu vyplývá, že při použití režimu FOLFOX6 se významně častěji vyskytla nevolnost a zvracení, trombocytopenie a především periferní neurotoxicita. Režim FOLFIRI vykazoval významně častěji alopecii, častější byl též výskyt průjmu. Souhrnný výskyt alergické reakce G3 na infuzi cetuximabu představoval 6,4 %. Souhrnný výskyt kožní reakce G3 po podání cetuximabu dosahoval 34 %. Tato zjištění jsou ve shodě s toxicitou a nežádoucími příhodami obou režimů, jež byly zaznamenány v předchozích klinických studiích s cetuximabem v léčbě metastazujícího kolorektálního karcinomu [9].
Diskuse
V roce 2011 publikoval profesor Adam přehled údajů z mezinárodního registru resekcí jaterních metastáz u kolorektálního karcinomu, který od roku 1995 do června 2010 zahrnul celkem 10 436 pacientů ze 151 zdravotnických center ve 39 zemích [11].
Synchronní jaterní metastázy se vyskytly u 69 % pacientů s kolorektálním karcinomem. Postižení obou laloků bylo zjištěno u 49 % pacientů. Metastázy v průměru větší než 5 cm pak byly zjištěny ve 30 % případů. Jako primárně resekabilní byly jaterní metastázy hodnoceny v 63 % případů. Předoperační chemoterapii dostalo zhruba 45 % pacientů s jaterními metastázami, přičemž oxaliplatina byla použita ve 36 %, irinotekan ve 12 % případů. Pět let přežívalo 39 % a 10 let 23 % pacientů. Jako nezávislé proměnné ovlivňující OS byly zjištěny: progrese nádoru při předoperační chemoterapii (p = 0,03), primární metastatické postižení uzlin (p = 0,005), konkomitantní mimojaterní metastázy (p < 0,001), postižení více než 3 lokalizací (p = 0,006), resekce s makroskopicky pozitivním lemem (p < 0,001) a zvýšené hodnoty karcinoembryonálního antigenu (p < 0,001). Navíc použití více než 6 cyklů předoperační chemoterapie bylo spojeno s kratší DFS (p = 0,04). Typ předoperační léčby nebyl z hlediska přežití prokazatelně nezávislou proměnnou [11].
Rozsáhlý systematický přehled výsledků publikovaných do roku 2008 ukazuje, že použití irinotekanu nebo oxaliplatiny v kombinované chemoterapii (FOLFOX4 nebo FOLFIRI) vede k významnému zmenšení primárně neresekabilních jaterních metastáz, které umožní následnou resekci u 9–35 % pacientů při použití irinotekanu a u 7–51 % pacientů při použití oxaliplatiny. Neexistují zatím jednoznačné důkazy o tom, že by některé z těchto dvou cytostatik bylo v konverzní léčbě jaterních metastáz účinnější z hlediska PFS a OS [12].
Přímé srovnání účinnosti režimu FOLFOXIRI proti režimu FOLFIRI v populaci pacientů s multiorgánovým postižením ukázalo, že účinnost režimu FOLFOXIRI je z hlediska R0 metastazektomií vyšší než účinnost režimu FOLFIRI. V subpopulaci pacientů s výlučně jaterními metastázami to byly četnosti R0 resekcí 36 % při použití režimu FOLFOXIRI oproti 12 % při použití režimu FOLFIRI [13].
V případě využití biologické léčby v konverzní terapii u metastazujícího kolorektálního karcinomu s výlučně jaterními metastázami existuje velmi málo výsledků z kontrolovaných klinických studií. Dosud se jedná převážně o výsledky nekontrolovaných studií fáze II.
Jednou z nich byla studie POCHER, jejíž výsledky publikovali Garufi a kol. v roce 2010 [14]. V prospektivní nekontrolované studii fáze II (POCHER; Eudaract 2005-006205-28), do které bylo zařazeno 43 pacientů s neoperovatelnými jaterními metastázami kolorektálního karcinomu (9 pacientů mělo metastázy > 5 cm, 29 pacientů mělo mnohočetné metastázy – tj. více než 4, 1 pacient měl metastázy v oblasti hilu, 4 pacienti měli současně extrahepatální metastázy) autoři hodnotili účinnost kombinovaného režimu cetuximab + FOLFIRINOX v konverzní léčbě jaterních metastáz. Celková četnost dosažených léčebných odpovědí byla 79 %, z toho v 5 % byla patologem potvrzena kompletní regrese. Resekce jater byla provedena u 65 % pacientů, z toho 60 % tvořily radikální resekce
R0. Medián PFS byl v celé skupině 14 měsíců, u pacientů po resekci 15 měsíců oproti 9 měsícům u pacientů bez možnosti provedení následné resekce. Medián OS dosahoval pro celou populaci pacientů 37 měsíců, přičemž 2 roky přežívalo 68 % pacientů, z toho 81 % ve skupině s následnou resekcí jater vs. 47 % ve skupině bez resekce [14].
V roce 2011 byly publikovány výsledky 2 studií fáze II hodnotící účinnost kombinace bevacizumab + chemoterapie v konverzní léčbě pacientů s primárně neoperovatelnými jaterními metastázami kolorektálního karcinomu.
Wong a kol. v prospektivní multicentrické nekontrolované studii fáze II (BOXER; NCT00450346) hodnotili účinnost kombinace bevacizumab + CAPOX (kapecitabin + oxaliplatina) v konverzní léčbě 46 pacientů s výlučně jaterními metastázami, které byly primárně neresekabilní nebo obtížně resekabilní [15]. V rámci neoadjuvantní léčby bylo 50 % pacientů kromě systémové kombinované terapie bevacizumab + CAPOX léčeno současně chemoradioterapií a 28 % pacientů podstupujících resekci bylo před vlastní resekcí léčeno ještě radiofrekvenční ablací (RFA), což obojí mohlo zvyšovat pravděpodobnost dosažení resekability jaterních metastáz. Před léčbou bylo pouze 33 % pacientů hodnoceno jako potenciálně operabilních, po léčbě byla jaterní resekce provedena u 40 % pacientů, což je zvýšení o 7 %. Jako R0 resekce bylo hodnoceno 9 případů, což při celkovém počtu 46 pacientů představuje 20 %. Je však nutno dodat, že dalších 11 % pacientů dosáhlo po léčbě kompletní regrese metastatického postižení, takže u nich nebyla resekce indikována ani provedena. Lze tedy nepřímo kalkulovat, že celkový počet kompletního vymizení jaterních metastáz odpovídal 33 %. Bez progrese přežívalo 6 měsíců 73 % a 12 měsíců 50 % pacientů. Celkově přežívalo 6 měsíců 96 %, 1 rok 86 % pacientů [15].
V další prospektivní nekontrolované studii fáze II Bertolini a kol. hodnotili v kohortě 21 pacientů s výlučně jaterními metastázami kolorektálního karcinomu, které byly primárně neresekovatelné nebo obtížně resekovatelné, účinnost kombinace bevacizumab + FOLFOX6 [16]. Celkem bylo dosaženo 57 % léčebných odpovědí, z čehož 14 % tvořily odpovědi kompletní. Celková resekabilita byla 62 %, z toho R0 resekce byly provedeny ve 23 % případů. Medián doby PFS byl 12,9 měsíce, medián OS byl 22,5 měsíce v celé populaci, v populaci pacientů s provedenou jaterní resekcí byl 35,6 měsíce oproti 15,3 měsíce u pacientů, u nichž resekce nebyla provedena. Medián doby přežití bez známek onemocnění u pacientů s R0 resekcí byl 8 měsíců [16].
Jestliže na základě existujících výsledků a nepřímých srovnání připustíme, že zavedení biologické léčby zvýšilo účinnost neoadjuvantní, konverzní léčby ve srovnání s účinností samotné chemoterapie, pak na základě stejných nepřímých srovnání můžeme konstatovat, že výsledky studie CELIM spolu s výsledky studie POCHER naznačují, že kombinace cetuximab + chemoterapie vykazuje v průměru zhruba stejnou četnost léčebných odpovědí a poněkud vyšší četnost radikálních jaterních resekcí R0 ve srovnání s kombinací bevacizumab + chemoterapie. Z hlediska PFS je účinnost bevacizumabu a cetuximabu v konverzní léčbě obdobná, z hlediska OS se cetuximab jeví výrazně účinnější. Je-li cetuximab použit v kombinaci s chemoterapií pouze u pacientů, jejichž nádory vykazují nemutovanou formu alely KRAS (Wt-KRAS), účinnost cetuximabu se dále zvýší. V současné době nás nepřímá srovnání opravňují k tomu, aby v konverzní léčbě pacientů s metastazujícím kolorektálním karcinomem a s výlučně jaterními metastázami byl u nádorů s nemutovanou formou alely KRAS používán přednostně cetuximab, zatímco u pacientů s mutovanou formou alely KRAS se jako vhodné jeví použití bevacizumabu.
Pro definitivní potvrzení přínosu biologické léčby v konverzní léčbě metastazujícího kolorektálního karcinomu je zapotřebí uskutečnit další klinické studie, především kontrolované klinické studie fáze III, ve kterých budou provedena potřebná přímá srovnání jednotlivých léčebných přístupů.
Seznam použité literatury
- [1] Wang CC, Li J. An update on chemotherapy of colorectal liver metastases. World J Gastroenterol 2012; 18: 25–33.
- [2] Chan KM, Chiang JM, Lee ChF, et al. Outcomes of resection for colorectal cancer hepatic metastases stratified by evolving eras of treatment. World J Surg Oncol 2011; 9: 174.
- [3] Chibaudel B, Tournigand C, André T, de Gramont A. Therapeutic strategy in unresectable metastatic colorectal cancer. Ther Adv Med Oncol 2012; 4: 75–89.
- [4] Hurwitz H, Fehrenbacher L, Novotny W, et al. Bevacizumab plus Irinotecan, Fluorouracil, and Leucovorin for Metastatic Colorectal Cancer. NEJM 2004; 350: 2335–2342.
- [5] Saltz LB, Clarke S, Díaz-Rubio E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: A randomized phase III study. JCO 2008; 26: 2013–2019.
- [6] Van Cutsem E, Köhne CH, Láng I, et al. Cetuximab Plus Irinotecan, Fluorouracil, and Leucovorin As First-Line Treatment for Metastatic Colorectal Cancer: Updated Analysis of Overall Survival According to Tumor KRAS and BRAF Mutation Status. J Clin Oncol 2011; 29: 2011–2019.
- [7] Bokemeyer C, Bondarenko I, Makhson A, et al. Fluorouracil, Leucovorin, and Oxaliplatin With and Without Cetuximab in the First-Line Treatment of Metastatic Colorectal Cancer. J Clin Oncol 2009; 27: 663–671.
- [8] Douillard JY, Siena S, Cassidy J, et al. Randomized, Phase III Trial of Panitumumab With Infusional Fluorouracil, Leucovorin, and Oxaliplatin (FOLFOX4) Versus FOLFOX4 Alone As First-Line Treatment in Patients With Previously Untreated Metastatic Colorectal Cancer: The PRIME Study. JCO 2010; 28: 4697–4705.
- [9] Folprecht G, Gruenberger T, Bechstein WO, et al. Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab: the CELIM randomised phase 2 trial. The Lancet Oncology 2010; 11: 38–47.
- [10] Folprecht G, et al. Program and abstracts of the 2011 European Multidisciplinary Cancer Congress; September 23-27, 2011; Stockholm, Sweden. Abstract 6009.
- [11] Adam R, Barroso E, Laurent G, et al. Impact of the type and modalities of preoperative chemotherapy on the outcome of liver resection for colorectal metastases. J Clin Oncol 2011; 29: abstr 3519.
- [12] Rivoire M, Thezenas S, Rebischung C, et al. Preliminary results of a randomized phase II trial comparing standard bi-therapy versus three intensified chemotherapy regimens as treatment for patients with non resectable liver metastases from colorectal cancer (METHEP). J Clin Oncol 2008; 26: a4075.
- [13] Falcone A, Ricci S, Brunetti I, et al. Phase III Trial of Infusional Fluorouracil, Leucovorin, Oxaliplatin, and Irinotecan (FOLFOXIRI) Compared With Infusional Fluorouracil, Leucovorin, and Irinotecan (FOLFIRI) As First-Line Treatment for Metastatic Colorectal Cancer: The Gruppo Oncologico Nord Ovest. J Clin Oncol 2007; 25: 1670–1676.
- [14] Garufi C, Torsello A, Tumolo S, et al. Cetuximab plus chronomodulated irinotecan, 5-fluorouracil, leucovorin and oxaliplatin as neoadjuvant chemotherapy in colorectal liver metastases: POCHER trial. Br J Cancer 2010; 103: 1542–1547.
- [15] Wong R, Cunningham D, Barbachano Y, et al. A multicentre study of capecitabine, oxaliplatin plus bevacizumab as perioperative treatment of patients with poor-risk colorectal liver-only metastases not selected for upfront resection. Ann Oncol 2011; 22: 2042–2048.
- [16] Bertolini F, Malavasi N, Scarabelli L, et al. FOLFOX6 and bevacizumab in non-optimally resectable liver metastases from colorectal cancer. Br J Cancer 2011; 104: 1079–1084.
![Graf 2 DFS po R0 resekcích; podle [10] – Folprecht, et al., 2011. DFS – doba přežití bez známek nádorového onemocnění, OS – celková doba přežití, CI – interval spolehlivosti](https://www.remedia.cz/photo-a-28963---.jpg)