Cetuximab v léčbě metastatického kolorektálního karcinomu – kazuistiky
Souhrn:
Cetuximab patří mezi pilíře cílené terapie u pacientů s metastatickým kolorektálním karcinomem. V klinických studiích přidání cetuximabu k chemoterapii výrazně prodloužilo celkové přežití pacientů s nemutovaným genem RAS. Cetuximab dále prokázal významné dosažení časného zmenšení metastatického postižení jater, jež umožňuje následnou chirurgickou resekci. Kazuistiky prezentují právě tento přínos cetuximabu v klinické praxi.
Key words: colorectal carcinoma – metastases – targeted therapy.
Summary:
Cetuximab is a mainstay of targeted therapy of metastatic colorectal carcinoma. Adding cetuximab to chemotherapy lead to significant prolongation of overall survival of patients without RAS gene mutations in clinical trials. Moreover, cetuximab treatment was associated with significant early reduction in metastatic lesion load, making subsequent surgical resection possible. Our case studies demonstrate these benefits associated with cetuximab in clinical practice.
Úvod
Léčba metastatického kolorektálního karcinomu (metastatic colorectal cancer, mCRC) patří ke každodenní praxi všech onkologických center. Nutnou podmínkou úspěšné léčby je konzultace pacientů v rámci mezioborové komise. Nepostradatelnou součástí léčebných postupů je i aplikace systémové chemoterapie a cílené terapie, které prokázaly prodloužení celkového přežití (overall survival, OS) u nemocných s neresekabilním mCRC až za horizont tří let. Jedním z typů cílené terapie je aplikace monoklonálních protilátek proti receptoru pro epidermální růstový faktor (epidermal growth factor receptor, EGFR), kam patří i cetuximab. Jedná se o chimérickou IgG1 protilátku, která prokázala v kombinaci s chemoterapií významné prodloužení mediánu OS při podání v první linii u pacientů s nemutovaným genem KRAS (wild type KRAS, wtKRAS) [1]. V případě optimálně neresekabilního onemocnění byl jasně zdokumentován přínos cetuximabu v konverzní léčbě s cílem dosažení časné terapeutické odpovědi (early tumour shrinkage, ETS) s následným použitím resekce či jiných ablačních metod [2]. Cetuximab jako představitel anti EGFR terapie ve srovnání s bevacizumabem prokázal: a) významné prodloužení OS v první linii léčby u pacientů s wtRAS, b) vyšší podíl dosažení ETS. Nutnou podmínkou podání cetuximabu je přítomnost genu wtRAS jako prediktoru jeho účinnosti. V poslední době výsledky retrospektivních analýz klinických studií potvrzují jednoznačný přínos cetuximabu v léčbě levostranných karcinomů, kde nepodání anti EGFR terapie u pacientů s genem wtRAS lze považovat za neoptimální až chybný postup [3]. Následně představujeme dvě kazuistiky pacientů s mCRC, u nichž aktuálně probíhá léčba cetuximabem v rámci naší onkologické ambulance.
Kazuistika 1
Nemocný (nar. 1947) v anamnéze
léčen inhibitorem angiotenzin konvertujícího enzymu (ACE) pro
arteriální hypertenzi. Od února 2016 postupně pozoroval
krvácení z konečníku. Na kolonoskopii byl popsán
tumorový proces v oblasti rektosigmatu, histologicky potvrzen
adenokarcinom. V rámci stagingu zjištěn mnohočetný
metastatický proces jater, kde bylo v obou lalocích nalezeno
celkem sedm ložisek, největší o průměru 95 mm (obr. 1). Pacient byl konzultován v rámci mezioborového
seminář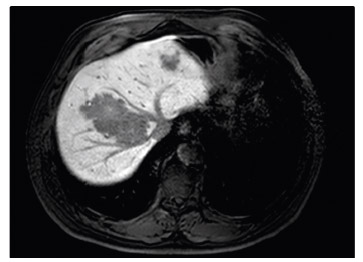 e, kde byl nález zhodnocen jako
inoperabilní. Současně byla vzhledem ke krvácení
z primárního tumoru doporučena paliativní resekce, která
proběhla v dubnu 2016. Histologicky po resekci
rektosigmatu byl nalezen tubulární adenokarcinom, stupeň
diferencovanosti G2, metastázy v lymfatických uzlinách
(LU) +0/7, byla zjištěna přítomnost genu wtRAS, stadium:
pT3 pN0 M1 (HEP). Následně se pacient dostavil na naši
ambulanci k zahájení systémové léčby. Vzhledem k rozsahu
onemocnění bylo cílem prodloužení OS při
zachování dobré kvality života. Pacient byl ve výborné
kondici, s hodnotou performance status (PS) dle ECOG
(Eastern Cooperative Oncology Group) 0. Vstupně byla
přítomna elevace tumorových markerů: CEA
(karcinoembryonální antigen) 21,9 µg/l, CA 19 9
(monoklonální protilátkou definovaný mucin sialo glykolipid)
56,1 kU/l.
e, kde byl nález zhodnocen jako
inoperabilní. Současně byla vzhledem ke krvácení
z primárního tumoru doporučena paliativní resekce, která
proběhla v dubnu 2016. Histologicky po resekci
rektosigmatu byl nalezen tubulární adenokarcinom, stupeň
diferencovanosti G2, metastázy v lymfatických uzlinách
(LU) +0/7, byla zjištěna přítomnost genu wtRAS, stadium:
pT3 pN0 M1 (HEP). Následně se pacient dostavil na naši
ambulanci k zahájení systémové léčby. Vzhledem k rozsahu
onemocnění bylo cílem prodloužení OS při
zachování dobré kvality života. Pacient byl ve výborné
kondici, s hodnotou performance status (PS) dle ECOG
(Eastern Cooperative Oncology Group) 0. Vstupně byla
přítomna elevace tumorových markerů: CEA
(karcinoembryonální antigen) 21,9 µg/l, CA 19 9
(monoklonální protilátkou definovaný mucin sialo glykolipid)
56,1 kU/l.
Pacienta jsme začali léčit kombinací
FOLFOX/cetuximab od května 2016. Již po pěti dnech se
u něj objevila výraznější kožní reakce na tváři,
až třetího stupně. U nemocného jsme proto zahájili lokální
terapii kortikoidy a systémové podávání doxycyklinu.
Po této léčbě došlo sice k rozvoji kožní reakce
i na oblast trupu a k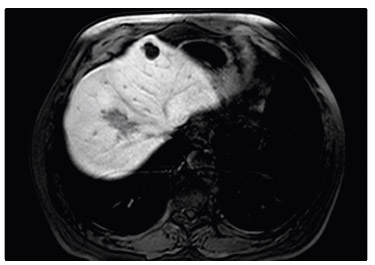 ončetin, ale nižšího stupně.
Postupně nastala rovněž regrese
postižení kůže na tváři až na stupeň
1, který trvá dosud. Po čtvrtém
cyklu se objevily neuropatické bolesti v oblasti horních
končetin, které se postupně zhoršovaly. Po osmi cyklech jsme
provedli přešetření s částečným zmenšením všech
ložisek v játrech (největší z 95 mm
na 60 mm, obr. 2).
Nález je však dále inoperabilní. V laboratoři
byla zjištěna normalizace hodnot markerů. Vzhledem k neuropatii
jsme pokračovali v léčbě samotnou aplikací cetuximabu
po dvou týdnech. Na následném
vyšetření magnetickou rezonancí (únor 2017)
se projevila další regrese všech ložisek, která trvá dosud
(červen 2017). Příznaky neuropatie
postupně regredují. Pacient byl po celou dobu bez infekčních
komplikací, bez patologie v krevním obraze či v biochemických
hodnotách; je aktivní, pracuje, cestuje, s celkovým
PS v hodnotě 0.
ončetin, ale nižšího stupně.
Postupně nastala rovněž regrese
postižení kůže na tváři až na stupeň
1, který trvá dosud. Po čtvrtém
cyklu se objevily neuropatické bolesti v oblasti horních
končetin, které se postupně zhoršovaly. Po osmi cyklech jsme
provedli přešetření s částečným zmenšením všech
ložisek v játrech (největší z 95 mm
na 60 mm, obr. 2).
Nález je však dále inoperabilní. V laboratoři
byla zjištěna normalizace hodnot markerů. Vzhledem k neuropatii
jsme pokračovali v léčbě samotnou aplikací cetuximabu
po dvou týdnech. Na následném
vyšetření magnetickou rezonancí (únor 2017)
se projevila další regrese všech ložisek, která trvá dosud
(červen 2017). Příznaky neuropatie
postupně regredují. Pacient byl po celou dobu bez infekčních
komplikací, bez patologie v krevním obraze či v biochemických
hodnotách; je aktivní, pracuje, cestuje, s celkovým
PS v hodnotě 0.
Kazuistika 2
Druhý nemocný (nar. 1949) k nám přišel na konzultaci po vyšetření v regionální onkologické ambulanci. V roce 2014 u něj byla provedena resekce rektosigmatu s nálezem adenokarcinomu stadia pT2 pN0 (LU +0/12) M0. Pacient byl bez adjuvantní léčby. Za rok, v červnu 2016, byla zjištěna dvě ložiska v játrech, primárně operabilní. Byla provedena resekce, histologicky potvrzena metastáza adenokarcinomu. Následně do prosince 2015 bylo podáno osm cyklů adjuvantní léčby v režimu XELOX. Za čtyři měsíce nastala opět recidiva v játrech s nálezem dvou operabilních ložisek, resekce provedena v květnu 2016, histologie pozitivní na adenokarcinom. Bez adjuvantní systémové léčby. Letos v únoru na kontrolním přešetření nález čtyř metaložisek o velikosti do 26 mm. Nemocný byl odeslán k nám do centra, nález byl optimálně inoperabilní. Pacient bez dalších komorbidit v anamnéze, pracuje jako řidič, celkový PS dle ECOG je 0. Byla provedena analýza na přítomnost RAS, zjištěna nemutovaná forma.
Cílem léčby byla konverze s následnou indikací lokální terapeutické metody. U pacienta jsme indikovali režim FOLFIRI/cetuximab. Po prvním cyklu se na tváři objevila kožní reakce stupně 1, dále se vyskytly mírný průjem a aftózní stomatitida. Zahájili jsme lokální léčbu mastným krémem, aplikaci loperamidu a péči o dutinu ústní pomocí chlorhexidinu. Po třetím cyklu došlo ke zhoršení reakce na tváři na stupeň 2, po lokálním podání antibiotik stav regredoval, až dosud trvá stupeň 1 kožní toxicity. Došlo k vymizení průjmu a aftózní stomatitidy. Laboratorní hodnoty byly po celou dobu léčby bez výkyvů. Celkem jsme u pacienta podali sedm cyklů léčby, po nichž jsme v červnu 2017 provedli kontrolní vyšetření. Na magnetické rezonanci došlo k vymizení dvou ložisek a k regresi dvou metaložisek na velikost 10 mm. Nemocný byl konzultován v rámci mezioborové komise. Vzhledem k již opakovaným resekcím a k riziku další subklinické diseminace v játrech jsme u pacienta indikovali provedení radiofrekvenční ablace (RFA) dvou ložisek a pokračování systémové léčby.
Diskuse
Obě kazuistiky představují nemocné s levostranným karcinomem. V prvním případě šlo již v době diagnózy o výrazné postižení jater, kde resekce nebyla možná ani při výraznější regresi. Cílem léčby bylo prodloužení celkového přežití. V první linii má v oblasti prodloužení OS nejvíce dat cetuximab, zvolili jsme proto tuto cílenou terapii. Aktuálně již máme data rovněž o podání cetuximabu s režimem FOLFOX [4,5]. Nemocný měl obavu ze vzniku průjmu po předchozí operaci rektosigmatu, z tohoto důvodu jsme indikovali režim FOLFOX. Bohužel došlo k rozvoji výraznější neuropatie, podávaní chemoterapie jsme tedy byli nuceni ukončit. Dále trvá přínos cílené monoterapie cetuximabem, dosud za dobré kvality života. Pacient je léčen již třináctý měsíc.
U druhého nemocného se jednalo o lokalizované postižení jater (celkem čtyři ložiska). Cílem byla konverze na lokálně řešitelné onemocnění, kdy za 3,5 měsíce došlo k výraznému zmenšení postižení jater. U pacienta jsme indikovali RFA na dvě přetrvávající ložiska. Nebyl indikován chirurgický výkon vzhledem ke dvěma dřívějším resekcím a k riziku existence subklinického jaterního postižení. Pacient bude dále pokračovat v systémové léčbě.
Obě kazuistiky potvrdily účinnost cetuximabu. U nemocných se vyskytla časná kožní reakce, u jednoho až třetího stupně. Po lokální i celkové terapii došlo k regresi a stabilizaci reakce. Časný výskyt kožní reakce predikoval léčebnou odpověď na cetuximab. Závěrem lze shrnout, že podání cetuximabu patří mezi účinné léčebné možnosti u pacientů s RAS nemutovaným metastatickým karcinomem v první linii, zvláště u nemocných s levostranným uložením primárního nádoru.
Seznam použité literatury
- [1] Van Cutsem E, Köhne CH, Láng I, et al. Cetuximab plus irinotecan, fluorouracil, and leucovorin as first‑line treatment for metastatic colorectal cancer: updated analysis of overall survival according to tumor KRAS and BRAF mutation status. J Clin Oncol 2011; 29: 2011–2019.
- [2] Heinemann V, Rivera F, O’Neil BH, et al. A study‑level meta‑analysis of efficacy data from heed‑to‑head first line trial of epidermal growth factor receptor inhibitors versus bevacizumab in patients with RAS wild‑type metastatic colorectal cancer. Eur J Cancer 2016; 67: 11–20.
- [3] Venook AP, Niedzwiecki D, Innocenti F, et al. Impact of primary (1°) tumor location on overall survival (OS) and progression‑free survival (PFS) in patients (pts) with metastatic colorectal cancer (mCRC): Analysis of CALGB/SWOG 80405. J Clin Oncol 2016; 34 (Suppl): 3504 (Abstr).
- [4] Qin S, Xu J, Wang L, et al. LBA‑05 First‑line FOLFOX- -4 ± cetuximab in patients with RAS wild‑type (wt) metastatic colorectal cancer (mCRC): the open‑label, randomized phase 3 TAILOR trial. Ann Oncol 2016; 27 (Suppl 4): 0–25.
- [5] Venook A, Niedzwiecki H, Lenz HJ, et al. CALGB/SWOG 8040. Ann Oncol 2014; 25: ii105–ii117.