Dlouhodobá účinnost a bezpečnost léčby siponimodem u pacientů se sekundárně progresivní roztroušenou sklerózou – pětiletá data studie EXPAND a její ex
Analýza více než pětiletých dat studie EXPAND a její extenze doložila, že dlouhodobá léčba siponimodem je spojena s dobrou bezpečností a setrvalým prospěchem, co se týče počtu relapsů, fyzické a kognitivní disability a nálezů na magnetické rezonanci (MRI) [1]. Ve srovnání se základní studií (medián 21 měsíců) se v průběhu dlouhodobé léčby snižuje počet relapsů a objem lézí na MRI a zmírňuje se mozková atrofie. Pacienti, kteří byli siponimodem léčeni bez přerušení (časné zahájení léčby), měli lepší výsledky včetně parametrů kognitivní a fyzické disability než nemocní převedení z placeba na léčbu siponimodem (pozdější zahájení léčby). Zpoždění léčby tedy podle těchto výsledků vede k nevratné disabilitě nemocných. Siponimod byl pacienty velmi dobře tolerován, a to i v případě starší a více postižené populace.
Analýza více než pětiletých dat studie EXPAND a její extenze doložila, že dlouhodobá léčba siponimodem je spojena s dobrou bezpečností a setrvalým prospěchem, co se týče počtu relapsů, fyzické a kognitivní disability a nálezů na magnetické rezonanci (MRI) [1]. Ve srovnání se základní studií (medián 21 měsíců) se v průběhu dlouhodobé léčby snižuje počet relapsů a objem lézí na MRI a zmírňuje se mozková atrofie. Pacienti, kteří byli siponimodem léčeni bez přerušení (časné zahájení léčby), měli lepší výsledky včetně parametrů kognitivní a fyzické disability než nemocní převedení z placeba na léčbu siponimodem (pozdější zahájení léčby). Zpoždění léčby tedy podle těchto výsledků vede k nevratné disabilitě nemocných. Siponimod byl pacienty velmi dobře tolerován, a to i v případě starší a více postižené populace.
Úvod
Siponimod představuje první chorobu modifikující terapii, která u pacientů se sekundárně progresivní formou roztroušené sklerózy (SP RS) na základě výsledků studie fáze III EXPAND významně redukuje progresi disability a zhoršení rychlosti zpracování kognitivních informací, navíc zmírňuje zánětlivou aktivitu onemocnění [2]. Probíhající část extenze studie EXPAND je zaměřena na hodnocení dlouhodobé účinnosti a bezpečnosti léčby siponimodem a na porovnání efektu časně a pozdně zahájené léčby u pacientů se SP RS.
Uspořádání studie
Základní část multicentrické randomizované, dvojitě zaslepené, placebem kontrolované studie fáze III EXPAND hodnotila účinnost a bezpečnost léčby siponimodem oproti placebu u pacientů se SP RS (N = 1 651) při mediánu trvání klinického hodnocení 21 měsíců (0,2–37,0 měsíce) [2]. Doba sledování před přechodem do otevřené extenze se lišila u jednotlivých pacientů a pohybovala se v rozmezí zhruba 12–37 měsíců. Pacienti, kteří v základní části studie dostávali siponimod v dávce 2 mg/kg, pokračovali v extenzi v této léčbě. Nemocní z placebové skupiny byli v rámci extenze převedeni na siponimod v dávce 2 mg/kg. Studijní lék byl zveřejněn až po odslepení základní části studie. Datum cut off pro analýzu základní části studie a extenze bylo stanoveno na 6. dubna 2019, kdy většina pacientů dosáhla nejméně 36. měsíce extenze. Průměrná doba trvání/medián trvání činily v rámci analýzy pro v
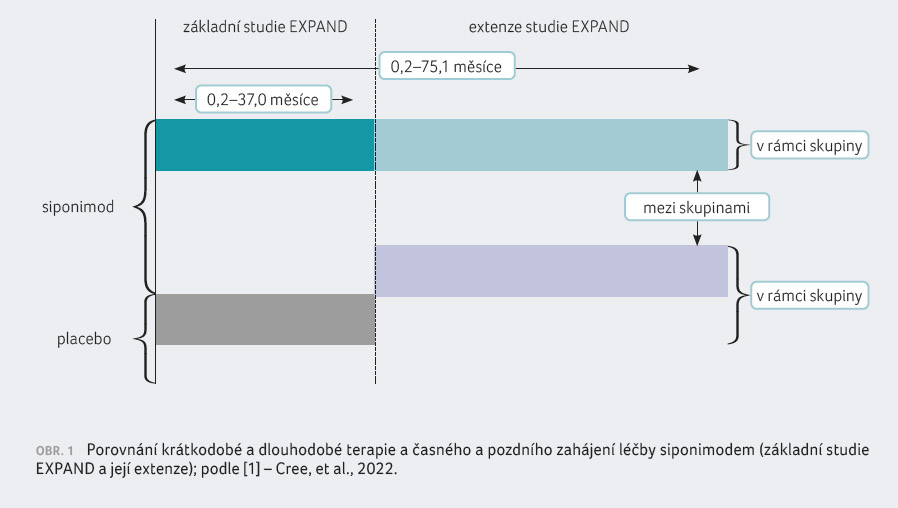
šechny pacienty (s ohledem na různě dlouhou dobu sledování v základní části studie) 45,1/53,1 měsíce (0,2–75,1 měsíce), obrázek 1 [1].
Cílové ukazatele
Čas do šestiměsíční potvrzené progrese disability (confirmed disability progression, CDP), který vycházel ze skóre na škále disability (Expanded Disability Status Scale, EDSS), byl hodnocen při vstupu do základní části studie a poté každé tři měsíce, v rámci extenze v prvním roce a poté každých šest měsíců. Čas do šestiměsíčního potvrzeného významného zhoršení (≥ 4 body) rychlosti kognitivního zpracování informací (cognitive processing speed, CPS) byl hodnocen pomocí nástroje Symbol Digit Modalities Test (SDMT) při vstupu a poté každých šest měsíců v základní části i extenzi studie. Ukazatel ročního počtu relapsů (annualized relapse rate, ARR) byl hodnocen u potvrzených relapsů. Vyšetření na MRI zahrnovalo: měření objemu mozku, kortikální šedé hmoty a objemu thalamu; změnu v objemu T2 lézí; průměrný kumulativní počet nových/rozšiřujících se T2 lézí, které byly v základní části hodnoceny ročně, v extenzi po jednom roce a poté po dvou letech. Z důvodu bezpečnosti starších pacientů při expozici gadoliniu a kvůli nízké užitečnosti doplňujících dat (kromě počtu nových/rozšiřujících se T2 lézí) nebyl v extenzi měřen počet T1 lézí vychytávajících gadolinium (Gd+).
Analýza bezpečnosti léčby shrnula nejčastěji se vyskytující nežádoucí účinky a nežádoucí účinky zvláštního zájmu u pacientů, kteří dostali nejméně jednu dávku siponimodu během základní části nebo extenze studie.
Analýza podskupin
Ukazatele CDP a potvrzeného kognitivního zhoršení (confirmed cognitive worsening, CCW) byly hodnoceny v podskupinách pacientů s aktivní SP RS (relapsy ve dvou letech před screeningem do základní studie a/nebo jedna T1 Gd+ léze při vstupu do základní studie) [2] a u pacientů se SP RS bez aktivity choroby (bez relapsů dva roky před zařazením do studie a žádné Gd+ léze při vstupu do základní studie) [3]. Rovněž MRI parametry byly měřeny u podskupiny s aktivním i s neaktivním onemocněním [4].
Výsledky
Z celkem 1 651 pacientů randomizovaných do základní studie EXPAND jich 1 220 vstoupilo do otevřené extenze a bylo léčeno siponimodem (821 osob pokračovalo v léčbě siponimodem, 399 přešlo z placeba na léčbu siponimodem). K datu cut off v dubnu 2019 celkem 316 (25,9 %) pacientů, kteří vstoupili do extenze, přerušilo léčbu. V extenzi pokračovalo a 36. měsíce léčby dosáhlo 593 (72,2 %) osob kontinuálně léčených siponimodem a 285 (71,4 %) osob, které přešly z placeba na siponimod. Podskupina s aktivní SP RS zahrnula 782 pacientů, kteří byli randomizováni v základní studii, a 582 z extenze. V podskupině s neaktivní SP RS to bylo 830, resp. 612 pacientů. Demografické charakteristiky a charakteristiky onemocnění u pacientů byly při vstupu do základní studie a do extenze srovnatelné [1].
Šestiměsíční potvrzená progrese disability
V případě celkové studijní
populace bylo riziko šestiměsíční CDP na EDSS významně
redukováno u 22 % pacientů kontinuálně léčených
siponimodem ve srovnání s těmi, kteří byli
na siponimod převedeni z placeba (poměr rizik [HR] 0,78;
95% interval spolehlivosti [CI] 0,66–0,92; p = 0,0026),
graf 1 [1]. Mediánu času do šestiměsíční CDP
nebylo dosaženo ve skupině pacientů kontinuálně léčených
siponimodem a ve skupině placebo siponimod činil
51,7 měsíce. Ve skupině pacientů kontinuálně léčených
siponimodem bylo zaznamenáno 55% zpoždění v šestiměsíční
CDP pro 25. percentil oproti skupině placebo siponimod.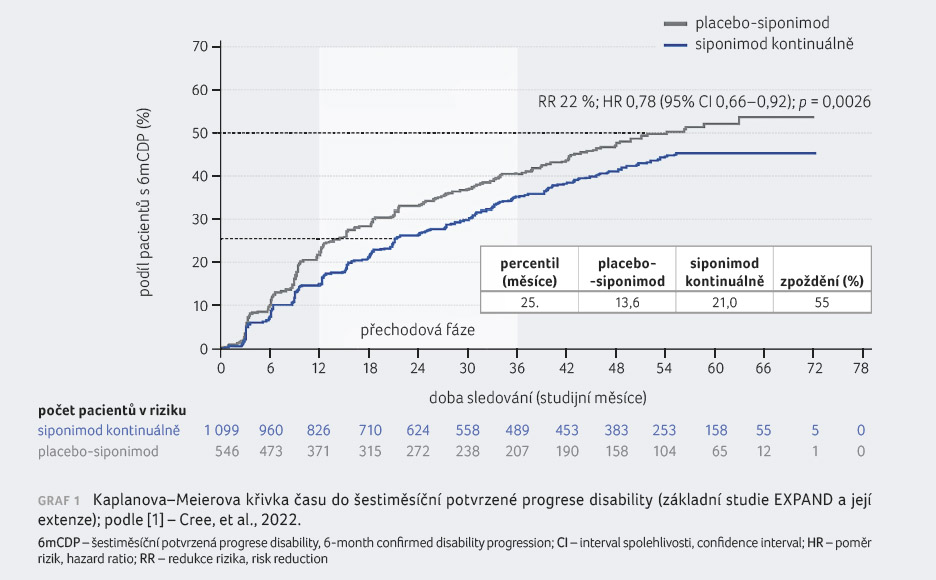
V podskupině s aktivní SP RS bylo riziko šestiměsíční CDP sníženo u 29 % pacientů (HR 0,71; 95% CI 0,57–0,90; p = 0,0044) kontinuálně léčených siponimodem oproti pacientům převedeným z placeba na siponimod. Mediánu času do šestiměsíční CDP nebylo dosaženo ve skupině pacientů kontinuálně léčených siponimodem a ve skupině placebo siponimod činil 48,0 měsíce. Ve skupině pacientů kontinuálně léčených siponimodem bylo zaznamenáno více než 75% zpoždění v šestiměsíční CDP pro 25. percentil oproti skupině placebo siponimod. U nemocných s neaktivní SP RS bylo riziko šestiměsíční CDP nesignifikantně sníženo ve 12,5 % (HR 0,88; 95% CI 0,691,11) a čas do šestiměsíční CDP pro 25. percentil byl prodloužen průměrně o 36 % ve skupině osob kontinuálně léčených siponimodem oproti skupině placebo siponimod (21,0 měsíce vs. 15,4 měsíce). Čas do progrese byl ve skupině placebo siponimod o 28 % delší u pacientů s neaktivní SP RS v porovnání s podskupinou s aktivní SP RS (15,4 měsíce vs. 12,0 měsíce ve 25. percentilu).
Šestiměsíční potvrzené kognitivní zhoršení
V případě celkové studijní
populace bylo riziko šestiměsíčního CCW v CPS redukováno
u 23 % pacientů kontinuálně léčených siponimodem
ve srovnání s těmi, kteří byli na siponimod
převedeni z placeba (HR 0,77; 95% CI 0,65–0,92; p = 0,0047),
graf 2 [1]. Mediánu šestiměsíčního CCW nebylo dosaženo
ani ve skupině pacientů kontinuálně léčených siponimodem,
ani ve skupině placebo siponimod; bylo zaznamenáno > 60%
zpoždění v CCW pro 25. percentil ve skupině
pacientů kontinuálně léčených siponimodem oproti skupině
placebo siponimod.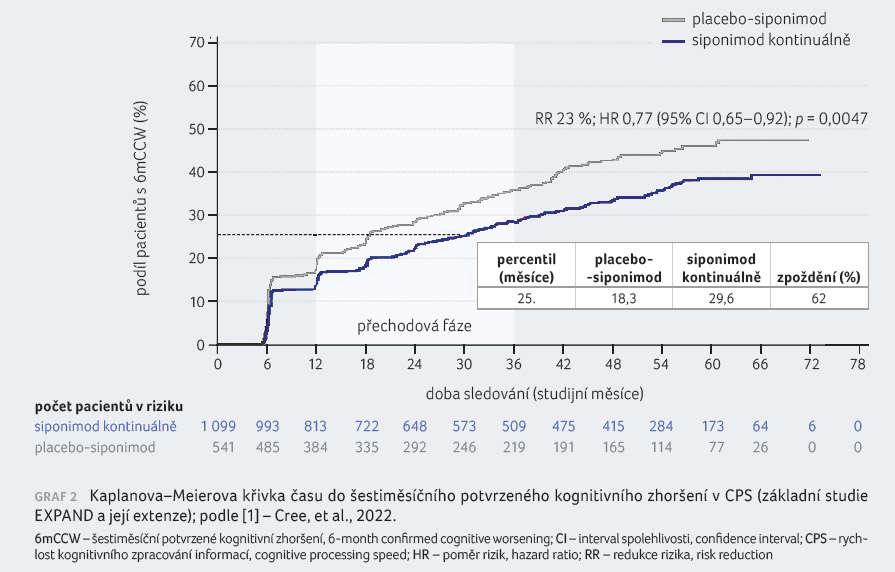
V podskupině s aktivní SP RS bylo riziko šestiměsíční CCW redukováno u 33 % pacientů (HR 0,67; 95% CI 0,53–0,86; p = 0,0044) kontinuálně léčených siponimodem oproti pacientům převedeným z placeba na siponimod. Mediánu šestiměsíční CCW nebylo dosaženo ve skupině pacientů kontinuálně léčených siponimodem a ve skupině placebo siponimod činil 55,5 měsíce. Ve skupině pacientů kontinuálně léčených siponimodem bylo zaznamenáno 45% zpoždění v šestiměsíční CCW pro 25. percentil oproti skupině placebo siponimod. U nemocných s neaktivní SP RS bylo riziko šestiměsíční CCW nesignifikantně sníženo ve 12,3 % (HR 0,88; 95% CI 0,68–1,14) a čas do šestiměsíční CCW pro 25. percentil byl prodloužen průměrně o 17 % ve skupině osob kontinuálně léčených siponimodem oproti skupině placebo siponimod (30,4 měsíce vs. 26,0 měsíce). Čas do kognitivního zhoršení byl ve skupině placebo siponimod o 49 % delší u pacientů s neaktivní SP RS v porovnání s podskupinou s aktivní SP RS (26,0 měsíce vs. 17,4 měsíce ve 25. percentilu).
Roční počet relapsů
V základní části studie společně s její extenzí došlo ke statisticky významné redukci ARR (52 %; p < 0,0001) u pacientů kontinuálně léčených siponimodem oproti skupině placebo siponimod (graf 3A, B) [1].
Při srovnání základní studie oproti extenzi nastal v parametru ARR u pacientů původně randomizovaných k podávání placeba očeká
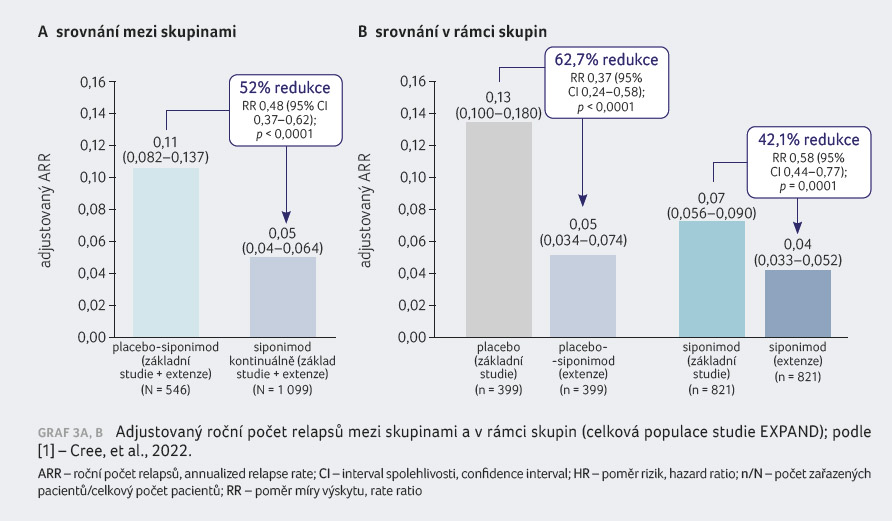
vaný pokles z 0,13 na 0,05 po převedení na siponimod – redukce 62,7 % (poměr četnosti výskytu [RR] 0,37; 95% C
I 0,24–0,58; p < 0,0001). U pacientů původně randomizovaných k podávání siponimodu parametr dále klesal z 0,07 v základní studii na 0,04 v extenzi – redukce 42,1 % (RR 0,58; 95% CI 0,44–0,77; p = 0,0001).
Vyšetření magnetickou rezonancí
V rámci meziskupinového srovnání byla po 60 měsících sledování zaznamenána redukce rozsahu ztráty celkového mozkového objemu (kumulativní procentuální změna oproti výchozí hodnotě: –1,62 % vs. –1,76 %; p < 0,05) a ztráty objemu thalamu (kumulativní procentuální změna oproti výchozí hodnotě: –2,68 % vs. –3,48 %; p < 0,0001) pro skupinu pacientů kontinuálně léčených siponimodem v porovnání se skupinou placebo siponimod. Přechod na siponimod v počátku extenze snížil ztrátu objemu kortikální šedé hmoty na takový rozsah, že do 60. měsíce už nebyl zaznamenán signifikantní rozdíl mezi skupinami v kumulativní ztrátě objemu kortikální šedé hmoty (–1,42 % vs. –1,43 %) [1]. Změna oproti výchozí hodnotě v objemu T2 lézí a kumulativní počet nových/rozšiřujících se T2 lézí byly rovněž významně redukovány u pacientů kontinuálně léčených siponimodem oproti pacientům ve skupině placebo siponimod po 60 měsících sledování (326 mm3 vs. 870 mm3, resp. 3,4 léze vs. 9,3 léze; pro obě hodnoty p < 0,0001) [1]. Průměrný počet nových/rozšiřujících se T2 lézí od poslední kontroly byl podobný mezi skupinou pacientů placebo siponimod a pacientů kontinuálně léčených siponimodem po přechodu na siponimod.
V rámci porovnání došlo u pacientů, kteří přešli na aktivní léčbu, k výrazné redukci v roční míře mozkové atrofie (annualized rate of brain atrophy, ARBA) pro celý mozek (58,1 %), kortikální šedou kůru (85,4 %) a thalamus (58,3 %; všechny hodnoty p < 0,0001). Roční změna oproti výchozí hodnotě v objemu T2 lézí a kumulativní počet nových/rozšiřujících se T2 lézí činily v této skupině 94,3 %, resp. 72,8 % (p < 0,0001). Kompletní potlačení atrofie kortikální šedé hmoty a vzestupu objemu T2 lézí byly doloženy v rámci prvních 12 měsíců přechodu z placeba na siponimod (měsíce 0–12 v extenzi).
Ve skupině pacientů kontinuálně léčených siponimodem byla potvrzena další redukce ARBA, pravděpodobně v souvislosti s nárůstem účinnosti léčby na mozkovou atrofii, a další redukce vzniku nových/rozšiřujících se T2 lézí a téměř kompletní potlačení zvyšování objemu T2 lézí.
Bezpečnost léčby
Nejčastěji se vyskytující nežádoucí účinky zaznamenané v dlouhodobé analýze byly v souladu s nežádoucími účinky v základní studii a nedošlo ke zvýšení míry incidence přizpůsobené expozici (incidence rate, IR/100 pacientoroků) během expozice siponimodu (≥ 36 měsíců). Vzorek nejčastěji se vyskytujících závažných nežádoucích účinků hlášených u 463 pacientů (30,5 %; IR 10,9/100 pacientoroků) byl rovněž konzistentní se základní studií. Tento vzorek byl také shodný s nežádoucími účinky vedoucími k přerušení léčby siponimodem u 179 pacientů (11,8 %; IR 3,6/100 pacientoroků). Příčiny 16 úmrtí u pacientů léčených siponimodem (4 v základní studii a 12 v extenzi) od začátku studie po dobu delší než pět let byly heterogenní, bez vztahu ke konkrétnímu orgánovému systému. U pacientů s aktivní SP RS byl profil nežádoucích účinků ve stejném období v souladu s celkovou populací.
V období od základní studie do pěti let léčby siponimodem nedošlo ani k neočekávanému vzestupu IR přizpůsobené expozici u nežádoucích účinků zvláštního zájmu. Malignity byly hlášeny u 5,1 % pacientů léčených siponimodem (78 osob; IR 1,6/100 pacientoroků; 95% CI 1,2–2,0) v průběhu dlouhodobého sledování v porovnání s 1,9 % (21 osob; IR 1,2/100 pacientoroků; 95% CI 0,8–1,9) v průběhu základní studie. Nárůst IR v případě bazocelulárního karcinomu byl pozorován v extenzi, avšak výskyt jiných nežádoucích účinků zvláštního zájmu (bradyarytmie při zahájení terapie, hypertenze, virus varicella zoster) byl konzistentní se základní studií. Nebyly zaznamenány žádné případy progresivní multifokální leukoencefalopatie a byl potvrzen pouze jeden případ kryptokokové meningitidy hlášený v rámci extenze. Dlouhodobá léčba siponimodem po dobu více než pěti let tedy nepřinesla nové neočekávané bezpečnostní signály této terapie.
Závěr
Setrvalá klinická účinnost a konzistentní bezpečnostní profil potvrzují klinický prospěch dlouhodobé léčby siponimodem u pacientů se SP RS. Přetrvávající rozdíly v klinických a MRI parametrech mezi pacienty léčenými siponimodem kontinuálně a těmi, kteří k ní přešli po podávání placeba, zvýrazňují význam časnějšího zahájení léčby.
Redakčně zpracovala PhDr. Nikola Homolová Richtrová
Seznam použité literatury
- [1] Cree BAC, Arnold DL, Fox RJ, et al. Long‑term efficacy and safety of siponimod in patients with secondary progressive multiple sclerosis: Analysis of EXPAND core and extension data up to > 5 years. Mult Scler J 2022; 28: 1591–1605.
- [2] Kappos L, Bar‑Or A, Cree BAC, et al. Siponimod versus placebo in secondary progressive multiple sclerosis (EXPAND): A double‑blind, randomised, phase 3 study. Lancet 2018; 391: 1263–1273.
- [3] Lublin FD, Reingold SC, Cohen JA, et al. Defining the clinical course of multiple sclerosis: The 2013 revisions. Neurology 2014; 83: 278–286.
- [4] Arnold DL, Piani Meier D, Bar‑Or A, et al. Effect of siponimod on magnetic resonance imaging measures of neurodegeneration and myelination in secondary progressive multiple sclerosis: Gray matter atrophy and magnetization transfer ratio analyses from the EXPAND phase 3 trial. Mult Scler J 2022; 28: 1526–1540.