Efekt léčby okrelizumabem na postvakcinační odpověď u pacientů s roztroušenou sklerózou – klinická studie VELOCE
Infekční onemocnění mohou vést k rozvoji relapsu a ke zhoršení příznaků roztroušené sklerózy (RS), na druhé straně představuje náchylnost k infekčním onemocněním známou komplikaci (nežádoucí účinek) některých modalit léčby RS. Vakcinace patří u imunitně zprostředkovaných onemocnění mezi diskutované otázky jednak z důvodu potenciálních rizik a na straně druhé z důvodu dostatečné účinnosti očkování.
Okrelizumab, humanizovaná monoklonální protilátka cílící selektivně na B buňky exprimující antigen CD20, je schválena k léčbě relabující a primárně progresivní RS. Léčba vede k depleci CD20+ B buněk, nicméně zachovává schopnost jejich rekonstituce a již existující humorální imunitu. Od srpna 2019 zahájilo léčbu okrelizumabem celosvětově více než 120 000 pacientů (v rámci klinických studií i po schválení přípravku do klinické praxe). Hodnocení sledující efekt léčby okrelizumabem na postvakcinační odpověď doposud nebyla uskutečněna. To si dala za cíl multicentrická otevřená studie fáze IIIb VELOCE (A Study to Evaluate the Effects of Ocrelizumab on Immune Responses in Participants With Relapsing Forms of Multiple Sclerosis; NCT02545868), která hodnotila účinnost očkování vybranými vakcínami u pacientů s relabující RS léčených okrelizumabem [1].
Metodika
Do studie byli v období mezi
říjnem 2015 až srpnem 2016 zařazeni dospělí pacienti
s relabující formou RS (míra postižení dle Expanded
Disability Status Scale 0−5,5) ve věku 18−55 let. Bližší
charakteristiky zařazených uvádí tabulka 1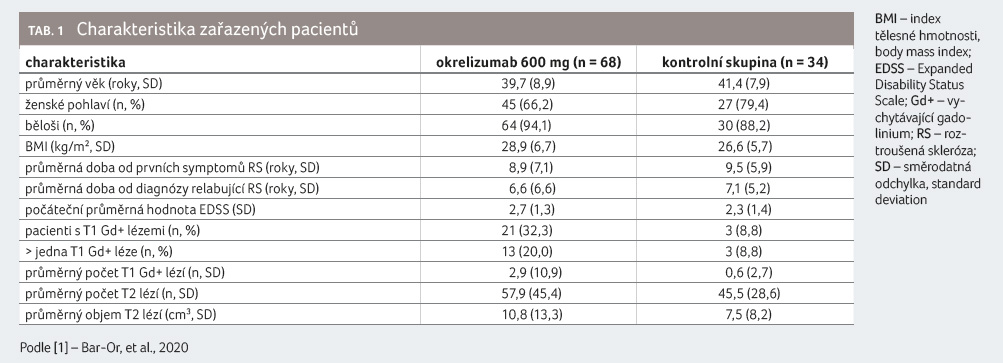 . Vyloučeni
byli při screeningu pacienti imunizovaní v průběhu
posledních dvou let vakcínou obsahující tetanický toxoid (TT;
očkování proti tetanu, záškrtu a dávivému kašli),
v posledních pěti letech 23valentní polysacharidovou
pneumokokovou vakcínou (23 PPV), vakcínou proti sezonní
chřipce doporučenou pro období 2015/2016 nebo 2016/2017 nebo ti,
kteří dostali KLH (keyhole limpet hemocyanin), látku používanou
jako tzv. neoantigen, se kterým se testovaný člověk neměl šanci
setkat.
. Vyloučeni
byli při screeningu pacienti imunizovaní v průběhu
posledních dvou let vakcínou obsahující tetanický toxoid (TT;
očkování proti tetanu, záškrtu a dávivému kašli),
v posledních pěti letech 23valentní polysacharidovou
pneumokokovou vakcínou (23 PPV), vakcínou proti sezonní
chřipce doporučenou pro období 2015/2016 nebo 2016/2017 nebo ti,
kteří dostali KLH (keyhole limpet hemocyanin), látku používanou
jako tzv. neoantigen, se kterým se testovaný člověk neměl šanci
setkat.
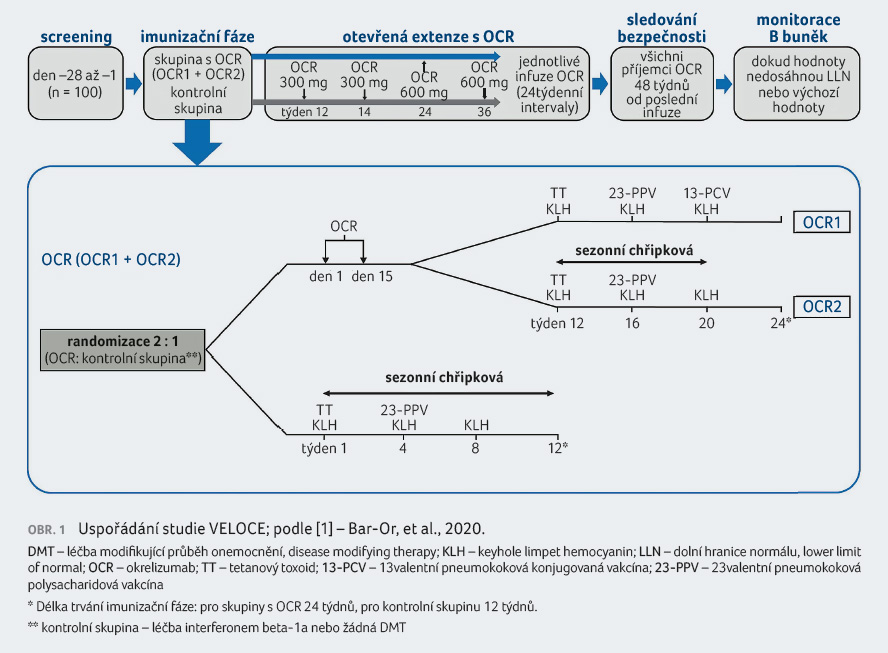 Pacienti byli po úvodním
screeningu randomizováni v poměru 2 : 1 do skupiny
léčené okrelizumabem (s úvodním podáním dvou infuzí
300 mg okrelizumabu v odstupu 14 dnů) nebo do kontrolní
skupiny, v níž pacienti buď pokračovali v aktuální
léčbě interferonem, u které je doložena absence vlivu
na postvakcinační odpověď [2−5], nebo nedostávali žádnou
léčbu modifikující onemocnění (disease modifying therapy, DMT).
Ve skupině s okrelizumabem byli účastníci studie dále
rozděleni do skupiny OCR1 a OCR2 podle toho, jestli dále
dostali 13valentní konjugovanou pneumokokovou vakcínu (13 PCV),
booster 23 PPV (skupina OCR1), nebo vakcínu proti chřipce
doporučenou na severní polokouli pro sezony 2015/2016 nebo
2016/2017 (skupina OCR2). Uspořádání studie popisuje obrázek 1.
Pacienti byli po úvodním
screeningu randomizováni v poměru 2 : 1 do skupiny
léčené okrelizumabem (s úvodním podáním dvou infuzí
300 mg okrelizumabu v odstupu 14 dnů) nebo do kontrolní
skupiny, v níž pacienti buď pokračovali v aktuální
léčbě interferonem, u které je doložena absence vlivu
na postvakcinační odpověď [2−5], nebo nedostávali žádnou
léčbu modifikující onemocnění (disease modifying therapy, DMT).
Ve skupině s okrelizumabem byli účastníci studie dále
rozděleni do skupiny OCR1 a OCR2 podle toho, jestli dále
dostali 13valentní konjugovanou pneumokokovou vakcínu (13 PCV),
booster 23 PPV (skupina OCR1), nebo vakcínu proti chřipce
doporučenou na severní polokouli pro sezony 2015/2016 nebo
2016/2017 (skupina OCR2). Uspořádání studie popisuje obrázek 1.
Ačkoliv výrazná deplece B buněk je patrná brzy po zahájení léčby anti CD20, nebyli pacienti ve skupině léčené okrelizumabem očkováni dříve než po 12 týdnech léčby, aby nedošlo k možnému ovlivnění výsledků. Pacienti zařazení v kontrolní skupině byli naopak očkováni ihned po randomizaci, aby jim bylo umožněno případně pokračovat do otevřené extenze studie nebo započít jinou DMT.
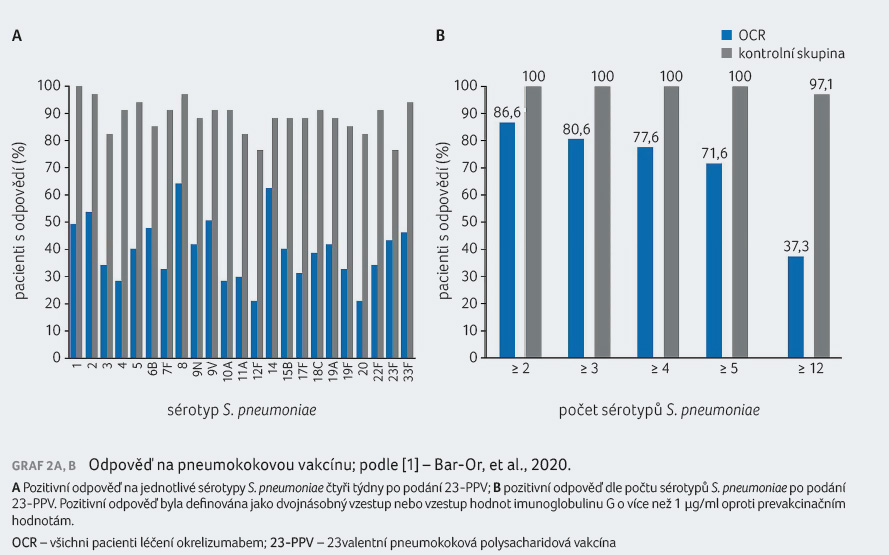
Primárním cílovým ukazatelem studie byl podíl pacientů s pozitivní odpovědí na posilující vakcínu (booster) obsahující TT po osmi týdnech po vakcinaci. Pozitivní odpověď na vakcínu byla definována jako titr protilátek (anti TT IgG) ≥ 0,2 IU/ml u pacientů s prevakcinačním titrem < 0,1 IU/ml nebo čtyřnásobný či vyšší vzestup titru protilátek u pacientů s prevakcinačním titrem protilátek ≥ 0,1 IU/ml. Sekundárním cílovým ukazatelem byla odpověď na vakcínu obsahující TT čtyři týdny po vakcinaci (definována obdobně, jen u osob s prevakcinačním titrem protilátek ≥ 0,1 IU/ml za odpověď považován dvojnásobný a vyšší vzestup titru protilátek po vakcinaci). Dalšími sekundárními cílovými ukazateli byly: odpověď na vakcínu 23 PPV čtyři týdny po vakcinaci a na 23 PPV posílenou vakcínou 13 PCV čtyři týdny po očkování 13 PCV. Za pozitivní odpověď byl považován dvojnásobek titru sérotypově specifických protilátek (IgG) nebo jeho vzestup o více než 1 µg/ml oproti prevakcinačnímu titru.
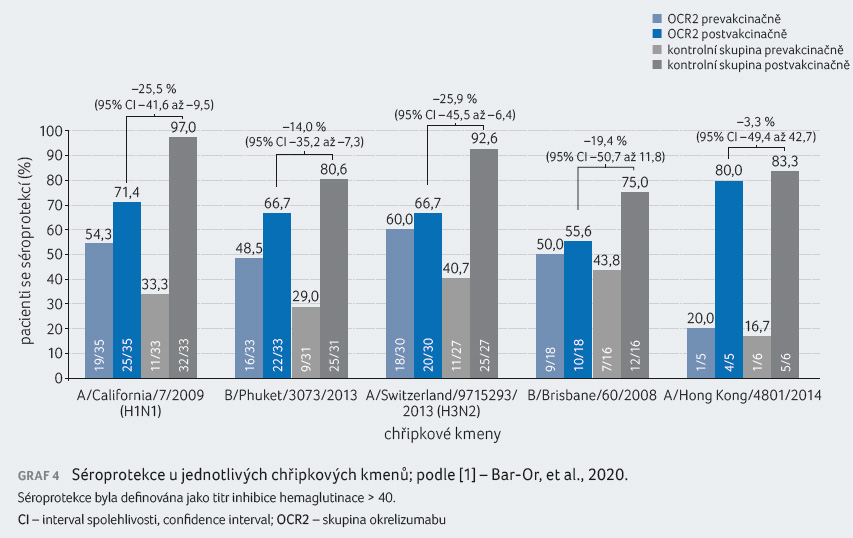
Dále byly hodnoceny průměrné titry protilátek anti KLH (IgG a IgM) za 4, 8 a 12 týdnů po podání KLH a séroprotekce vs. sérokonverze u vakcíny proti sezonní chřipce čtyři týdny po očkování.
Výsledky
Cílem této intervenční studie bylo primárně zjistit, zda u pacientů s relabující RS léčených okrelizumabem došlo k vytvoření odpovědi na vybrané vakcíny. Randomizováno bylo celkem 102 pacientů (68 do skupiny s léčbou okrelizumabe
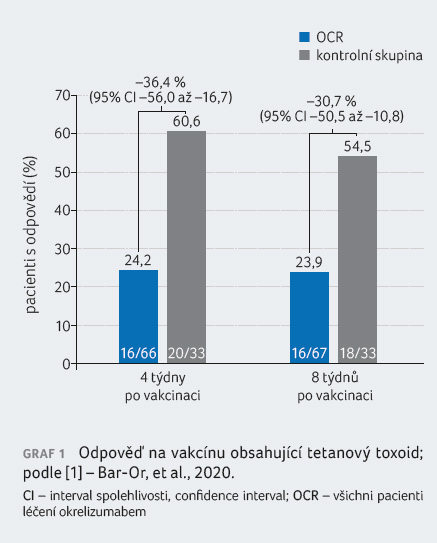
m, 34 do kontrolní skupiny). Všichni pacienti absolvovali fázi imunizace a pokračovali dále do fáze extenze s okrelizumabem. Většina pacientů nedostávala žádnou předchozí DMT (ve skupině s okrelizumabem 54 %, v kontrolní skupině 68 %). Nejčastěji užívanou předchozí DMT byly interferon beta 1a a glatiramer acetát. Dvanáct pacientů (35 %) randomizovaných do kontrolní skupiny bylo v průběhu imunizační periody léčeno interferonem beta 1a.
Průměrný počet CD19+ B buněk na počátku sledování byl ve skupinách s okrelizumabem 242 buněk/µl, v kontrolní skupině 205 buněk/µl. V průběhu dvou týdnů došlo ve skupině s okrelizumabem k téměř kompletní depleci (průměrně 0,6 buněk/µl) a u většiny pacientů tento stav setrvával do týdne 24 (průměrně 11 buněk/µl).
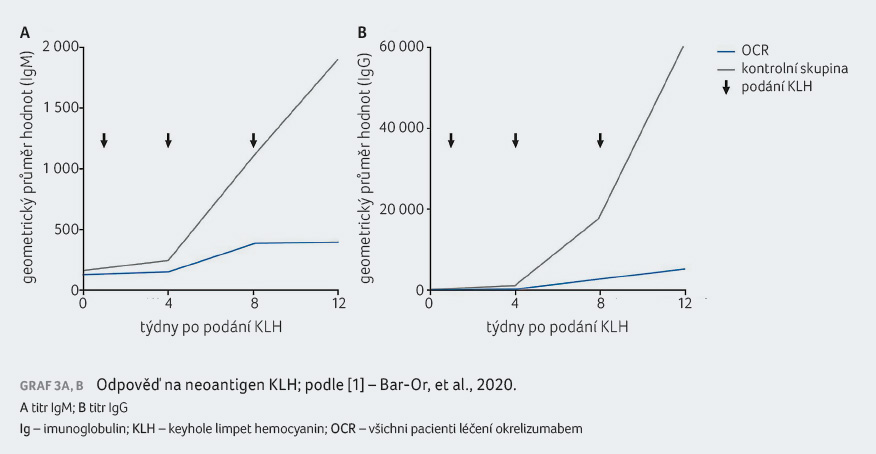
Klinické hodnocení poskytlo důkaz třídy II, že u pacientů s periferní deplecí B buněk v důsledku léčby okrelizumabem došlo po vakcinaci k vytvoření atenuované humorální odpovědi na klinicky relevantní vakcí
Výsledky studie doplňují předchozí
postřehy z hodnocení fáze III dokládající, že u pacientů
léčených okrelizumabem zůstává preexistující humorální
imunita proti běžným virovým a bakteriálním antigenům
zachována [6].ny
a neoantigen KLH. Použití neživých vakcín v průběhu léčby okrelizumabem je proto ke zvážení. V případě vakcíny proti sezonní chřipce je očkování při léčbě okrelizumabem doporučeno, protože potenciálně protektivní humorální odpověď, byť atenuovanou, lze očekávat.
Živé vakcíny nebyly zkoumány, jejich použití není z důvodu rizika reaktivace v průběhu léčby a do obnovení populace B buněk doporučeno.
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Bar‑Or A, Calkwood JC, Chognot C, et al. Effect of ocrelizumab on vaccine responses in patients with multiple sclerosis: The VELOCE study. Neurology 2020; 95: e1999–e2008.
- [2] Schwid SR, Decker MD, Lopez‑Bresnahan M; Rebif‑Influenza Vaccine Study Investigators. Immune response to influenza vaccine is maintained in patients with multiple sclerosis receiving interferon beta‑1a. Neurology 2005; 65: 1964–1966.
- [3] Olberg HK, Cox RJ, Nostbakken JK, et al. Mmunotherapies influence the influenza vaccination response in multiple sclerosis patients: an explorative study. Mult Scler 2014; 20: 1074–1080.
- [4] Mehling M, Fritz S, Hafner P, et al. Preserved antigen‑specific immune response in patients with multiple sclerosis responding to IFNbeta‑therapy. PLoS One 2013; 8: e78532.
- [5] Olberg HK, Eide GE, Cox RJ, et al. Antibody response to seasonal influenza vaccination in patients with multiple sclerosis receiving immunomodulatory therapy. Eur J Neurol 2018; 25: 527–534.
- [6] Bar‑Or A, Arnold DL, Comi G, et al. Effect of ocrelizumab on humoral immunity markers in the phase iii, double‑blind, double‑dummy, interferon β‑1a–controlled OPERA I and OPERA II studies. Poster DX12 presented at 2016 Annual Meeting of the Consortium of Multiple Sclerosis Centers (CMSC); June 1–4, 2016; National Harbor, MD. Presentation available at: cmsc.confex.com/…/2016/webprogram/Handout/Paper4280/DX12.pdf. Accessed December 2019.