Efekt osimertinibu a multimodální přístup v léčbě pacienta s nemalobuněčným karcinomem plic s pozitivní mutací genu EGFR
Souhrn:
Bratová M. Efekt osimertinibu a multimodální přístup v léčbě pacienta s nemalobuněčným karcinomem plic s pozitivní mutací genu EGFR. Remedia 2021; 31: 236–240.
Karcinom plic je na smutné první příčce, co se týče mortality na nádorová onemocnění. Ačkoliv u valné většiny nemocných představuje hlavní rizikový faktor kouření, u části pacientů spočívá odstartování kancerogeneze v molekulárně‑genetických změnách. Autorka předkládá kazuistiku nemocného, u něhož došlo k recidivě nemalobuněčného karcinomu plic s pozitivní mutací EGFR a který velmi dobře profitoval z podávání osimertinibu ve vyšší linii léčby. Významnou roli hrál také multimodální přístup při vedení onkologické léčby tohoto nemocného.
Summary:
Bratova M. Effect of osimertinib and multimodal approach in the treatment of a patient with non‑small cell lung cancer with a positive mutation of the EGFR gene. Remedia 2021; 31: 236–240.
Lung cancer is a leading cause of death among other oncological diseases. Although the main risk factor is still smoking, in some patients molecular‑genetic changes are drivers of the carcinogenicity. Author describes a case report of a patient with a relapse of EGFR‑positive non‑small cell lung cancer who experienced a clear benefit from osimertinib in further line of treatment. Multimodality of the oncological treatment also played an important role in the therapy of this patient.
Key words: non‑small cell lung cancer, EGFR mutation, resistance, osimertinib
Úvod
Karcinom plic lze považovat za nejvíce smrtící onkologickou diagnózu vůbec [1]. V roce 2017 zemřelo v České republice na 5 300 osob na nádory plic a průdušnice [1]. Jedná se o celých 20 % všech úmrtí na nádorová onemocnění [1]. Na druhou stranu je tento smutný fakt významnou pobídkou ke stále se zlepšující precizní patologické a molekulárně genetické diagnostice, k novým léčebným přístupům (ať už ve smyslu zcela nových látek, či jejich kombinací) a v neposlední řadě k neutuchající debatě o screeningu karcinomu plic.
Ačkoliv hlavním hnacím motorem kancerogeneze zhoubných nádorů plic je bez debat kouření [2], část těchto malignit je způsobena změnami na úrovni protoonkogenů v buňce. Ty vedou k dysregulaci konkrétní signální dráhy, jejímž důsledkem je spuštění procesu kancerogeneze [3]. Tak je tomu i v případě nemalobuněčného karcinomu plic (non small cell lung carcinoma, NSCLC) nesoucího mutaci v genu receptoru pro epidermální růstový faktor (epidermal growth factor receptor, EGFR). Konkrétní impulz, který ovšem tuto změnu odstartuje, dosud identifikován nebyl [3].
Výskyt mutací genu EGFR u NSCLC je signifikantně vyšší u histologického typu adenokarcinomu, v asijské populaci, u žen a nekuřáků [4]. Mezi typy mutací EGFR dominují z 80–90 % delece v exonu 19 a bodová mutace L858R v exonu 21 [5]. Z možných cílených přípravků jsou v České republice, ale i ve světě k dispozici léky ze skupiny tyrozinkinázových inhibitorů (TKI) 1. generace (erlotinib, gefitinib), 2. generace (afatinib) a 3. generace (osimertinib). Osimertinib je v našich úhradových podmínkách schválen pro pacienty v dobrém klinickém stavu s NSCLC nesoucím rezistentní mutaci EGFR na exonu 20 T790M. Léčba je vyhrazena pro onemocnění v lokálně pokročilém a metastatickém stadiu, přičemž došlo k selhání předchozí léčby TKI [6].
Nově od 1. 6. 2021 je schválena indikace a stanovena úhrada pro užití osimertinibu v 1. linii onkologické léčby u pokročilého a metastatického NSCLC EGFR pozitivního. Podmínkou je dobrý klinický stav a absence příznaků symptomatických metastáz mozku.
Článek přináší kazuistiku nemocného s recidivou adenokarcinomu plic EGFR pozitivního po radikální plicní resekci, který v průběhu léčby TKI 1. generace vyvinul rezistentní mutaci T790M a následně byl efektivně léčen osimertinibem. U tohoto pacienta byl také úspěšně aplikován multimodální přístup jak kombinací cílené léčby a standardní chemoterapie, tak v léčbě metastatického postižení skeletu. Pacient přežívá od stanovení diagnózy karcinomu plic devět let.
Kazuistika
Pacient, v době diagnózy ve věku 50 let, Asiat žijící dlouhodobě na území České republiky, bývalý kuřák, v osobní anamnéze pouze asthma bronchiale lehkého stupně, byl v říjnu 2012 předán do péče Kliniky nemocí plicních a tuberkulózy FN Brno z rukou chirurga po radikální plicní resekci. U nemocného byla provedena horní lobektomie vpravo s mediastinální lymfadenopatií pro invazivní adenokarcinom grade 2. Dle pooperačního stagingu pT1aN0M0, tedy klinické stadium bylo definováno jako pIA. Adjuvantní chemoterapie nebyla vzhledem k nízkému stadiu nemoci indikována.
Nemocný byl na našem pracovišti dále pečlivě dispenzarizován pneumoonkologem, který v lednu 2015 konstatoval na základě vyšetření pozitronovou emisní tomografií/výpočetní tomografií (PET/CT) recidivu nemoci. Pomocí zobrazovacích metod bylo zjištěno PET aktivní ložisko 8. žebra vpravo s osteolýzou v CT obraze a dále v pravé plíci 4–5 drobných PET aktivních ložisek ve smyslu metastáz. Klinické stadium nemoci bylo IV (7. TNM). V té době došlo také k výraznému nárůstu hodnot nádorových markerů (karcino embryonální antigen, CEA 3,3 IU/ml na 63,7 IU/ml). Solitární postižení žebra vpravo bylo potvrzeno i dle scintigrafie skeletu, další ložiska skeletu nebyla detekována. Bronchoskopický nález byl bez patologie, jen s patrným klidným pahýlem po horní lobektomii vpravo, cytologicky nebyly prokázány maligní buňky. Vzhledem k nálezu jen drobných ložisek pravé plíce nebyla možná histologická reverifikace procesu. Vycházeli jsme tedy z původní histologie nádoru. Z původního resekátu byla doplněna mutační analýza genu pro EGFR, která prokázala deleci v exonu 19. Pacient se nacházel ve velmi dobrém klinickém stavu (performance status 0).
Od února 2015 byla tedy vzhledem k pozitivitě EGFR a klinickému stadiu nemoci zahájena léčba gefitinibem. Ta byla nemocným dobře tolerována. Nejlepší dosaženou léčebnou odpovědí na gefitinib (červenec 2015) byla parciální regrese počtu metastatických ložisek v pravé plíci, nález ve skeletu zůstával stabilní. Po celou dobu probíhala pravidelná léčba kostního postižení bisfosfonáty. Ta však musela být k září 2018 ukončena pro komplikovanou periodontitidu s nutností intervence čelistního chirurga. Pacient si nadále zachovával dobrý klinický stav.
Nicméně v říjnu 2018 byla při
CT vyšetření hrudníku zjištěna jasná progrese nemoci –
došlo k navýšení počtu i velikosti ložisek pravé
plíce, nově byla také patrna patologická lymfadenopatie
paratracheálně vpravo a drobný fluidothorax na téže
straně (obr. 1A, B). Scintigrafií skeletu bylo detekováno
zhoršení metastatického postižení v místě 8. žebra
vpravo a nově i 7. žebra na stejné straně.
Pro obtěžující bolesti v této krajině a intoleranci
opioidů i opiátů byla doplněna analgetická radioterapie
postižených žeber s dobrým klinickým efektem. U nemocného
bylo také doplněno magnetorezonanční (MR) zobrazení mozku
(ve snaze odhalit i další diseminaci), které bylo bez
průkazu metastáz intrakraniálně. Vzhledem k postižení
lymfatických uzlin mezihrudí byla provedena endobronchiální
ultrasonografie (EBUS). Tato metoda potvrdila postižení
lymfatických uzlin buňkami adenokarcinomu a na základě
mutační analýzy tohoto materiálu byla kromě perzistující
delece v exonu 19 zachycena také de novo vzniklá
rezistentní mutace T790M v exonu 20.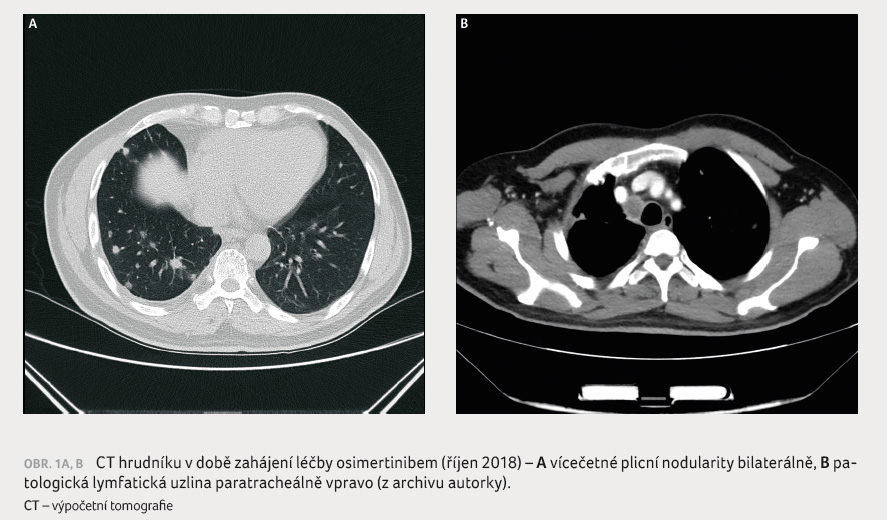
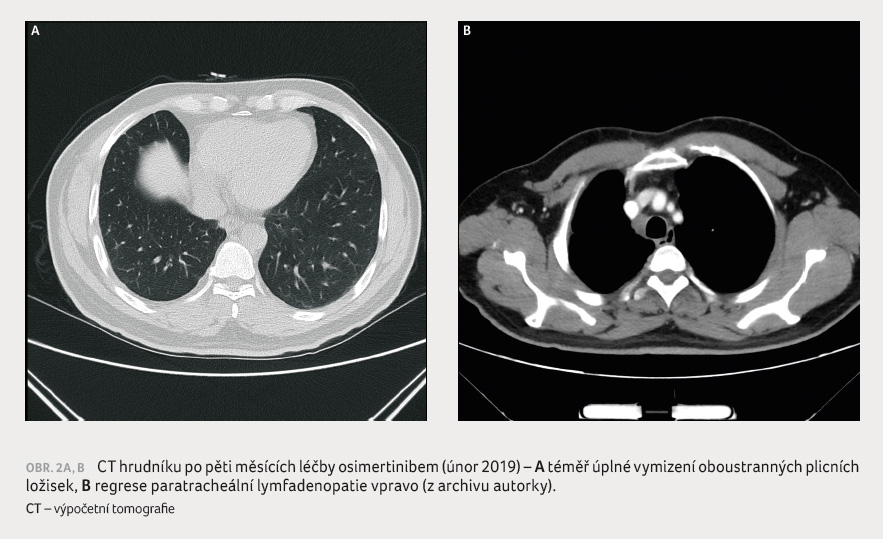
Na základě těchto nových skutečností jsme u pacienta v říjnu 2018 zahájili léčbu osimertinibem ve druhé linii. Nemocný ji bez větších obtíží toleroval. Při této terapii dochází v únoru 2019 k výrazné parciální regresi plicních metastáz i lymfadenopatie (byly patrny pouze fibrózní pruhy v místech po původních plicních ložiscích, obr. 2A, B), nález ve skeletu zůstával beze změn. V květnu 2019 mohla být opět po kontrole čelistním chirurgem zahájena léčba kostních metastáz, tentokrát denosumabem. Efekt osimertinibu trval u nemocného až do října 2020, kdy došlo ke vzniku nového meta ložiska páteře v obratli L5, dále byla patrna i lehká progrese ložiska v S3 pravé plíce. Doplnili jsme tedy paliativní radioterapii na oblast bederní páteře a zároveň zahájili léčbu standardní chemoterapií pemetrexedem v monoterapii.
V době od října 2020 do ledna 2021 bylo podáno celkem pět cyklů antifolátu bez závažnější toxicity. Následně musela být léčba ukončena pro progresi dvou plicních ložisek a vznik objemného pravostranného maligního pleurálního výpotku (ověřeno cytologicky). Od února do března 2021 byl pacient léčen erlotinibem, nicméně dochází k poměrně rychlému zhoršení jak klinického stavu (performance status 1), tak fluidothoraxu vpravo. Byla provedena hrudní drenáž s uspokojivým efektem a zahájena již pátá linie onkologické léčby v kombinaci karboplatina + gemcitabin (duben 2021). Tato léčebná linie nyní stále probíhá a zatím její efekt nelze spolehlivě hodnotit.
Diskuse
Problematika NSCLC nesoucích mutace EGFR je velmi specifická, nesmírně zajímavá a neustále se rozvíjí. Jsou diskutovány inovativní přístupy v léčbě [7–9], zkoumány nové mechanismy vzniku rezistence na TKI [10,11] či nežádoucí účinky této lékové skupiny [12]. Osimertinib – jako TKI nejvyšší generace – je spjat se dvěma zásadními klinickými studiemi – FLAURA a AURA3.
V klinické studii fáze III FLAURA bylo provedeno přímé srovnání efektivity osimertinibu a ostatních TKI (erlotinibu a gefitinibu) u pacientů s pokročilým NSCLC EGFR pozitivním v první linii léčby. Celkem bylo zařazeno 556 pacientů s mutacemi EGFR (delece v exonu 19 a mutace L858R v exonu 21) a randomizováno v poměru 1 : 1 do ramene s osimertinibem a erlotinibem/gefitinibem. V rameni s osimertinibem bylo dosaženo průměrného celkového přežití 38,6 měsíce vs. 31,8 měsíce u kontrolní skupiny (poměr rizik [hazard ratio, HR] 0,8; 95,5% interval spolehlivosti [confidence interval, CI]; p = 0,046) [13]. Toxicita třetího a vyššího stupně byla monitorována u 42 % pacientů léčených osimertinibem vs. 47 % pacientů léčených ostatními TKI [13]. U podskupiny nemocných s prokázanými mozkovými metastázami bylo zaznamenáno výrazné prodloužení doby do progrese (15,2 měsíce vs. 9,6 měsíce, HR 0,47; 95% CI; p = 0,0009). Dle doporučení Evropské společnosti pro klinickou onkologii (European Society for Medical Oncology, ESMO) je osimertinib lékem volby do první linie léčby NSCLC EGFR pozitivních [14]. Od 1. 6. 2021 je tato indikace schválena a hrazena plátci péče i v České republice.
Klinická studie fáze III AURA3 byla zaměřena na srovnání osimertinibu a chemoterapeutického režimu karboplatina + pemetrexed u pacientů s pokročilým NSCLC předléčených TKI, u nichž došlo ke vzniku rezistentní mutace T790M. Na 279 pacientů bylo randomizováno do dvou ramen v poměru 2 : 1. Doba do progrese byla signifikantně delší u nemocných léčených osimertinibem oproti chemoterapii (10,2 měsíce vs. 4,4 měsíce, HR 0,30; 95% CI 0,23–0,41; p < 0,0001) [15]. Celkové přežití pacientů léčených osimertinibem dosáhlo 26,8 měsíce vs. 22,5 měsíce v rameni s karboplatinou + pemetrexedem (HR 0,8; 95% CI 0,67–1,12; p = 0,277) [15]. Nutno poznamenat, že u 73 % nemocných došlo k přestupu (crossover) do ramene s osimertinibem. Z vážnějších nežádoucích účinků (grade 3 a více) dominovaly vyrážka a průjem (32–33 % vs. 1 %) u osimertinibu a nauzea (47 % vs. 3,3 %) pro režim s pemetrexedem.
Naše kazuistika popisuje případ nemocného s velmi dobrou léčebnou odpovědí na osimertinib podávaný ve druhé linii. Doba do progrese byla téměř dvojnásobná oproti té, která je popisována v klinických studiích (24 měsíců vs. 10,2 měsíce). U nemocného byla v době zhoršení nálezu při léčbě TKI verifikována přítomnost rezistentní mutace de novo z cytologických odběrů EBUS. Což jen podtrhuje důležitost detekce aktuálních molekulárně genetických vlastností pacientova nádorového onemocnění, ať už rebiopsií, cytologickým odběrem např. maligního fluidothoraxu, či v podobě tekuté biopsie. Ve strategii onkologické léčby našeho nemocného hrála také významnou roli její multimodalita. A to nejen ve smyslu střídání léčby cílenými přípravky se standardní chemoterapií, ale také použitím paliativní radioterapie na oblast metastatického postižení skeletu, která byla uskutečněna pro dosažení lokální kontroly nemoci celkem dvakrát s velmi dobrým dopadem na kvalitu života pacienta.
Výskyt mutací EGFR u NSCLC je v asijské populaci několikanásobně vyšší nežli v populaci kavkazské (30 % vs. 8 %) [4]. V důsledku globalizace a migrace obyvatel se můžeme běžně setkávat i s nemocnými jiných ras, a tedy i potenciálně jiných epidemiologických charakteristik (např. odlišná incidence molekulárně genetických změn). Zajímavou otázkou může být také přežívání po plicní resekci v závislosti na přítomnosti či absenci molekulárně genetických změn v nádoru. Studie srovnávající pooperační přežití u nemocných pro NSCLC s mutacemi EGFR a bez nich neprokázala rozdíl pro stadia 0 až IA, avšak u stadia IB byla přítomnost mutace EGFR pozitivním prognostickým markerem [16]. Ideálním stavem je jistě histologická reverifikace recidivy nádorového procesu, nicméně ne vždy je zcela možná. V tomto případě může být došetření mutačního statusu ze vzorku původně získaného při resekci nápomocno. Je třeba si ovšem uvědomit, že reflexní testování stavu EGFR probíhá pouze v malých biopsiích; pokud jej chceme stanovit i z resekátu plic, musíme si je jako klinici od patologa vyžádat [17].
Závěr
Osimertinib prokázal efektivitu jak u nemocných s NSCLC EGFR pozitivních v první linii léčby, tak v léčbě rezistence na TKI v důsledku přítomnosti mutace T790M. Stěžejní je adekvátní molekulárně genetická analýza v úvodu nemoci, ale i při progresi při léčbě TKI, ideálně provedená na nově odebraném vzorku. Multimodální přístup v léčbě NSCLC může představovat výhodu ve smyslu zlepšení kvality života nemocného a udržení dlouhodobější kontroly zhoubného onemocnění.
Seznam použité literatury
- [1] Novotvary 2017 ČR, ÚZIS, str. 16. Dostupné na: https://www.uzis.cz/res/f/008318/novotvary2017.pdf, Navštíveno dne 30. 4. 2021.
- [2] Alberg AJ, Brock MV, Ford JG, et al. Epidemiology of lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence‑based clinical practice guidelines. Chest 2013; 143(5 Suppl): e1S–e29S.
- [3] Köhler J, Schuler M. Afatinib, erlotinib and gefitinib in the first‑line therapy of EGFR mutation‑positive lung adenocarcinoma: a review. Onkologie 2013; 36 : 510–518.
- [4] Shigematsu H, Lin L, Takahashi T, et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers. J Natl Cancer Inst 2005; 97: 339–346.
- [5] Castellanos E, Feld E, Horn L. Driven by Mutations: The Predictive Value of Mutation Subtype in EGFR‑Mutated Non‑Small Cell Lung Cancer. J Thorac Oncol 2017; 12: 612–623.
- [6] SPC léčivého přípravku Tagrisso, SÚKL. Dostupné na: https://www.sukl.cz/modules/medication/detail.php?code=0209153&tab=prices, Navštíveno dne 30. 4. 2021.
- [7] Sun L, Guo YJ, Song J, et al. Neoadjuvant EGFR‑TKI Therapy for EGFR‑Mutant NSCLC: A Systematic Review and Pooled Analysis of Five Prospective Clinical Trials. Front Oncol 2021; 10: 586596.
- [8] Fernandes Neto JM, Nadal E, Bosdriesz E, et al. Multiple low dose therapy as an effective strategy to treat EGFR inhibitor‑resistant NSCLC tumours. Nat Commun 2020; 11: 3157.
- [9] Liu S, Wu F, Li X, et al. Patients With Short PFS to EGFR‑TKIs Predicted Better Response to Subsequent Anti‑PD‑1/PD‑L1 Based Immunotherapy in EGFR Common Mutation NSCLC. Front Oncol 2021; 11: 639947.
- [10] Dong RF, Zhu ML, Liu MM, et al. EGFR mutation mediates resistance to EGFR tyrosine kinase inhibitors in NSCLC: From molecular mechanisms to clinical research. Pharmacol Res 2021; 26: 167.
- [11] Ma L, Li H, Wang D, et al. Dynamic cfDNA Analysis by NGS in EGFR T790M‑Positive Advanced NSCLC Patients Failed to the First‑Generation EGFR‑TKIs. Front Oncol 2021; 11: 643199.
- [12] Zhao Y, Cheng B, Chen Z, et al. Toxicity profile of epidermal growth factor receptor tyrosine kinase inhibitors for patients with lung cancer: A systematic review and network meta‑analysis. Crit Rev Oncol Hematol 2021; 160: 103305.
- [13] Ramalingam SS, Vansteenkiste J, Planchard D, et al. FLAURA Investigators. Overall Survival with Osimertinib in Untreated, EGFR‑Mutated Advanced NSCLC. N Engl J Med 2020; 382: 41–50.
- [14] Metastatic Non‑Small‑Cell Lung Cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up, 2020; str. 13–14. Dostupné na: https://www.esmo.org/content/download/347819/ 6934778/1/ESMO‑CPG‑mNSCLC‑15SEPT2020.pdf. Navštíveno dne 30. 4. 2021.
- [15] Papadimitrakopoulou VA, Mok TS, Han JY, et al. Osimertinib versus platinum‑pemetrexed for patients with EGFR T790M advanced NSCLC and progression on a prior EGFR‑tyrosine kinase inhibitor: AURA3 overall survival analysis. Ann Oncol 2020; 31: 1536–1544.
- [16] Isaka T, Ito H, Nakayama H, et al. Effect of epidermal growth factor receptor mutation on early‑stage non‑small cell lung cancer according to the 8th TNM classification. Lung Cancer 2020; 145: 111–118.
- [17] Pravidla pro prediktivní testování solidních nádorů. Linkos 2017. Dostupné na: https://www.linkos.cz/ceska‑onkologicka‑spolecnost‑cls‑jep/spoluprace‑cos/dohody‑s‑platci‑pece/pravidla‑pro‑prediktivni‑testovani‑solidnich‑nadoru‑prehled‑indikaci‑a‑metod‑sou/, Navštíveno dne 30.4.2021.