Glargin 300 U/ml – zkušenosti z praxe
Souhrn:
Adamíková A. Glargin 300 U/ml – zkušenosti z praxe. Remedia 2018; 28: 235–237.
Glargin 300 U/ml (Toujeo®) je dlouhodobě působící bazální inzulinový analog, který oproti inzulinu glargin 100 U/ml má více konstantní farmakokinetický profil s prolongovaným trváním účinku. Program klinických studií EDITION prokázal, že glargin 300 U/ml vede ke srovnatelné kontrole glykemie v široké populaci pacientů s diabetem, k menšímu počtu nočních a těžkých hypoglykemií a k nižším hmotnostním přírůstkům přes někdy vyšší spotřebu inzulinu, než je tomu při podávání glarginu 100 U/ml. Glargin 300 U/ml má nově publikované a s klinickým programem EDITION konzistentní výsledky také z reálné klinické praxe, ze sběru prospektivních i retrospektivních dat. Program studií DELIVER se zabýval klinickými výsledky u diabetiků 2. typu, kteří užívali jiný bazální inzulin a byli převedeni na léčbu přípravkem glargin 300 U/ml (DELIVER 1), dále srovnáním po převodu pacienta z bazálního inzulinu na inzulin glargin 300 U/ml nebo na jiný bazální inzulin (DELIVER 2) a srovnáním účinnosti glarginu 300 U/ml s ostatními bazálními inzuliny u pacientů s diabetes mellitus 2. typu ve věku 65 let a více v podmínkách reálné klinické praxe (DELIVER 3). Kazuistika 65leté pacientky s dvacetiletou anamnézou diabetes mellitus 2. typu, která byla postupně léčena kombinací perorálních antidiabetik, bazálního inzulinu s agonisty receptoru pro GLP‑1, až nakonec intenzifikovaným inzulinovým režimem, dokládá, že teprve změna bazálního inzulinu na dlouhodobě působící glargin 300 U/ml vedla k dobré kompenzaci s hodnotami glykovaného hemoglobinu 44 mmol/mol a bez hypoglykemií.
Summary:
Adamikova A. Glargine 300 U/ml – experience from practice. Remedia 2018; 28: 235–237.
Glargine 300 U/ml (Toujeo) is a long-acting basal insulin analogue which compared to insulin glargine 100 U/ml has a more constant pharmacokinetic profile with prolonged clinical effect. EDITION, a program of clinical studies, proved that glargine 300 U/ml lead to comparable control of glycaemia in a large population of diabetic patients, to a smaller number of night and serious hypoglycaemic events, and to smaller increments of mass through occasionally increased consumption of insulin than glargine 100 U/ml. Glargine 300 U/ml (Toujeo) has new identical results from real-world clinical settings, from prospective and retrospective collection of data. The programme of trials, DELIVER, dealt with clinical results of type 2 diabetic patients using another basal insulin and then transferred to glargine 300 U/ml (DELIVER 1), comparison of transfer from basal insulin to glargine 300 U/ml or another basal insulin (DELIVER 2), and comparison of the effectiveness of glargine 300 U/ml with the other basal types of insulin for treatment of type 2 diabetic patients aged ≥65 years in the conditions of real clinical practice (DELIVER 3). A case study of a 65-year old woman who has been suffering from type 2 diabetes for 20 years is presented; she was treated successively with a combination of oral antidiabetic drugs, basal insulin with GLP-1RA, and, eventually, with an intensified insulin regimen. It was only after the change of basal insulin to glargine 300 U/ml that good diabetes control was attained, i.e. HbA1c 44 mmol/mol, without hypoglycaemia.
Key words: glargine 300 U/ml , clinical trials programme EDITION, study programme DELIVER, diabetes control.
Úvod
Glargin 300 U/ml (Toujeo), dlouhodobě působící bazální inzulin, má stejný počet jednotek inzulinu jako glargin 100 U/ml, ale v třetinovém objemu aplikované injekce. Po subkutánní aplikaci se jen velmi pozvolna uvolňuje z podkoží, má prolongované trvání účinku delší než 24 hodin. Účinnost a bezpečnost byla ověřována studiemi fáze III v klinickém programu EDITION u diabetiků 1. a 2. typu. Primárním výstupem všech studií bylo prokázání non inferiority dle změny hodnot glykovaného hemoglobinu (HbA1c) a mezi hlavní sekundární výstupy patřilo sledování výskytu hypoglykemií a tělesné hmotnosti. Program prokázal, že glargin 300 U/ml vedl oproti glarginu 100 U/ml v populaci diabetiků 1. a 2. typu ke srovnatelné účinnosti dle změny hodnot HbA1c, k nižšímu výskytu nočních hypoglykemií, hypoglykemií potvrzených kdykoliv během dne nebo těžkých hypoglykemií a k menšímu hmotnostnímu přírůstku přes těsně vyšší spotřebu inzulinu. Metaanalýza studií programu EDITION také potvrdila redukci potvrzených nebo těžkých hypoglykemií jak nočních, tak v jakoukoliv denní dobu u diabetiků 2. typu, což je samozřejmě velkou výhodou [1].
Glargin 300 U/ml má nyní výsledky i ze studií z reálné klinické praxe (RWE), a to ze sběru prospektivních i retrospektivních dat. Mezi prospektivní studie patří observační studie z registru bazálních inzulinů, intervenční pragmatické klinické studie (ACHIEVE CONTROL, REACH CONTROL, REGAIN CONTROL) a pak retrospektivní sledování (studie DELIVER 1–3).
Studie DELIVER 3 srovnávala účinnost glarginu 300 U/ml s jinými bazálními inzuliny u pacientů s diabetes mellitus 2. typu ve věku 65 let a více. Studie použila data z databáze Predictive Health Intelligence Environment (PHIE) pro diabetes z 26 integrovaných informačních sítí, 360 nemocnic, od 315 000 zdravotnických pracovníků. Do analýzy byli zařazeni pacienti s diabetes mellitus 2. typu ve věku 65 let a starší převedení na léčbu glarginem 300 U/ml nebo jiným bazálním inzulinem (glargin 100 U/ml, inzulin degludek, inzulin detemir). Převedení na léčbu glarginem 300 U/ml vedlo oproti léčbě jinými bazálními inzuliny po šesti měsících k porovnatelné změně v úrovni kontroly HbA1c oproti výchozí hodnotě (p = 0,24), podobný podíl pacientů dosáhl hodnot HbA1c < 8 % (63,9 mmol/mol, p = 0,797). U pacientů převedených na léčbu přípravkem glargin 300 U/ml byla pravděpodobnost výskytu hypoglykemie během šestiměsíčního sledování o 57 % nižší (p = 0,0001) a počet hypoglykemických příhod byl signifikantně – o 48 % – nižší (p = 0,0002) [2].
Hypoglykemie patří mezi hlavní akutní komplikace diabetu u starších pacientů s déletrvajícím onemocněním. Těžké hypoglykemie jsou potenciálním markerem vysokého rizika kardiovaskulárních příhod a mortality. Ve studii u 195 pacientů s anamnézou nejméně jedné těžké hypoglykemie během 13,5 roku byla tříletá kumulativní incidence ischemické choroby srdeční 10,8 % a mortality 28,3 % [3]. Redukce počtu hypoglykemických příhod u pacientů ve věku 65 let a více je tak vedle dobré účinnosti na kontrolu glykemie důležitým aspektem při rozhodování o způsobu antidiabetické terapie.
Kazuistika
65letá pacientka se léčí s diabetes mellitus 2. typu dvacet let, od roku 1998. Při stanovení diagnózy měla hyperglykemii 12,3 mmol/l nalačno a po jídle 14,2 mmol/l, index tělesné hmotnosti (BMI) 35,8. Kromě redukční diabetické diety byla léčena metforminem v postupně narůstající dávce, od roku 2000 v kombinaci s deriváty sulfonylurey, nejprve s gliklazidem a posléze s glimepiridem. Dlouhodobě užívala pro zvýšené sérové koncentrace cholesterolu statiny. V roce 2002 byla u pacientky pro hyperglykemii nalačno 11,8 mmol/l a postprandiálně 16,3 mmol/l při maximálních dávkách glimepiridu a metforminu zahájena terapie inzulinem v intenzifikovaném inzulinovém režimu. Pacientce byl podáván inzulin NPH ve dvou denních dávkách, krátkodobě působící analog ve třech dávkách a metformin. Postupně se při selfmonitoringu a redukční diabetické dietě podařilo snížit dávku inzulinu NPH na 6 0 6 jednotek (j) a dávku inzulinu aspart na 4 4 4 j, 2 700 mg metforminu; BMI poklesl na 31,9, glykemický profil 5,0 5,9 5,6 4,8 mmol/l.
V roce 2007 vzhledem k nízké spotřebě inzulinu a dostatečné koncentraci C peptidu jsme zkusili vysadit inzulin, v léčbě byl ponechán metformin. Během dvou let se však opět objevují hyperglykemie s potřebou přidávat do léčebného schématu derivát sulfonylurey. Hodnota HbA1c se pohybuje kolem 57 mmol/mol. V lednu roku 2011 se terapie pro neuspokojivou kompenzaci vrátila zpět k intenzifikovanému inzulinovému režimu kombinací krátkodobě a dlouhodobě působícího analoga (aspart/detemir) a podávání metforminu. V roce 2013 pacientka prodělala operaci abscesu stehna a abscesu podkoží lumbální krajiny s píštělí do páteřního kanálu. Epidurální abscesy jen pomalu regredovaly, zhoršovaly se vertebrogenní potíže i pohyblivost. Při hypertenzi a diabetu se rozvinula lehčí forma nefropatie, na očním pozadí zatím není dokumentována diabetická retinopatie.
V roce 2014 pacientka absolvovala operaci femoropopliteálního
bypassu vlevo. Dávky inzulinu postupně
narůstaly, hodnota HbA1c byla 79 mmol/mol, zcela
neuspokojivá. Pro obezitu, BMI 34, za hospitalizace a dohledu
nad redukční dietou jsme se pokusili v roce 2015 změnit
intenzifikovaný inzulinový režim v dávce
54 j/24 h na kombinaci bazálního inzulinového
analoga detemiru, metforminu a analoga receptoru pro glukagonu
podobný peptid 1 (GLP 1RA) liraglutidu. Kompenzace se zlepšila
na hodnotu HbA1c 59 mmol/mol a BMI 33, avšak
pacientka se rozhodla, že nechce hradit liraglutid, a vrátila
se k původnímu inzulinovému
režimu již koncem roku 2015. Kompenzace diabetu se při kombinaci
aspart/detemir/metformin dařilo udržovat kolem hodnoty HbA1c
60 mmol/mol jen za cenu vysokých dávek inzulinu 74 j/24 h,
1,2 j/kg. Přechodně bylo dosaženo hodnot HbA1c
nižších než 60 mmol/mol 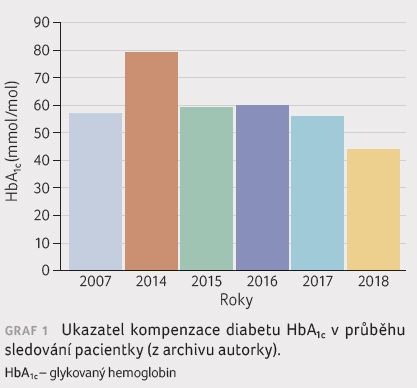 během účasti na kurzu skupinové
edukace, kde pacientka lépe pracovala se selfmonitoringem
a s úpravou dávek inzulinu dle aktuálních hodnot
a zřejmě i více dodržovala dietu. Snahy zhatila
prolongovaná léčba pneumonie.
během účasti na kurzu skupinové
edukace, kde pacientka lépe pracovala se selfmonitoringem
a s úpravou dávek inzulinu dle aktuálních hodnot
a zřejmě i více dodržovala dietu. Snahy zhatila
prolongovaná léčba pneumonie.
V srpnu 2017 při hodnotě HbA1c 61 mmol/mol, glykemickém profilu 14,0 15,6 11,4 14,7 13,3 mmol/l, dávce 48 j detemiru a 24 14 14 j aspartu s denním podáváním metforminu jsme provedli změnu bazálního analoga detemiru na bazální analog druhé generace glargin 300 U/ml. Při kontrole za tři měsíce již pacientka měla hodnotu HbA1c 56 mmol/mol a za další tři měsíce 44 mmol/mol, poprvé za celou dobu léčby diabetu, glykemický profil 6,9 9,5 5,4 8,6 6,2 mmol/l. Při stažení glukometru jsme zaznamenali průměrnou glykemii 7,5 mmol/l, směrodatná odchylka (SD) 2,0, pacientka neprodělala žádné hypoglykemické příhody. Dávku bazálního analoga nebylo třeba upravit. Graf 1 ukazuje parametr dlouhodobé kompenzace hodnoty HbA1c v průběhu sledování.
Diskuse
Za dvacet let doznala léčba diabetes mellitus 2. typu celou řadu změn. Místo derivátů sulfonylurey se do kombinace s metforminem nabízí řada nových antidiabetik, která svým účinkem zasahují přímo do patofyziologie onemocnění a umožňují vybrat léčbu téměř „šitou na míru“. I dlouhá anamnéza diabetu a původní klasická schémata léčby nemusejí znamenat, že pacient nemůže využít potenciálu nově příchozích antidiabetik ke kontrole glykemie.
Výhoda GLP 1RA pro léčbu diabetiků 2. typu spočívá v dobrém efektu na kompenzaci diabetu, ve snížení tělesné hmotnosti a v absenci rizika vzniku hypoglykemických příhod. Tato léčiva aktivují receptory pro GLP 1 a tím dochází ke zvýšení sekrece inzulinu, snížení sekrece glukagonu, snížení pocitu hladu, zpomalení vyprazdňování žaludku, snížení sérové koncentrace lipidů a krevního tlaku. Mají velmi dobrý bezpečnostní profil z hlediska kardiovaskulárního rizika, některé GLP 1RA kardiovaskulární riziko signifikantně snižují. Kombinace s bazálním inzulinem vedla i u naší pacientky ke zlepšení kompenzace. Nyní již jsou k dispozici přípravky obsahující fixní kombinaci GLP 1RA s inzulinem (Xultophy, Suliqua) [4,5]. Fixní kombinace zlepšuje adherenci k léčbě, titrace je pro pacienta jednodušší než úpravy dávek v intenzifikovaném inzulinovém režimu. Počáteční dávkování při převodu z bazálního inzulinu je u přípravku Xultophy 16 dávkovacích jednotek (16 j inzulinu degludek a 0,6 mg liraglutidu, titrace 2× týdně) a u přípravku Suliqua 20 dávkovacích jednotek v předplněném peru Suliqua 10–40, při vyšší spotřebě (≥ 30 j inzulinu) úvodní dávkování 30 dávkovacích jednotek v peru Suliqua 30–60 (20 j inzulinu glargin 100 U/ml a 10 µg lixisenatidu nebo 30 j inzulinu glargin a 10 µg lixisenatidu, titrace dle glykemie nalačno). Při přechodu z léčby dvěma dávkami bazálního inzulinu nebo z léčby glarginem 300 U/ml je doporučeno dávku snížit o 20 %.
Pro poměrně vysoké glykemie v profilu, postprandiálně 15,6 mmol/l při bazální dávce inzulinu detemir 48 j, jsme se rozhodli pacientku nadále léčit inzulinoterapií. Změnili jsme bazální inzulin za přípravek z nové generace bazálních inzulinů glargin 300 U/ml s prolongovaným účinkem a s vyšší koncentrací umožňující mimo jiné lepší vstřebávání z podkoží při delší expozici tkáňovým peptidázám a s menším objemem aplikované dávky. Tato terapie měla efekt na kompenzaci, aniž by se vyskytly hypoglykemické příhody, tělesná hmotnost se nezvyšovala. Je možno zkusit snižovat dávky inzulinu.
Závěr
Bazální inzulin nové, druhé generace glargin 300 U/ml u 65leté polymorbidní pacientky s dlouhotrvajícím onemocněním diabetes mellitus 2. typu a s terapií řadou různých neúspěšných kombinací antidiabetik vedl k výraznému zlepšení kontroly glykemie, k dosažení hodnoty HbA1c 44 mmol/mol a k absenci hypoglykemických příhod. Zkušenosti z naší praxe odpovídají výsledkům studií s glarginem 300 U/ml jak v klinickém programu studií fáze III EDITION, tak výsledkům studií z reálné klinické praxe v programu DELIVER.
Seznam použité literatury
- [1] Ritzel R, Roussel R, Bolli GB, et al. Patient‑level‑meta‑analysis of EDITION 1, 2, and 3: glycaemic control and hypoglycaemia with new glargine 300 U/ml versus glargine 100 U/ml in people with type 2 diabetes. Diabetes Obes Metab 2015; 17: 859–867.
- [2] Zhou FL, et al. Older adults with type 2 diabetes (T2D) experience less hypoglycemia when switching to insulin glargine 300 U/mL (Gla‑300) vs other basal insulins (DELIVER 3 Study). Poster 986‑P, American Diabetes Association (ADA) 77th Scientific Sessions, San Diego, CA, U.S., June 10, 2017.
- [3] Lee AK, Warren B, Lee CJ, et al. The association of severe hypoglycemia with incident cardiovascular events and mortality in adults with type 2 diabetes. Diabetes Care 2018; 41: 104–111.
- [4] Souhrn údajů o přípravku Xultophy. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/002647/WC500177657.pdf
- [5] Souhrn údajů o přípravku Suliqua. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004243/WC500224673.pdf