Inhibice interleukinu 17A jako komplexní řešení PsA i axSpA
Lze dlouhodobě ovlivnit všechny hlavní domény psoriatické artritidy při podávání sekukinumabu, inhibitoru IL‑17A? Přináší tato terapie úlevu od mimokloubních projevů a zpomalení radiografické progrese u pacientů s axiálními spondyloartritidami? Mohou při komplexní péči o nemocné pomoci moderní technologie, „big data“ a 3D vizualizace?
Nejen na tyto otázky získali odpovědi
účastníci satelitních sympozií, která společnost Novartis
uspořádala jako součást odborného programu červnového
výročního kongresu EULAR (European League Against Rheumatism) 2019
ve španělském Madridu. Dozvědět se mohli jak o nových
výsledcích hodnocení léčby sekukinumabem u psoriatické
artritidy (PsA) a radiografické formy axiální
spondyloartritidy (axSpA), tedy ankylozující spondylitidy (AS), tak
i o jeho budoucnosti u formy neradiografické
(nr axSpA). Diskutovány byly patofyziologie SpA, nenaplněné
potřeby nebo optimalizace managementu daných onemocnění včetně
řešení heterogenních manifestací.
IL 17A ovlivňuje osteoklasty
i osteoblasty…
Profesorka Ellen M. Gravalleseová z University of Massachusetts Medical School, USA, zdůraznila, že v případě psoriázy, PsA či axSpA je ústředním hnacím motorem jejich patogeneze osa IL 23/IL 17. „Dostupné preklinické a klinické důkazy naznačují, že cytokiny IL 23 a IL 17A mají překrývající se, ale odlišnou biologii. Prvně jmenovaný má totiž jen malý přímý efekt na kostní buňky, zatímco druhý jmenovaný podporuje osteoklasty a má komplexní účinek na osteoblasty,“ vysvětlila profesorka Gravalleseová. Upozornila mj. na experimentální práci Shawa a kol. publikovanou v Arthritis Research & Therapy 2016, ze které vyplynulo, že IL 17A inhibuje diferenciaci osteoblastů a může omezovat novotvorbu kostní tkáně na zánětlivých periostálních místech u SpA. Ukazuje se rovněž, že IL 17A účinkuje i na prekurzory osteoblastů. Uluçkan a kol. totiž experimentálně prokázali, že chronický zánět kůže vede ke ztrátě kostní hmoty, a to v důsledku inhibice signální dráhy Wnt u osteoblastů zprostředkované právě IL 17A (Science Translational Medicine 2016). „Tento cytokin tedy hraje při patogenních procesech u spondyloartritid stěžejní roli – podporuje vznik zánětu, kostní erozi či destrukci chrupavčité tkáně. Jeho hlavním producentem jsou Th17 lymfocyty, jejichž zvýšený počet byl detekován v periferní krvi pacientů s AS. U nemocných s PsA zase synoviální tekutina obsahuje vyšší koncentraci IL 17+ CD8+ T buněk,“ dodala profesorka Gravalleseová s tím, že budoucí výzkum by měl cílit na další zkoumání signálních drah, které indukují IL 17A, a enteziálních kostních formací ve vztahu k mechanickému stresu a zánětu.
… a podporuje rozvoj
entezitidy
Pokud se týká entezitidy u nemocných se SpA, mezi typicky zasažené oblasti patří podle profesora Georga Schetta z Friedrich Alexander Universität Erlangen Nürnberg, Německo, Achillova šlacha, plantární fascie, patelární šlacha, trochanter, epikondyly, šlacha m. supraspinatus nebo přední podélný vaz, ale také sakroiliakální nebo sternoklavikulární klouby. „V případě axSpA tedy na MR detekujeme periferní i axiální zánětlivé léze,“ uvedl profesor Schett. Dodal, že entezitida je charakterizována výraznou intraoseální složkou zánětu. „Za normálních okolností se šlacha upíná do porézní trabekulární kosti, která je prostoupena velkým množstvím cév, jež de facto umožňují komunikaci mezi kostní dření a entezí. V důsledku mechanického stresu však nastává vazodilatace těchto cév, následně osteitida a jsou vylučovány imunitní buňky. Vlivem IL 17 a IL 22 dochází k mezenchymální proliferaci a diferenciaci osteoblastů, posléze pak k novotvorbě kostní tkáně,“ vysvětlil.
Entezitida řízená IL 17A vede u nemocných s AS k nevratnému strukturálnímu poškození, které je navíc asociováno s remodelací kostní tkáně a metaplazií kostní dřeně v podobě tukových lézí. Zánětlivé oblasti v kostní dřeni u jedinců s radiografickou axSpA jsou charakterizovány osteoklasty, zatímco pro tukové oblasti jsou charakteristické osteoblasty (Baraliakos, et al., Annals of the Rheumatic Diseases 2019).
Axiální postižení u PsA versus
axSpA
Docent Xenofon Baraliakos, PhD, z Rhur Universität Bochum, Německo, se zaměřil na další manifestaci – a sice srovnání bolesti zad u PsA a axSpA. „Z genetického hlediska se axiální postižení u obou chorob překrývá jen velmi málo, a to prostřednictvím antigenu HLA B27. Jeho pozitivita se spolu s radiograficky prokázaným poškozením periferních kloubů a zvýšenou sedimentací erytrocytů řadí k rizikovým faktorům u časné PsA, zatímco u té dlouhotrvající má rozvoj bolesti zad návaznost na přítomnou dystrofii nehtů, periostitidu, vysoký počet postižených kloubů a rovněž zvýšenou sedimentaci,“ vysvětlil s tím, že závažnost periferních symptomů může maskovat zánětlivé onemocnění zad u PsA (Aydin, et al., Clinical Rheumatology 2018). „Na druhé straně práce Jadona a kol. zveřejněná v roce 2017 v časopise Annals of the Rheumatic Diseases, prokázala, že v kombinované kohortě pacientů s PsA nebo AS splnila čtvrtina souboru diagnostická kritéria pro obě choroby,“ komentoval docent Baraliakos.
Jak dále konstatoval, u nemocných s PsA je axiální postižení, které souvisí se závažnějším průběhem choroby, v klinické praxi velmi těžko rozpoznatelné. Neexistuje totiž jeho univerzálně přijímaná definice a dostupná kritéria jsou nekonzistentní. Přesná prevalence rovněž není známa – odhady v jednotlivých studiích se liší a uvádějí například, že v případě dlouhotrvající PsA trpí bolestmi zad 25–70 % jedinců, u časné formy onemocnění pak 5–28 %. Tyto rozdíly naznačují, že axiální onemocnění se obvykle vyvíjí až v pozdějším stadiu nemoci (Feld, et al., Journal of Rheumatology 2018).
Zaměřeno na psoriatickou
artritidu
Co se týká terapie PsA, guidelines Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA) z roku 2015 uvádějí, že léčba by měla být vedena podle toho, která ze šesti základních domén je zapojena (periferní artritida, axiální postižení, entezitida, daktylitida, postižení kůže, postižení nehtů). „V případě axiálního onemocnění byla doporučení odvozena od evidence u AS, protože data pro PsA nebyla k dispozici. Nyní vám však mohu prezentovat recentní výsledky studie MAXIMISE – prvního randomizovaného klinického hodnocení, jehož cílem bylo ověřit účinnost a bezpečnost biologického léčiva při řešení axiálních manifestací PsA,“ uvedl docent Baraliakos.
MAXIMISE ‒ sekukinumab zmírnil
axiální obtíže u dvou třetin pacientů
Do probíhající 52týdenní dvojitě zaslepené, randomizované, placebem kontrolované studie fáze IIIb MAXIMISE bylo zařazeno 498 dospělých pacientů s PsA určenou podle kritérií CASPAR (Classification Criteria for Psoriatic Arthritis) a s klinicky diagnostikovanými axiálními obtížemi, bolestí páteře hodnocenou na vizuální analogové škále (VAS) > 40/100 a s hodnotou skóre aktivity BASDAI (Bath Ankylosing Spondylitis Activity Index) > 4 navzdory terapii nejméně dvěma nesteroidními antirevmatiky (NSA). Randomizováni byli k podávání placeba, nebo sekukinumabu subkutánně v dávce 300 mg či 150 mg jednou týdně po dobu čtyř týdnů, následně pak každé čtyři týdny. Jedinci z placebové skupiny byli ve 12. týdnu znovu randomizováni k aktivní léčbě sekukinumabem 300 mg nebo 150 mg. „Demografické a základní charakteristiky sledovaného souboru byly ve všech třech ramenech srovnatelné,“ komentoval docent Baraliakos a upřesnil, že průměrný věk se pohyboval okolo 46–47 let, zhruba polovinu tvořili muži, třetina byla HLA B27 pozitivní, asi 90 % nemocných trpělo psoriázou, průměrná doba od prvních axiálních příznaků činila přibližně 8–9 let a průměrná hodnota skóre BASDAI 1,2–1,4.
Z výsledků vyplynulo, že studie MAXIMISE splnila svůj primární, resp. hlavní sekundární cíl – odpovědi ASAS20 (20% zlepšení dle Assessment in Ankylosing Spondylitis) ve 12. týdnu totiž dosáhlo 63,1 % nemocných léčených sekukinumabem v dávce 300 mg, resp. 66,3 % nemocných léčených sekukinumabem v dávce 150 mg oproti 31,3 % jedinců s placebem (p < 0,0001 pro obě srovnání). Rychlý nástup účinku byl pozorován již ve čtvrtém týdnu, přičemž bezpečnostní profil sekukinumabu byl v souladu s předchozími zjištěními (Baraliakos, et al., EULAR 2019, abstrakt OP0235). „V současnosti jsou analyzována zaslepená data z MR vyšetření na počátku, ve 12. a 52. týdnu sledování, závěry budou dostupné v příštím roce,“ prozradil docent Baraliakos.
Big data na pomoc komplexní péči
O potřebě komplexní léčby PsA, s využitím 3D vizualizace dat při komunikaci s pacienty a rozhodování o léčbě, se zmínil docent Peter Nash z University of Queensland, Austrálie. „Big data se nevyhýbají ani biomedicíně. Pokroky v moderních technologiích a strojovém učení, které je jednou ze součástí umělé inteligence, nám pomáhají optimalizovat zdravotní péči a jsou dalším krokem směrem k personalizovanému přístupu k našim nemocným,“ komentoval a dodal: „Zásadní je posunout se za hranici pouhých čísel, jakými jsou třeba kompozitní indexy PASI (Psoriasis Area and Severity Index) nebo ACR (American College of Rheumatology), jež využíváme ke kvantifikaci, a zachovat anatomickou i fyziologickou integritu dané choroby.“
A právě na příkladu sekukinumabu, který v klinickém programu FUTURE prokázal časnou i setrvalou účinnost ve všech šesti klíčových doménách PsA a umožnil dosažení remise, docent Nash demonstroval, jak lze díky vizualizaci dat pacientům názorně ukázat, co mohou od konkrétní léčby v konkrétním případě očekávat – s ohledem na závažnost onemocnění, jeho manifestace, formy, strukturální či kloubní poškození apod. Vzal si přitom na pomoc software iDIVE a s využitím dat ze studií FUTURE 1–5 vizualizoval, jak sekukinumab působí na psoriázu a postižení nehtů, tedy jak zlepšuje skóre PASI, a to nejen v průběhu času, ale i v různých tělesných oblastech. Dále jak redukuje počet oteklých kloubů, inhibuje radiografickou progresi nebo řeší entezitidu či daktylitidu.
FUTURE 5 ‒ sekukinumab dlouhodobě
zpomaluje RTG progresi…
Ve svém vystoupení docent Nash dále mj. představil nejnovější dlouhodobé výsledky klinického hodnocení fáze III FUTURE 5, jež sledovalo účinnost sekukinumabu na klinické známky, symptomy a radiografickou progresi u nemocných s aktivní PsA. Tato randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie zahrnula 996 dospělých jedinců, kteří byli léčeni placebem, nebo sekukinumabem 300 mg či 150 mg s úvodními dávkami o stejné výši, nebo 150 mg bez úvodní dávky – a to v prvních čtyřech týdnech, poté jednou za čtyři týdny. Ke zvýšení dávky sekukinumabu ze 150 mg na 300 mg mohlo dojít na základě rozhodnutí lékaře od 52. týdne. Povoleno bylo konkomitantní podávání metotrexátu, maximálně 25 mg týdně.
Primární údaje FUTURE 5 již dříve
poukázaly na fakt, že v porovnání s placebem
dosáhlo odpovědi ACR20 v 16. týdnu, tedy primárního
cíle, statisticky signifikantně více nemocných ve všech
třech ramenech se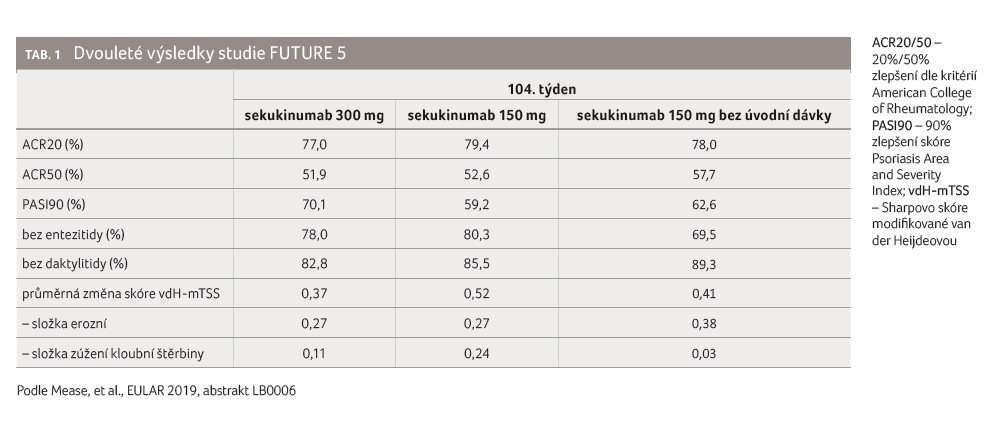 sekukinumabem. Obdobně tomu bylo v případě
klíčového sekundárního cílového ukazatele, a sice
zpomalení radiografické progrese, měřené změnou celkového
Sharpova skóre modifikovaného van der Heijdeovou (vdH mTSS)
ve 24. týdnu. Nejnovější dvouletá data, prezentovaná
právě v Madridu (Mease, et al., EULAR 2019, abstrakt LB0006),
pak potvrdila, že u převážné většiny pacientů nedošlo
při podávání sekukinumabu k radiografické progresi (změna
vdH mTSS ≤ 0,5) – konkrétně u 89,5 %
osob léčených 300 mg, 82,3 % 150 mg a 81,1 % 150 mg
bez úvodní dávky; průměrná změna vdH mTSS přitom činila
0,37, resp. 0,52, resp. 0,41. Až do 104. týdne zůstaly
zachovány také další klinické odpovědi, např. při podávání
nejvyšší dávky sekukinumabu byla odpověď ACR20/50 zaznamenána
v 77 %, resp. 51,9 % případů, skóre PASI90 dosáhlo
70,1 % nemocných, k vyřešení entezitidy došlo u 78 %
a daktylitidy u 82,8 % jedinců. Obdobně pozitivní
údaje byly hlášeny i u osob léčených nižší dávkou
sekukinumabu (tab. 1).
sekukinumabem. Obdobně tomu bylo v případě
klíčového sekundárního cílového ukazatele, a sice
zpomalení radiografické progrese, měřené změnou celkového
Sharpova skóre modifikovaného van der Heijdeovou (vdH mTSS)
ve 24. týdnu. Nejnovější dvouletá data, prezentovaná
právě v Madridu (Mease, et al., EULAR 2019, abstrakt LB0006),
pak potvrdila, že u převážné většiny pacientů nedošlo
při podávání sekukinumabu k radiografické progresi (změna
vdH mTSS ≤ 0,5) – konkrétně u 89,5 %
osob léčených 300 mg, 82,3 % 150 mg a 81,1 % 150 mg
bez úvodní dávky; průměrná změna vdH mTSS přitom činila
0,37, resp. 0,52, resp. 0,41. Až do 104. týdne zůstaly
zachovány také další klinické odpovědi, např. při podávání
nejvyšší dávky sekukinumabu byla odpověď ACR20/50 zaznamenána
v 77 %, resp. 51,9 % případů, skóre PASI90 dosáhlo
70,1 % nemocných, k vyřešení entezitidy došlo u 78 %
a daktylitidy u 82,8 % jedinců. Obdobně pozitivní
údaje byly hlášeny i u osob léčených nižší dávkou
sekukinumabu (tab. 1).
… a zmírňuje psoriázu nehtů
Docent Nash se rovněž zmínil o své recentní subanalýze studie FUTURE 5, která byla věnována podskupině 663 nemocných trpících PsA a zároveň psoriázou nehtů. „Ta se vyskytuje až u 80 % pacientů s PsA a je spojena s významnou bolestí, psychosociální disabilitou, sníženou fyzickou funkcí a kvalitou života. Víme také, že je prediktorem závažnosti onemocnění s postižením kloubů a se strukturálním poškozením,“ konstatoval a dodal: „Zjistili jsme, že v 16. týdnu terapie sekukinumabem statisticky signifikantně zmírnila psoriázu nehtů, přičemž další pozitivní účinek přetrvával až do 52. týdne.“
Konkrétní údaje pro změnu modifikovaného skóre závažnosti nehtové psoriázy mNAPSI (modified Nail Psoriasis Severity Index) byly doloženy v 16. týdnu: –8,71 při podávání sekukinumabu 300 mg, –8,95 pro 150 mg a –7,55 pro 150 mg bez úvodní dávky versus –2,34 v placebové skupině (p < 0,0001 pro všechna srovnání), po roce sledování pak –13,5, resp. –13,9, resp. –14 v ramenech se sekukinumabem (Nash, et al., EULAR 2019, abstrakt FRI0457). U jedinců s nehtovou psoriázou a PsA tento lék dále vedl k efektivnímu ovlivnění kloubního a kožního postižení, entezitidy, daktylitidy, fyzické funkce i kvality života.
Setrvale příznivý bezpečnostní
profil
„Žádná účinná terapie se však neobejde bez bezpečnosti,“ zdůraznil docent Nash a zmínil se v této souvislosti o práci Deodhara a kol. publikované letos v květnu v Arthritis Research & Therapy. Jednalo se o analýzu bezpečnostních dat poolovaných z 21 studií se sekukinumabem u psoriázy (téměř 5 200 nemocných), PsA (takřka 1 400 nemocných) či AS (bezmála 800 nemocných) a údajů z postmarketingového sledování (kumulativní expozice 96 054 pacientoroků). „Ukázalo se, že sekukinumab má dlouhodobě příznivý bezpečnostní profil. Nejčastěji hlášeným nežádoucím účinkem byly nákazy horních cest dýchacích. Výskyt závažných či kandidových infekcí, střevních zánětů či významných kardiovaskulárních příhod byl nízký, stejně jako imunogenicita. Tvorba protilátek proti léku nebyla asociována s potenciální ztrátou klinické odpovědi, neočekávanými změnami farmakokinetiky sekukinumabu či možnými komplikacemi souvisejícími s imunogenicitou,“ vysvětlil docent Nash. Upozornil, že při podávání sekukinumabu nebyla zaznamenána ani reaktivace tuberkulózy. Ta musí být vyšetřena ještě před zahájením terapie a dále pečlivě monitorována během léčby i po jejím ukončení.
Zaměřeno na axiální
spondyloartritidy
Jak konstatoval profesor Robert Landewé, PhD, z Academisch Medisch Centrum – Universiteit van Amsterdam, Nizozemsko, v přednášce zaměřené na axSpA, ať už se jedná o radiografickou formu, tedy AS, nebo o formu neradiografickou, k dispozici nejsou žádné diagnostické testy. „Máme klasifikační kritéria, která však pro stanovení diagnózy, s ohledem na rozlišení obou forem, nejsou úplně vhodná,“ dodal s tím, že je obtížné odlišit pacienta s časnou AS a nr axSpA. „Zátěž pro nemocného je obdobná, neradiografickou formu je ovšem složitější rozpoznat,“ komentoval profesor Landewé.
V souvislosti s rozvojem terapie axSpA a masivním zavedením inhibitorů tumor nekrotizujícího faktoru alfa (TNFα) do praxe v indikaci AS pak mj. upozornil na meeting amerického Úřadu pro kontrolu potravin a léčiv (FDA) z roku 2013, konkrétně Arthritis Advisory Committee, jehož cílem bylo posoudit vyžití klasifikačních kritérií ASAS při schvalování léčiv u nr axSpA. „Důvodem byla obava z nesprávné diagnózy, ze zneužití těchto kritérií a z explozivního rozšíření inhibitorů TNFα. Požadavkem regulátora bylo zavedení placebem kontrolovaných klinických studií s ročním trváním a zařazením nemocných s objektivními známkami zánětu,“ připomněl profesor Landewé. Aktuálně je podle něj potřeba soustředit se na fakt, že nr axSpA je samostatné chronické onemocnění, dále na objasnění jeho patofyziologie či na rozuzlení zánětlivých a nezánětlivých symptomů.
MEASURE
1–4 ‒ sekukinumab řeší periferní i axiální entezitidu
Managementu léčby axSpA se věnoval profesor Denis Poddubnyy, PhD, z Charité – Universitätsmedizin Berlin, Německo. Připomněl, že primárním cílem je dosažení remise či nízké aktivity onemocnění založené na hodnocení kombinace laboratorních a klinických markerů včetně extraartikulárních manifestací. Nejúčinnějšími možnostmi terapie axSpA jsou NSA, inhibitory TNFα a IL 17. „Volba konkrétního léku by měla brát v úvahu muskuloskeletální a mimokloubní projevy,“ uvedl profesor Poddubnyy. Zmínil se v této souvislosti o sekukinumabu, který v rozsáhlém klinickém programu MEASURE prokázal dlouhodobou účinnost a bezpečnost u nemocných s aktivní AS, s ohledem na její různé symptomy a projevy.
Recentní post hoc analýza poolovaných dat ze studií MEASURE 1–4, kterou na kongresu EULAR 2019 prezentoval profesor Schett (abstrakt FRI0380), např. potvrdila, že léčba sekukinumabem vede k setrvalému a v porovnání s placebem ke statisticky významnému zlepšení či úplnému vyřešení axiální i periferní entezitidy u nemocných s AS. V 16. týdnu byla zaznamenána průměrná změna celkového skóre MASES (Maastricht Ankylosing Spondylitis Enthesitis Score; 13 míst entezí) –1,9 v placebovém rameni, –2,9 při dávce 300 mg sekukinumabu (p < 0,01) a –2,4 při dávce 150 mg ( < 0,05), v 52. týdnu pak –3,9 pro vyšší a –3,5 pro nižší dávku sekukinumabu. Obdobné výsledky byly evidovány i pro axiální místa entezí.
Co přinese budoucnost?
„Současná data rovněž ukazují, že včasná a účinná protizánětlivá léčba je schopna inhibovat radiografickou progresi,“ konstatoval dále profesor Poddubnyy a upozornil na aktuální experimentální práci van Toka a kol. publikovanou v Arthritis & Rheumatology 2019, která naznačila, že profylaktická i terapeutická inhibice IL 17A vede k redukci zánětu a novotvorby kostní tkáně u transgenních potkanů se SpA. To podporuje hypotézu, že IL 17A je klíčovým hnacím motorem obou uvedených procesů. Již ze studie MEASURE 1 vyplynulo, že takřka u 80 % nemocných s AS léčených sekukinumabem nedošlo po čtyřech letech ke změně modifikovaného skóre mSASSS (modified Stoke Ankylosing Spondylitis Spinal Score < 2), které slouží ke sledování radiografické progrese. Novější práce, jež nepřímo srovnává studii MEASURE 1 s historickou kohortou ENRADAS, kde pacienti dostávali NSA, opět poukazuje na to, že podávání sekukinumabu je spojeno s numericky vyšším podílem jedinců s menší změnou skóre mSASSS (0,55 vs. 0,89) v průběhu dvou let. Výsledky však nejsou statisticky signifikantní (Braun, et al., Arthritis Research & Therapy 2019).
„Zda blokáda IL 17A může být asociována se snížením radiografické progrese i u jedinců v pokročilém stadiu onemocnění, by měla potvrdit head to head studie SURPASS. V plánu je zařadit více než 800 nemocných s aktivní AS dosud neléčených biologiky, kteří neodpověděli na NSA či léky modifikující chorobu a mají zvýšenou koncentraci vysoce senzitivního C reaktivního proteinu (hsCRP) nebo přítomnost alespoň jednoho syndesmofytu. Primárním cílem je přímo porovnat efektivitu sekukinumabu oproti biosimilárnímu adalimumabu na radiografickou progresi ve 104. týdnu,“ nastínil profesor Poddubnyy s tím, že předpokládaný termín dokončení tohoto klinického hodnocení je v listopadu 2021.
Pokud jde o neradiografickou axSpA, pro jejíž terapii sekukinumab zatím schválení nemá, v příštím roce jsou očekávány výsledky randomizované, dvojitě zaslepené multicentrické studie PREVENT, do které bylo zařazeno 555 jedinců s neadekvátní odpovědí na NSA, biologika nebo jiné léky modifikující chorobu. Primárním cílovým ukazatelem je odpověď ASAS40 v 16. a 52. týdnu u pacientů léčených sekukinumabem versus placebem.
Redakčně zpracovala Ing. Jana Tlapáková