Intestinální podání levodopy v léčbě Parkinsonovy nemoci
Souhrn:
U pacientů s Parkinsonovou nemocí (PN) je ve stadiu pozdních hybných a psychických komplikací dosažení dlouhodobě vyrovnaného stavu velmi obtížné. V tomto stadiu lze terapeuticky použít buď hlubokou mozkovou stimulaci (s výjimkou pacientů s kognitivními poruchami nebo s demencí) nebo intestinální infuzní podání levodopy spolu s carbidopou (Duodopa®), výjimečně subkutánní podávání apomorfinu. Je prezentován případ 63letého muže s pokročilou PN ve stadiu pozdních motorických a psychických komplikací, u kterého byla po selhání klasické farmakoterapie použita dlouhodobě a bezpečně terapie Duodopou®.
Key words: advanced Parkinson’s disease – late motor and mental complications – Duodopa.
Summary:
It is very difficult to achieve long‑term balance in the clinical status of patients with Parkinson’s disease (PD) suffering from late motor and mental complications. As for therapy at this stage, deep brain stimulation (not suitable for patients with cognitive deficits or dementia) or intestinal infusion of levodopa plus carbidopa (Duodopa®) can be used; subcutaneous application of apomorphine can be implemented exceptionally. We present the case of 63‑year‑old man with advanced PD suffering from late motor and mental complications in whom Duodopa® treatment has been safely used for a long time after the failure of classical pharmacotherapy.
Úvod
Parkinsonova nemoc (PN) je nejčastější poruchou bazálních ganglií. Patologický nález je charakterizován ztrátou dopaminergních neuronů v pars compacta substantiae nigrae a přítomností inkluzí synukleinu ve formě Lewyho tělísek. Braakova teorie z roku 2002 představuje toto onemocnění jako plynule progresivní neurodegenerativní proces, který postupně postihuje řadu mozkových systémů [1]. V terapii PN nastal zlom po zavedení levodopy (L dopa), která je doposud nejúčinnějším lékem a zlatým standardem v léčbě PN.
V prvních letech po stanovení diagnózy PN lze vcelku účinně zvládat motorické symptomy této choroby léčbou dle mezinárodních doporučení [15]. S progresí onemocnění jsme nuceni zvyšovat dávku L dopa a frekvenci podávání či přidat další farmakoterapii (agonisté dopaminu, inhibitory katechol O methyltransferázy, amantadin, rasagilin) [10]. Později se onemocnění rozvíjí do stadia pozdních hybných a psychických komplikací, kdy je dosažení dlouhodobě vyrovnaného stavu již velmi obtížné [1]. Po určité době (zpravidla několika let) se však u většiny pacientů objevují komplikace, které jsou důsledkem specifik farmakokinetiky podávané léčby a pokročilosti základního onemocnění – fluktuace (kolísání) stavu hybnosti, zkrácené trvání účinku jednotlivých dávek léčby (tzv. wearing off), což časem může vyústit ve střídání stavů dobré („on“) a špatné („off“) hybnosti.
Pro zlepšení stavu pacientů v pokročilých komplikovaných stadiích PN máme v současné době prakticky jen dvě terapeutické možnosti, a to hlubokou mozkovou stimulaci (deep brain stimulation, DBS) a Duodopu – intraduodenální infuzní podání L dopa spolu s carbidopou (inhibitorem periferní metabolizace L dopa) cestou perkutánní endoskopické gastrostomie (PEG) pomocí programovatelné pumpy (obr. 1) [5]. Výjimečně lze použít subkutánní podávání apomorfinu. V indikovaných případech hraje DBS velmi významnou roli v léčbě pokročilé PN. Výskyt kognitivní poruchy nebo demence u PN představuje jedno z nejčastějších vylučujících kritérií pro léčbu metodou DBS. U těchto případů, pokud je to možné, volíme léčbu Duodopou.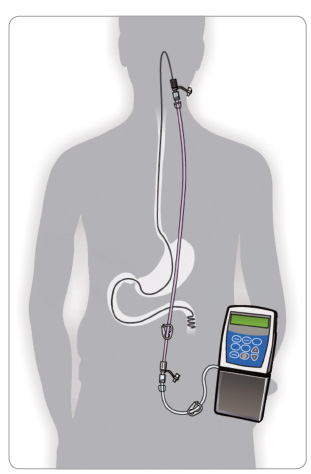
Jedná se o kombinaci L dopa a carbidopy v poměru 4 : 1 v gelové formě (Duodopa), která byla do České republiky zavedena v roce 2008 [13]. Představuje poslední terapeutickou možnost u pacientů, kde je zachována odpověď na léčbu L dopa, ale u nichž je tato léčba provázena těžkými komplikacemi (fluktuace, dyskineze, případně i psychické komplikace PN) [8]. Pokud se tyto komplikace nedaří zvládnout farmakologicky a z různých důvodů nepřichází v úvahu DBS, indikujeme testovací podání Duodopy přes nazojejunální sondu. V případě příznivé odpovědi zavedeme PEG a přes katétr do tenkého střeva programovatelnou pumpou regulujeme dávky přípravku dle individuálních potřeb pacienta. Titrační období trvá zpravidla několik dnů, maximálně 2–3 týdny. Přes noc se přívod léčiva přerušuje a při zhoršení stavu je možnost bolusového navýšení dávky. Ve střevě se L dopa plynule vstřebává, nezávisle na příjmu potravy a na dalších vlivech, což vede k naplnění moderního konceptu kontinuální dopaminergní stimulace. Výsledkem je dobrá stabilizace stavu hybnosti a většinou i zmírnění ostatních, zejména motorických komplikací [10].
Kasuistika
U 63letého muže byla PN diagnostikována podle modifikovaných klinických diagnostických kritérií United Kingdom Parkinson’s Disease Society Brain Bank [4]. V roce 1996 se u něj objevily jako první projevy onemocnění tremor a hypokineze, a to výrazněji na levostranných končetinách. Ve stejném roce byla u spádového neurologa zahájena léčba L dopa. Od dubna 2004 se u pacienta objevily pozdní hybné komplikace typu fluktuací a wearing off, přičemž pacient po celou dobu onemocnění nevykazoval kognitivní deficit a pracoval na řídicí pozici ve státní správě. U pacienta byly také přítomny významné komorbidity: diabetes mellitus 2. typu kompenzovaný inzulinoterapií, arteriální hypertenze a obezita. Při hodnocení testem Mini Mental State Examination (MMSE) v roce 2009 dosáhl pacient skóre 29 bodů; pacient odmítl léčbu DBS a terapie Duodopou byla zahájena v prosinci 2009. Před zahájením léčby pacient užíval kombinaci L dopa/carbidopa 250 mg/25 mg 6–7× 1 tbl. a pramipexol 4× 0,7 mg a trpěl významnými projevy pozdních hybných komplikací, a to zejména typu wearing off, fluktuacemi a dyskinezemi, které jej těžce invalidizovaly. Pacient nereagoval na farmakologické intervence včetně pokusu o snížení dopaminergní medikace, protože byl pozorován dopaminový dysregulační syndrom (Leesův syndrom) pro nepoměr celkových dávek mezi preskribovanou a doporučenou dopaminergní léčbou. V důsledku příznivé klinické odpovědi na aplikovanou léčbu prostřednictvím nazojejunální sondy byla provedena titrace účinné dávky. Duodopa je intestinální gel obsahující kombinaci L dopa a carbidopa (4 : 1) o síle 20 mg/5 mg v 1 ml. Udržovací terapie pokračovala ranní bolusovou dávkou 10,3 ml s následnou udržovací denní dávkou 6,1 ml/h (5–21 hodin), s podáním mimořádné dávky 1 ml a s noční pauzou. U pacienta došlo k velmi významnému celkovému zlepšení stavu, zejména k vymizení stavů „on/off“ a ke zlepšení celkové mobility. Pacient byl nadále schopen práce na plný úvazek a také se významně zlepšila kvalita jeho života. Po dobu pěti let léčby nebyla zaznamenána žádná závažná komplikace. Byla jen opakovaně provedena úprava dávkování, lokální ošetřování PEG a jednou výměna pumpy pro technickou závadu.
Diskuse
Kombinovaná farmakoterapie má u pacientů s pokročilými stupni PN s motorickými komplikacemi často malou účinnost. U pacientů užívajících dlouhodobě L dopa se rozvíjejí typické dyskineze. Snížení dávky L dopa vede k poklesu výskytu dyskinezí, ale je prakticky vždy spojeno se snížením účinnosti léčby. Projevuje se především nárůstem času „off“ (stav zhoršené hybnosti) [10]. Účinek samostatné L dopa je limitován velmi krátkým plazmatickým poločasem (60 minut). Po přidání carbidopy se prodlužuje na 90 minut [7]. Leesův syndrom se typicky rozvíjí u pacientů s dlouhodobou anamnézou užívání dopaminergní medikace (u našeho pacienta již 11 let). Je pro něj charakteristické podávání mnohem vyšších dávek dopaminergních látek, než je nezbytné pro kontrolu motorických příznaků. Dochází tak k rozvoji těžkých dyskinezí a různých poruch chování [6]. Kolísání sérových koncentrací L dopa při perorálním podávání vede k pulsatilní stimulaci dopaminových receptorů v mozku, což spolu s progresí PN vede ke zhoršení pozdních hybných komplikací [9]. Jak již bylo zmíněno výše, pro dosažení významného zlepšení stavu máme v současné době k dispozici dvě terapeutické možnosti: DBS a intestinální gel obsahující kombinaci L dopa a carbidopa. Tyto dvě léčebné možnosti jsou prokazatelně účinné a mají svoje výhody a nevýhody.
Hluboká mozková stimulace je účinná metoda sloužící ke zmírnění motorických příznaků u pacientů, kteří již nejsou dostatečně kompenzováni léčbou antiparkinsoniky. Podle toho, které struktury v bazálních gangliích stimulujeme, dochází k rozdílnému ovlivnění základních příznaků PN. Větší množství kritérií (např. neodpovídavost na terapii L dopa, demence a poruchy poznávacích funkcí, deprese, jiné závažné somatické onemocnění), která vylučují aplikaci DBS, činí tuto možnost léčby dostupnou jen pro vybranou skupinu pacientů. Vzhledem k invazivitě výkonu je nutné zmínit také riziko krvácení či infekce. Vše je minimalizováno pečlivým výběrem pacientů a uvedené riziko činí maximálně 3 % [3]. Při použití DBS se vyskytují také kognitivní a psychické problémy [12].
Duodopa představuje novou možnost léčby L dopa, která zajišťuje stabilní účinnou koncentraci L dopa v séru a vede k významnému omezení výskytu motorických komplikací a ke zvýšení podílu stavu „on“ [11]. Nevýhodou je nutnost zavedení PEG, která je pacienty všeobecně hůře přijímána. V přímém porovnání DBS a Duodopy nalezneme některé technické odlišnosti. Délka „titrace“ léčby je u DBS až několik týdnů oproti dnům při podávání Duodopy. Liší se také invazivitou obou výkonů, technikou kontroly léčby vzhledem k umístění uvnitř těla (DBS) a mimo tělo (Duodopa) [14]. Určitou limitací je dostupnost této léčby pouze ve specializovaných centrech pro léčbu extrapyramidových onemocnění na neurologických klinikách FN Brno, Praha a Olomouc.
Seznam použité literatury
- [1] Antonini A. Continuous dopaminergic stimulation – from theory to clinical practice. Parkinsonism Relat Disord 2007; 13: 24–28.
- [2] Braak H, Del Tredici K, Bratzke H, et al. Staging of the intracerebral inclusion body pathology associated with idiopathic Parkinson’s disease (preclinical and clinical stages). J Neurol 2002; 249 (Suppl 3): 1301–1304.
- [3] Hariz MI. Complication of deep brain stimulation surgery. Mov Disord 2002; 17 (Suppl 3): S162–S166.
- [4] Hughes AJ, Daniel SE, Kilford L, et al. Accuracy of clinical diagnosis of idiopathic Parkinson‘s disease: a clinico‑pathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992; 55: 181–184.
- [5] Kianička B, Žák J, Bareš M. Využití perkutánní endoskopické gastrostomie – přehled indikací, popis techniky a současné trendy v neurologii. Cesk Slov Neurol N 2012; 75/108: 165–169.
- [6] Menšíková K, Nestrašil I, Praško JP. Behaviorální komplikace dopaminergní terapie v pokročilé fázi Parkinsonovy nemoci. Neurol praxi 2013; 14: 92–95.
- [7] Nutt JG, Holford NHG. The response to levodopa in Parkinson´s disease: imposing pharmacological law and order. Ann Neurol 1996; 39: 561–573.
- [8] Nyholm D, Nilsson Remahl AI, Dizdar N, et al. Duodenal levodopa infusion monotherapy vs. oral polypharmacy in advanced Parkinson disease. Neurology 2005; 64: 216–223.
- [9] Obeso JA, Rodriguez‑Oroz M, Marin C, et al. The origin of motor fluctuations in Parkinson‘s disease: importance of dopaminergic innervation and basal ganglia circuits. Neurology 2004; 62: 17–30.
- [10] Olanow CW, Kieburtz K, Odin P, et al.; LCIG Horizon Study Group. Continuous intrajejunal infusion of levodopa‑carbidopa intestinal gel for patients with advanced Parkinson‘s disease: a randomised, controlled, double‑blind, double‑dummy study. Lancet Neurol 2014; 13: 141–149.
- [11] Stocchi F, Olanow CW. Continuous dopaminergic stimulation in early and advanced Parkinson’s disease. Neurology 2004; 62: 56–63.
- [12] Temel Y, Kessels A, Tan S, et al. Behavioural changes after bilateral subthalamic stimulation in advanced Parkinson disease: a systematic review. Parkinsonism Relat Disord 2006; 12: 265–272.
- [13] Vališ M, Taláb R, Waberžinek G, et al. První zkušenosti s kontinuální dopaminergní stimulací u pokročilé Parkinsonovy choroby. Neurol praxi 2008; 9: 179–181.
- [14] Wolters CHE. Deep brain stimulation and continuous dopaminergic stimulation in advanced Parkinson’s disease. Parkinsonism Relat Disord 2007; 13: 18–23.
- [15] Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS‑ES review on therapeutic management of Parkinson’s disease. Eur J Neurol 2013; 20: 5–15.