Komentář ke studii srovnávající dva biosimilární adalimumaby po povinném switchi z originálního přípravku (registr DANBIO)
Souhrn:
Pavelka K. Komentář ke studii srovnávající dva biosimilární adalimumaby po povinném switchi z originálního přípravku (registr DANBIO). Remedia 2022; 32: 201–204.
Biosimilární léky představují bioterapeutické přípravky, které jsou v kategoriích kvality, bezpečnosti a účinnosti podobné referenčnímu originálnímu přípravku. Zásadním přínosem biosimilárních léků je jejich nižší cena oproti originálním lékům. Otázkou je, zda je možné převádět pacienty dlouhodobě léčené originálním lékem na biosimilární přípravek prostřednictvím tzv. switche, aniž by docházelo ke zvýšenému počtu imunopatologických reakcí a k poklesu účinnosti. Důkaz o bezpečnosti switche přinesla v případě infliximabu studie NOR‑SWITCH, v níž byla poprvé použita metodika tzv. mandatorního (nemedicínského) switche. Dánská studie z národního registru DANBIO porovnávala dva biosimilární adalimumaby (GP2017 a SB5) po switchi z originálního adalimumabu u pacientů se zánětlivými revmatickými onemocněními. Primárním cílovým ukazatelem sledování bylo adjustované setrvání na léčbě v průběhu 12 měsíců. Studie potvrdila účinnost a bezpečnost mandatorního switche adalimumabu v běžné klinické praxi registru a rovněž rozdíly mezi dvěma registrovanými biosimilárními adalimumaby.
Summary:
Pavelka K. Commentary to a study comparing two biosimilar adalimumab formulations after a mandatory switch from the original medicine (the DANBIO registry). Remedia 2022; 32: 201–204.
Biosimilar drugs are biotherapeutic products that correspond to the referential original in quality, safety and efficacy. The fundamental benefit of biosimilar drugs is their lower price compared with the original product. The question is whether it is possible to switch patients from long‑term treatment with the original product to a biosimilar drug without increasing the number of immunopathological reactions and decreasing the efficacy. In the case of infliximab, the switch safety was demonstrated by the NOR‑SWITCH study, using the methodology of a so‑called mandatory (non‑medical) switch for the first time. The Danish study based on the national DANBIO registry compared two biosimilar adalimumab formulations (GP2017 and SB5) after switching from the original adalimumab in patients with inflammatory rheumatic disease. The primary monitoring endpoint was adjusted treatment retention in 12 weeks. The study confirmed the efficacy and safety of the mandatory switch of adalimumab in real‑life clinical practice in the registry and the difference between the two registered biosimilar formulations.
Key words: rheumatoid arthritis, rheumatoid inflammatory diseases, adalimumab, biosimilar adalimumab, switch, the DANBIO registry.
Úvod
Biologické chorobu modifikující antirevmatické léky (biologic disease modifying antirheumatic drugs, bDMARDs) znamenaly po svém zavedení do běžné klinické praxe doslova revoluci v léčbě revmatoidní artritidy (RA) a dalších zánětlivých autoimunitních onemocnění. Jejich účinek je robustní, rychlý a docílení remise či stavu nízké aktivity nemoci je realistické pro většinu pacientů. Výrazně zlepšují funkční stav pacientů, kvalitu jejich života, práceschopnost a zpomalují až zastavují rentgenovou progresi RA. Jedním z problémů bDMARDs je přetrvávající vysoká cena léčby.
Po vypršení patentové ochrany bDMARDs byly syntetizovány tzv. biosimilární léky. Biosimilární léky představují bioterapeutické přípravky, které jsou v kategoriích kvality, bezpečnosti a účinnosti podobné již licencovanému referenčnímu originálnímu přípravku, kdy biosimilarita je vymezena jako absence relevantních rozdílů v parametrech zájmu. Průkaz biosimilarity je klíčový a je definován řadou dokumentů. V České republice se považuje za zásadní schválení biosimilárního léku v oblasti s vysokou úrovní regulace, tzn. v praxi Evropskou lékovou agenturou (EMA), americkým Úřadem pro kontrolu potravin a léčiv (FDA), ev. v Japonsku.
Jediným, ale zásadním přínosem biosimilárních léků je jejich nižší cena oproti originálním lékům. Z cenových důvodů může (ale nemusí) být výhodnější zavádět u nových pacientů léčbu levnějším biosimilárním produktem. Nicméně přirozeně vznikla otázka, zda je možné převádět pacienty, kteří jsou dlouhodobě léčeni originálním lékem, na biosimilární přípravek v postupu, pro nějž se vžil název switch, aniž by docházelo ke zvýšenému počtu imunopatologických reakcí (např. k tvorbě protilátek proti léku) a k poklesu účinnosti. Většina referenčních studií s biosimilárními léky měla switch po ukončení dvojitě zaslepené fáze ve svém uspořádání a nebyly zjištěny signály zvýšeného rizika rozvoje nežádoucích účinků. Nicméně jasný vědecký důkaz o bezpečnosti switche přinesla až studie NOR SWITCH. Šlo o nezávislou, vládou podporovanou studii provedenou v Norsku [1]. Do studie byli zařazeni pacienti s RA, ankylozující spondylitidou, psoriatickou artritidou, psoriázou a s idiopatickými střevními záněty. Všichni pacienti byli léčeni v první fázi originálním infliximabem a poté byli (po podepsání informovaného souhlasu) randomizováni do skupiny, která pokračovala v léčbě originálním infliximabem, a do skupiny s léčbou biosimilárním infliximabem (CT P13). Mezi oběma skupinami nebyl zjištěn žádný rozdíl v účinnosti ani ve výskytu nežádoucích účinků. Rovněž nebyl zjištěn vyšší výskyt protilátek proti léku. Studie NOR SWITCH poprvé použila metodiku tzv. nemedicínského switche. Jde o switch, jehož jedinou motivací je snížení nákladů na léčbu. Začal se používat termín povinný (mandatorní) switch, především ve zdravotnických systémech, kde je plná úhrada léčby. Časem se však ukázalo, že mandatorní switch může vyvolávat problémy, a to především při nedostatečné edukaci pacienta a vzniku tzv. nocebo efektu. Řada odborných společností včetně České revmatologické společnosti ČLS JEP doporučuje, aby se nemedicínský switch konal zásadně v ordinaci lékaře a za aktivní účasti pacienta. Dalším problémem je fakt, že zatímco je dostatek dat o účinnosti jednoho, maximálně dvou switchů, údaje o mnohočetných switchích nejsou dostatečné. Nelze proto doporučit, aby pacient střídal často bDMARD s biosimilárními přípravky na základě toho, který lék byl v určité oblasti či systému nasmlouván.
Srovnávací studie dvou biosimilárních
adalimumabů s povinným switchem z originálního
přípravku
Dánská studie srovnávající dva různé biosimilární adalimumaby po switchi z originálního adalimumabu přináší mnoho zajímavých dat. Pochází z dánského registru DANBIO, který je z dlouhodobého hlediska jedním z nejlépe vedených registrů na světě a kvalita jeho dat se blíží randomizovaným klinickým studiím.
Do studie bylo zařazeno celkem 1 380 pacientů, z toho 467 osob s RA, 321 osob s psoriatickou artritidou, 530 osob s ankylozující spondylitidou. Všichni byli léčeni v první fázi originálním adalimumabem [2]. Po podepsání informovaného souhlasu byli převedeni buď na biosimilární přípravek GP2017 (Hyrimoz), nebo na biosimilární přípravek SB5 (Imraldi). Skupiny byly vytvořeny tak, že přípravek GP2017 byl podáván ve východních regionech Dánska a přípravek SB5 v západních regionech. Primárním cílovým ukazatelem studie bylo adjustované setrvání na léčbě v průběhu 12 měsíců. Dalšími cílovými ukazateli byly dosažení remise po šesti měsících, důvody přerušení léčby a eventuální switch na originální přípravek. Je nutné zdůraznit, že vzhledem k plné úhradě biologické léčby pojišťovnami v Dánsku bylo možné switch realizovat jako mandatorní a přirozeně z podstaty věci jako nemedicínský. Bazální demografické charakteristiky a charakteristiky nemoci byly u obou kohort obdobné, i když rozdíly v registraci byly patrné. Pacienti léčení GP2017 byli v průměru starší, měli vyšší aktivitu nemoci a v minulosti užívali více bDMARDs. Celková dvanáctiměsíční míra setrvání na léčbě činila v případě obou biosimilárních léků 89,5 %, což lze považovat za velmi dobrý výsledek. Ve srovnání s přípravkem SB5 bylo riziko přerušení léčby po podávání GP2017 sníženo (poměr rizik [HR] 0,60) a pravděpodobnost remise po šesti měsících byla po léčbě GP2017 zvýšena (poměr šancí [OR] 1,72). Během jednoho roku 8,5 % pacientů léčených GP2017 a 12,9 % pacientů léčených SB5 přerušilo léčbu (primárně z důvodu nedostatku účinnosti, nežádoucích účinků). Rozdíly byly signifikantní pro RA, nikoliv pro psoriatickou artritidu a ankylozující spondylitidu.
Jak výsledky této studie interpretovat? Principiálně potvrzují fakt, že switch z originálního na biosimilární adalimumab v běžné klinické praxi je účinný a bezpečný. Pacienti byli před mandatorním switchem osm let léčeni originálním přípravkem, nicméně výborné výsledky ve smyslu setrvání na léčbě a účinnosti nesvědčí o žádném nocebo efektu. Celkem 9 z 10 pacientů, kteří byli originálním lékem po switchi léčeni v průběhu roku, pokračovalo v terapii a rovněž frekvence remise byly obdobné, takže se žádná negativní očekávání neprojevila.
Jak však interpretovat rozdíly mezi
dvěma biosimilárními adalimumaby? Prvním vysvětlením je to, že
získané výsledky skutečně odrážejí rozdíly mezi oběma
biosimilárními adalimumaby, tzn. mezi přípravky GP2017 a SB5.
Tyto rozdíly mohou například odrážet odlišnou lokální
snášenlivost, která byla lepší po GP2017 a která může
být způsobena např. složením pomocných látek (citrát,
fosfát), aplikátorem a objemem aplikovaného léku. Avšak
vysvětlení může být komplikovanější a může zde působit
celá řada tzv. zavádějících faktorů (confounding factors). Je
nutné mít stále na mysli, že šlo o observační
studii, kde ani lékař, ani pacient nebyli zaslepeni. Navíc ani
v Dánsku nelze vyloučit regionálně mírně odlišné
přístupy k některým aspektům biologické léčby.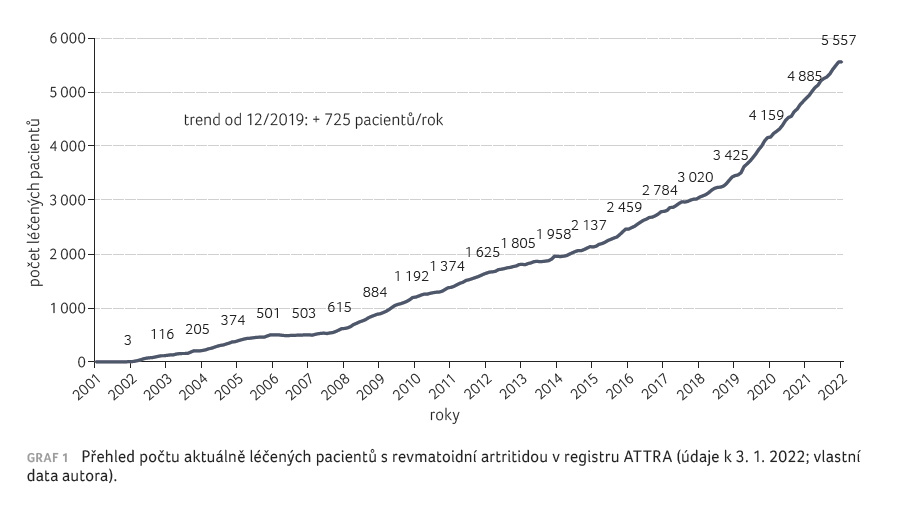
Je také nutné konstatovat, že některé další registry doložily odlišné výsledky. Například studie vycházející ze švédského registru ARTIS ukázala stejné setrvání na léčbě u všech adalimumabů (originálních i biosimilárních) [3]. V této studii bylo více pacientů, avšak jednalo se o první biologický lék, nikoliv o switch.
Závěrem lze tedy říci, že studie potvrdila účinnost a bezpečnost nemedicínského mandatorního switche adalimumabu v běžné klinické praxi registru. Potvrdila také rozdíly mezi dvěma registrovanými biosimilárními adalimumaby. Přežívání na léčbě bylo delší při léčbě přípravkem GP2017 ve srovnání s přípravkem SB5 a dosažení remise bylo při léčbě GP2017 častější. Tyto rozdíly mohou být skutečně způsobeny odlišnostmi mezi jednotlivými přípravky, vliv dalších faktorů ale nelze vyloučit a další studie jsou nutné. Prioritou studie je už fakt srovnání dvou biosimilárních léků v pozici switche v běžné klinické praxi a při nastavení podmínek hodnocení v registru, které se blíží randomizované studii.
Biosimilární adalimumab v ČR
Všichni pacienti užívající bDMARDs
v České republice jsou léčeni v centrech biologické
léčby a jsou zařazováni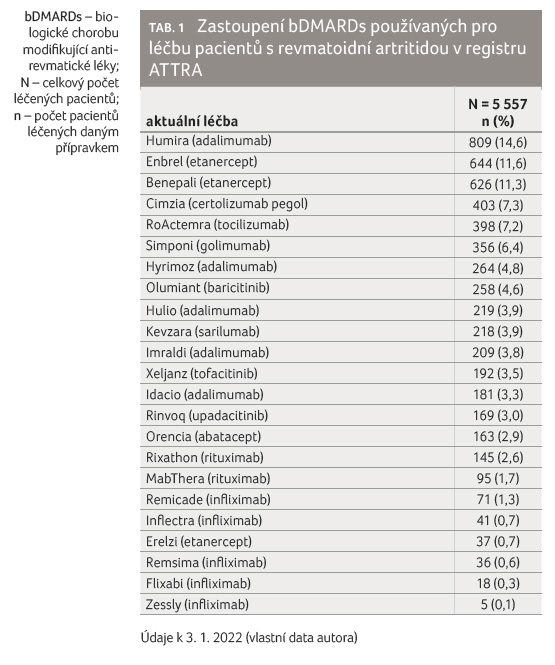 do registru ATTRA. V současné
době je v registru ATTRA aktivně léčeno 5 557 pacientů
s RA. Trendem v posledních třech letech je zvýšení
počtu osob o 725 ročně (graf 1). Co se týče
adalimumabů, podíl pacientů s RA léčených přípravkem
Humira je 14,6 % (809 pacientů), u přípravku Hyrimoz
4,8 % (264 pacientů), u přípravku Hulio 3,9 % (219
pacientů), u přípravku Idacio 3,3 % (181 pacientů),
tabulka 1. Adalimumab je tedy nejvíce používaným
přípravkem proti tumor nekrotizujícímu faktoru alfa (anti TNFα),
biosimilární přípravky tvoří asi 40 % spotřeby adalimumabu.
Analýza switchů ani mandatorních switchů zatím nebyla provedena.
Vyhodnocení přežívání na léčbě a dosažení remise
po jednotlivých biosimilárních lécích a posouzení
farmakoekonomických aspektů léčby je možno provést.
do registru ATTRA. V současné
době je v registru ATTRA aktivně léčeno 5 557 pacientů
s RA. Trendem v posledních třech letech je zvýšení
počtu osob o 725 ročně (graf 1). Co se týče
adalimumabů, podíl pacientů s RA léčených přípravkem
Humira je 14,6 % (809 pacientů), u přípravku Hyrimoz
4,8 % (264 pacientů), u přípravku Hulio 3,9 % (219
pacientů), u přípravku Idacio 3,3 % (181 pacientů),
tabulka 1. Adalimumab je tedy nejvíce používaným
přípravkem proti tumor nekrotizujícímu faktoru alfa (anti TNFα),
biosimilární přípravky tvoří asi 40 % spotřeby adalimumabu.
Analýza switchů ani mandatorních switchů zatím nebyla provedena.
Vyhodnocení přežívání na léčbě a dosažení remise
po jednotlivých biosimilárních lécích a posouzení
farmakoekonomických aspektů léčby je možno provést.
Seznam použité literatury
- [1] Jorgensen KK, Olsen IC, Goll GL, et al. Switching from originator infliximab to biosimilar CT‑P13 compared with maintained treatment with originator infliximab (NOR‑SWITCH): a 52‑week, randomised, double‑blind, non‑inferiority trial. Lancet 2017; 389: 2304−2316.
- [2] Nabi H, Georgiadis S, Loft AG, et al. Comparative effectivness of two adalimumab biosimilars in 1318 real‑world patients with inflammatory rheumatic disease mandated to switch from originator adalimumab: nationwide observational study emulgating a randomised clinical trial. Ann Rheum Dis 2021; 80: 1400−1409
- [3] Di Giuseppe D, Lindstrom U, Bower H, et al. Comparison of treatment retention of originator versus biosimilar product in clinical practice in Sweden. Rheumatol (Oxford) 2021; doi: 10.1093/rheumatology/keab933. Online ahead of print.