Léčba trifluridinem/tipiracilem v indikaci karcinomu žaludku
Souhrn:
Bencsiková B. Léčba trifluridinem/tipiracilem v indikaci karcinomu žaludku. Remedia 2020; 30: 402–404.
Karcinom žaludku je celosvětově pátým nejčastějším nádorovým onemocněním. Epidemiologicky a dle odlišných rizikových faktorů jsou rozlišovány dvě lokalizace: kardiální a nekardiální. Zatímco u západoevropské populace dochází k nárůstu počtu nádorů lokalizovaných do oblasti kardie s převahou výskytu u mužů, v Asii se objevují oba dva typy. V České republice onemocnělo v roce 2014 celkem 11,45 žen/16,27 mužů na 100 000 obyvatel. Paliativní chemoterapie zlepšuje kvalitu života a přežití pacientů s metastatickým karcinomem žaludku ve srovnání s nejlepší podpůrnou léčbou. Třetí a další linie léčby metastatického onemocnění je nutné individualizovat dle celkového stavu pacienta a chemosenzitivity onemocnění. Délka léčby má pravděpodobně vliv na celkové přežití pacientů, nepřímo ji lze odvozovat z výsledků studie RAINBOW, kde asijská populace pacientů dosáhla celkově i ve srovnávacím rameni delšího mediánu celkového přežití (10,5 měsíce v rameni s monoterapií paklitaxelem). Výborný výsledek se přisuzuje právě léčbě následnými liniemi, která je běžná v asijských zemích. Preferována je účast v klinických studiích, dále je možná léčba režimem s docetaxelem, paklitaxelem, irinotekanem, pokud tyto přípravky nebyly použity v předchozích terapeutických liniích.
Summary:
Bencsikova B. Treatment with trifluridine/tipiracil in gastric cancer. Remedia 2020; 30: 402–404.
Gastric cancer is the fifth most common cancer worldwide. From the epidemiological point of view and according to different risk factors, two localizations are distinguished: cardiac and non‑cardiac. In Western Europe, the number of carcinomas located in the cardiac region has been increasing, predominantly in men, both types of localizations are present in Asia. In the Czech Republic, 11.45 women/16.27 men per 100,000 inhabitants got ill in 2014. Palliative chemotherapy improves the quality of life and survival in patients with metastatic gastric carcinoma compared with the best supportive care. Third and further lines in the treatment of metastatic disease should be individualized according to the general health of the patient and disease chemosensitivity. The duration of treatment probably influences overall survival of patients and can be indirectly derived from the results of RAINBOW study. In this study, Asian population of patients achieved both in total and in the comparison arm longer median of overall survival (10.5 months in the paclitaxel monotherapy treatment arm). Excellent result is ascribed to the treatment with further lines, as it is usual in Asian countries. Participation in clinical trials if preferred, furthermore, treatment regimen with docetaxel, paclitaxel and irinotecan is possible, if these medicinal products had not been used in the previous therapeutic lines.
Key words: trifluridine/tipiracil – metastatic gastric cancer – chemotherapy.
Úvod
Karcinom žaludku je celosvětově pátým nejčastějším zhoubným nádorem. Převážná většina pacientů má již pokročilé nebo metastatické onemocnění v době stanovení diagnózy a jejich prognóza je špatná. V posledních letech došlo k prodloužení přežití pacientů s metastatickým onemocněním použitím kombinace standardních cytostatik s mediánem přežití (median overall survival, mOS) přibližně 12 měsíců. V případě HER2 (humánní epidermální receptor 2) pozitivity bylo dosaženo kombinací chemoterapie a trastuzumabu přežití až 16 měsíců. Ve druhé linii léčby metastatického onemocnění je účinný ramucirumab v kombinaci s chemoterapií. Léčebné možnosti u pacientů již předléčených alespoň dvěma režimy jsou zatím omezené.
Trifluridin/tipiracil (Lonsurf) byl
původně schválen pro léčbu metastatického kolorektálního
karcinomu ve třetí a vyšší linii léčby.
V září 2019 schválila Evropská léková agentura
(EMA) novou indikaci pro přípravek Lonsurf. Trifluridin/tipiracil
je tak možné využít v monoterapii k léčbě dospělých
pacientů s metastazujícím karcinomem žaludku
včetně
adenokarcinomu gastroezofageální junkce, kteří byli dříve
léčeni alespoň dvěma režimy systémové terapie pro pokročilé
stadium onemocnění. Trifluridin/tipiracil tak přináší důležité
rozšíření léčebných možností a další zlepšení
prognózy pro pacienty.
Klinická studie TAGS
Podle výsledků multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované klinické studie fáze III TAGS (TAS 102 Gastric Study) přípravek TAS 102 (trifluridin/tipiracil, FTD/TPI; Lonsurf®) prodlužuje OS u předléčených pacientů s metastazujícím karcinomem žaludku (metastatic gastric cancer, mGC).
Trifluridin/tipiracil známý jako TAS 102 je novým perorálním tymidinovým analogem (FTD) a inhibitorem tymidinfosforylázy (TPI) v poměru 1 : 0,5. Trifluridin představuje aktivní protinádorovou komponentu, která je inkorporována do nádorové DNA. Tipiracil inhibuje tymidinfosforylázu, enzym degradující FTD, udržuje přiměřenou koncentraci FTD v plazmě a tím potencuje jeho protinádorový účinek.
Do studie fáze III TAGS bylo zařazeno celkem 507 pacientů s mGC a karcinomem gastroezofageální junkce refrakterních na standardní léčbu dvěma a více režimy s fluoropyrimidinem, platinovým derivátem, taxanem, irinotekanem a HER2 inhibitorem v případě HER2 pozitivního nádoru. Klinická studie probíhala ve 110 nemocnicích 17 zemí. Pacienti měli výkonnostní stav (Eastern Cooperative Oncology Group performance status, ECOG PS) 0 nebo 1. Primárním cílovým ukazatelem studie bylo OS a sekundární cílové ukazatele zahrnovaly přežití bez progrese (progression free survival, PFS), bezpečnost, dále celkový počet odpovědí na léčbu (overall response rate, ORR), míru kontroly choroby (disease control rate, DCR), kvalitu života, čas do zhoršení ECOG PS ≥ 2. Stratifikace pacientů proběhla na základě ECOG PS (0 vs. 1), regionu (Japonsko vs. zbytek světa) a předléčenosti ramucirumabem.
Pacienti byli randomizováni v poměru 2 : 1 do ramene s FTD/TPI (n = 337) nebo do ramene s placebem (n = 170). Kombinace FTD/TPI byla podávána v dávkách 35 mg/m2 p.o. dvakrát denně 1.–5. den a 8.–12. den z 28denního cyklu.
Průměrný věk pacientů léčených
FTD/TPI činil 64 let (24–89 let), japonských pacientů bylo
celkem 14 %. Převažoval výkonnostní stav ECOG PS 1 (64 %).
Primární lokalizace nádoru byla u 71 % pacientů léčených
FTD/TPI v oblasti žaludku a u 29 % pacientů
v oblasti gastroezofageální junkce. Předcházející
gastrektomii podstoupilo 44 % nemocných. Počet absolvovaných
režimů u pacientů léčených FTD/TPI byl následující –
dvě linie absolvovalo 37 % osob, tři linie 40 % osob
a čtyři nebo více režimů 23 % osob. Podaná léčba
zahrnovala ve skupině pacientů léčených FTD/TPI:
fluoropyrimidin (> 99 % pacientů), platinu (100 %
pacientů), irinotekan (54 % pacientů), taxan (92 % pacientů),
ramucirumab (34 % pacientů), anti HER2 léčbu (18 %
pacientů), imunoterapii protilátkami proti receptoru programované
buněčné smrti 1 a jeho ligandu (anti PD 1/PD L1;
7 % pacientů).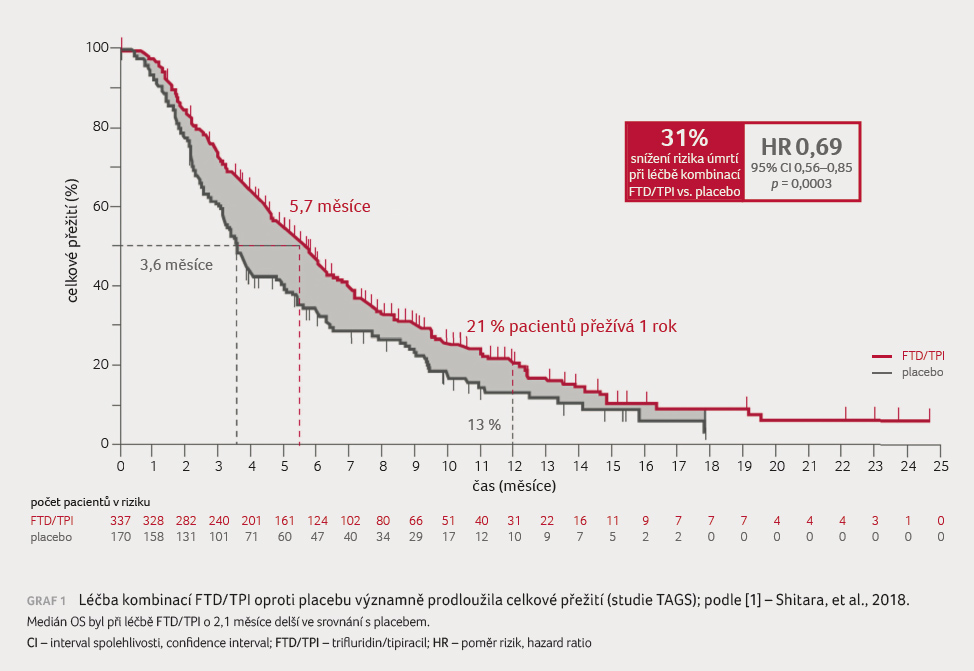
Medián OS u pacientů léčených FTD/TPI dosáhl 5,7 měsíce vs. 3,6 měsíce u pacientů léčených placebem (poměr rizik [HR] 0,69; 95% interval spolehlivosti [CI] 0,56–0,85; p = 0,0003). Ve 12. měsíci stále žilo ze skupiny léčené FTD/TPI 21 % pacientů, v placebové skupině pouze 13 % osob (graf 1).
Medián PFS dosáhl ve skupině s léčbou FTD/TPI 2,0 měsíce versus 1,8 měsíce ve skupině placeba (HR 0,57; 95% CI 0,47–0,70; p < 0,0001). Potvrdilo se tedy, že léčba prodloužila období PFS, kdy kontroly nad onemocněním bylo dosaženo u 44 % pacientů léčených FTD/TPI. Výsledky studie doložily, že léčba FTD/TPI je spojena s klinicky a statisticky významným prodloužením OS a se snížením rizika úmrtí o 31 % [1].
Toxicita léčby kombinací FTD/TPI byla očekávaná a dobře zvládnutelná podpůrnou terapií. Stupeň ≥ 3 nežádoucích účinků se vyskytl u 79 % pacientů léčených FTD/TPI a u 58 % pacientů léčených placebem. Nejčastějšími nehematologickými nežádoucími účinky všech stupňů u nemocných ve skupině s FTD/TPI byly nevolnost (37 %), nechutenství (34 %), únava (25 %) a průjem (23 %). Stupeň ≥ 3 hematologických nežádoucích účinků se vyskytoval ve skupině pacientů léčených FTD/TPI: neutropenie (38 %), anémie (19 %), lymfocytopenie (19 %), trombocytopenie (6 %). Febrilní neutropenie byla hlášena u šesti pacientů (2 %) ze skupiny s FTD/TPI.
Účinnost kombinace FTD/TPI byla potvrzena napříč všemi skupinami pacientů, včetně nemocných s předchozí gastrektomií u mGC nebo u karcinomu v oblasti gastroezofageální junkce a nemocných bez gastrektomie. Nebyly zaznamenány významné rozdíly v koncentraci léčiva v séru mezi pacienty s gastrektomií nebo bez ní [2].
Neméně důležitou skutečností je, že kvalita života byla zachována v průběhu studie u většiny funkčních a symptomatických hodnocení (graf 2). Léčba kombinací FTD/TPI významně prodlužuje medián doby do zhoršení výkonnostního stavu podle ECOG o 1,4 měsíce (3,7 měsíce při léčbě FTD/TPI vs. 2,3 měsíce při užívání placeba).
Díky dosavadním výsledkům se tak
FTD/TPI stává nově schválenou klinicky ověřenou možností
třetí linie léčby pacientů s mGC a s karcinomem
gastroezofageální junkce [3].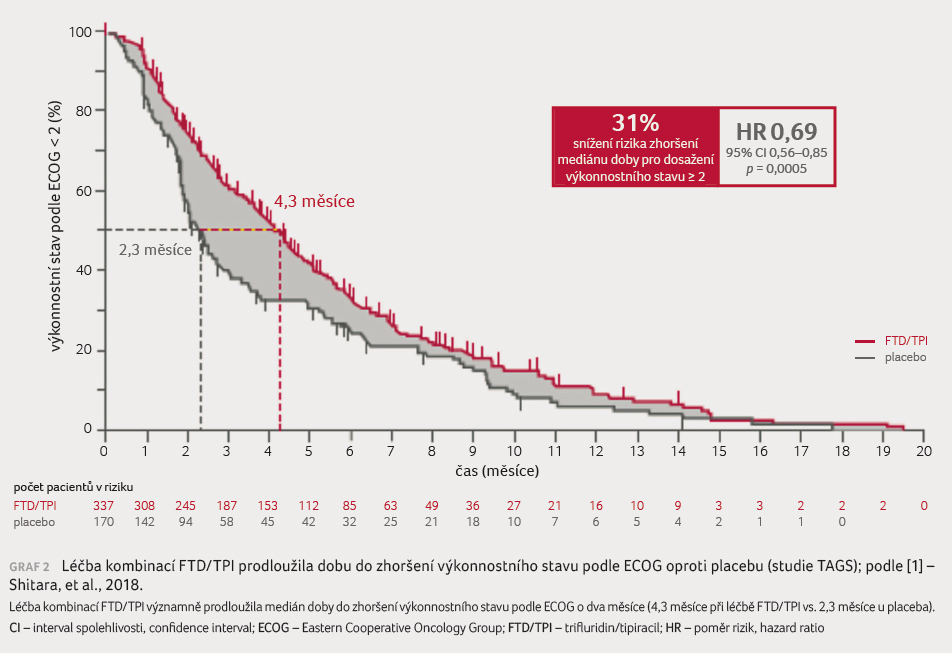
Závěr
Trifluridin/tipiracil dává nemocným s mGC šanci na prodloužení přežití i doby do progrese nemoci. Rovněž prodlužuje dobu do zhoršení celkového výkonnostního stavu. Léčba FTD/TPI snížila riziko úmrtí o 31 % (HR 0,69; 95% CI 0,56–0,85; p = 0,0003). Medián OS se zlepšil o 2,1 měsíce (5,7 měsíce vs. 3,6 měsíce). Nežádoucí účinky byly ve shodě se známým profilem přípravku popsaným u pacientů s metastatickým kolorektálním karcinomem. K nejčastějším patřily myelosuprese a gastrointestinální příhody. Nežádoucí účinky lze zvládnout úpravou dávky a podpůrnou léčbou, bez vážnější alterace kvality života.
V některých zemích je pro třetí linii léčby schválena imunoterapie anti PD 1. První byl pembrolizumab ve Spojených státech amerických u PD L1 pozitivních onemocnění, nádorů s vysokou mikrosatelitovou nestabilitou (MSI H). Druhou schválenou imunoterapii představuje nivolumab v Japonsku.
Bezpečnostní profil FTD/TPI se od novějších léčiv jiných skupin odlišuje. Ramucirumab, inhibitor vaskulárního endotelového růstového faktoru schválený pro druhou a vyšší linii léčby, je spojen s rizikem vzniku krvácení, perforace gastrointestinálního traktu, hypertenze, tromboembolie. Imunoterapie přináší imunitně podmíněné, někdy závažné dlouhodobé nežádoucí účinky. Léčba FTD/TPI je spojena spíše s krátkodobými řešitelnými nežádoucími příhodami.
Trifluridin/tipiracil představuje účinnou léčebnou alternativu se zvládnutelným bezpečnostním profilem u těžce předléčených pacientů s mGC.
Seznam použité literatury
- [1] Shitara K, Doi T, Dvorkin M, et al. Trifluridine/tipiracil versus placebo in patients with heavily pretreated metastatic gastric cancer (TAGS): a randomized, double‑blind, placebo‑controlled, phase 3 trial. Lancet Oncol 2018; 19: 1437–1448.
- [2] Ilson DH, Tabernero J, Prokharau A, et al. Efficacy and safety of trifluridine/tipiracil treatment in patients with metastatic gastric cancer who had undergone gastrectomy: subgroup analyses of a randomized clinical trial. JAMA Oncol 2019; 6: e193531.
- [3] Tabernero J, Shitara K, Dvorkin M, et al. Overall survival results from a phase III trial of trufluridine/tipiracil versus placebo in patients with metastatic gastric cancer refractory to standard therapies (TAGS). Ann Oncol 2018; 29(Suppl 5): v122–v123.