Manifestace Crohnovy choroby na perineu pod obrazem perineální sepse
Recidivující komplikované píštěle perinea s vícečetnými choboty jsou často první manifestací Crohnovy nemoci (CD) v zažívacím traktu, zejména u mladých lidí. Izolovaná perineální forma CD je méně frekventní. Pro kožní formu CD je patognomický nález nekaseózního granulomatózního zánětu kůže s obrovskými mnohojadernými buňkami typu z cizích těles, ale granulomy jsou přítomny jen u 21–60 % pacientů s CD. Naše kazuistika popisuje případ 53letého muže, kuřáka, u něhož po revaskularizační cévní operaci na dolních končetinách (DK) propukla chronická perineální sepse, která byla komplikována nekrotizující fasciitidou s těžkou devastací perineogenitální krajiny. Chronická sepse byla i příčinou opakovaných reinfekcí cévních štěpů na DK, které vedly k amputaci pravé DK. Vzhledem k normálnímu nálezu při endoskopickém vyšetření i při vyšetření pomocí zobrazovacích metod včetně enteroklýzy se v diferenciální diagnóze uvažovalo o purulentní hidradenitidě (HS) nebo aktinomykóze u imunokompromitovaného pacienta. Příčinou chronické sepse byla nerozpoznaná perineální forma CD. Diagnóza byla stanovena z excidované kůže perinea před plánovanou autologní transplantací perineogenitální krajiny. Ve světovém písemnictví jsme našli nejméně 13 prací, které popisují koincidenci CD a HS, s dobrým efektem po léčbě inhibitorem TNF-a. U obou chorob (CD a HS) se uvažuje o některých společných etiopatogenetických mechanismech poruchy regulace imunity na perineu.
Úvod
Crohnova nemoc (CD) je chronický nespecifický zánět střeva tenkého, tlustého nebo obou, segmentální nebo plurisegmentální, transmurální, v typických případech granulomatózní [1]. Perianální CD je jednou z forem systémové manifestace tohoto onemocnění. Perianální CD zahrnuje postižení anu a perianální oblasti. Anální píštěl může předcházet i o několik let střevní manifestaci onemocnění. Je nutno myslet na toto onemocnění u pacientů hospitalizovaných na jiných odděleních (chirurgických, gynekologických, očních) [1].
Popis případu
Muž 53 let, vyučený vodoinstalatér, pracoval jako zedník, kuřák 20 cigaret denně, ženatý. AA: Negativní. RA: Otec zemřel v 87 letech stářím, matka žije, jeden bratr trpí onemocněním pohybového aparátu (artróza), 2 děti zdravé. Od roku 1994 až do roku 2000 byl nemocný sledován na kožní ambulanci okresní nemocnice pro dermatitidu pravého bérce v terénu varixů, kterou dermatolog hodnotil jako benigní, byla vyloučena bakteriální i mykotická infekce. V dubnu 1995 nemocný prodělal operaci křečových žil na obou dolních končetinách. Od roku 1996 klaudikační bolesti v pravém lýtku s rychle se zhoršujícím klaudikačním syndromem obou dolních končetin. V září roku 2000 se na pravé dolní končetině (PDK) znovu objevily vinuté varixy, pigmentovaná kůže, nehmatné pulzace na periferních tepnách. Levá dolní končetina (LDK) byla bez otoku, bez známek zánětu. Nemocný měl hmotnost 95 kg, výšku 176 cm. V laboratorním nálezu byla zaznamenána FW 45/h, v krevním obraze mírná leukocytóza 12,70 x 109, hemoglobin 132 g/l, triacylglyceroly 4,02 mkat/l, celkový cholesterol 7,2 mmol/l. Při aortoarteriografii DK (27. 10. 2000) byla zjištěna významná stenóza v AIC vlevo v délce 10 mm, uzávěr AFS ve střední třetině. Vpravo uzávěr AFS v odstupu. Pro ICHDK III. st. indikována cévním chirurgem rekonstrukční cévní operace na obou DK. Po předchozím interním vyšetření 2. 10. 2000 byl proveden proximální femoropopliteální bypass vpravo, protéza byla subfasciálně protažena až do třísla. Dne 8. 10. 2000 pacient propuštěn do domácího léčení. Rekonstrukční cévní operaci LDK, tj. proximální ilikopopliteální bypass, nemocný podstoupil dne 13. 4. 2001. Operace byla komplikována abscesem v oblasti jizvy na levém stehně. V květnu 2001 se objevil absces nad levým kolenem, který byl ošetřen ambulantně incizí a lokální aplikací Betadine. Nemocný se cítil unavený, v popředí obtíží bylo nechutenství, artralgie obou kotníků a úbytek hmotnosti o 10 kg během jednoho roku. Jizvy po rekonstrukční cévní operaci na obou dolních končetinách byly zhojeny. Obě dolní končetiny byly chladnější, ale bez trofických změn. V laboratorním screeningu dominovala vysoká FW 130/h, leukocytóza, hypochromní mikrocytární anémie s HB 87 g/l, která se prohlubovala, reaktivní trombocytóza (PLT 300–415 x 109), vysoké hodnoty CRP 110–285 mg/l, známky katabolismu (urea 3,5 mmol/l, kreatinin v séru 53 mmol/l, albumin 22,0 g/l, hemokultura z krve byla opakovaně pozitivní s nálezem Staphylococcus aureus po pomnožení. Nemocný byl krátce hospitalizován na interním oddělení spádové nemocnice. Dne 22. 6. 2001 pod obrazem těžké chronické sepse s podezřením na hematogenní infekci obou cévních protéz byl pacient přijat na chirurgické oddělení Nemocnice Milosrdných sester sv. Karla Boromejského (NMSKB). Arteriografie obou DK potvrdila neprůchodnost cévních protéz. Při operační revizi (27. 6. 2001) na pravé dolní končetině byla cévní protéza obturována zánětlivými hmotami, anastomózy rozvolněny. Protéza byla odstraněna a nahrazena distálním ilikopopliteálním bypassem a protažena mimo infikované pole. Vlevo byly známky infekce jen na konci protézy, proto byla provedena její reinzerce. Vzhledem k tomu, že zdroj sepse nebyl jasný, všechny kožní vstupy po cévních operacích byly zhojeny, nemocný podstoupil řadu vyšetření.
Při ultrazvukovém vyšetření břicha byla zjištěna jen mnohočetná cholecystolitiáza v intaktním žlučníku a zvětšená aktivovaná slezina (140 x 65 mm). Horní endoskopie a kolonoskopie až do terminálního ilea vyloučila jeho postižení. Perianální krajina byla klidná, tonus zevního svěrače přiměřený. Při imunologickém vyšetření byla zjištěna aktivace humorální imunity především ve třídě IgG (28,8 g/l), pozitivní C-ANCA protilátky (protilátky proti cytoplazmě neutrofilních leukocytů) metodou ELISA a vysoká hladina CD4 T lymfocytů. Imunolog upozornil na možnost autoimunní vaskulitidy. Od 4. 7. 2001 si nemocný stěžoval na silné bolesti v oblasti konečníku. Při anoskopii byl zjištěn absces v intergluteální rýze a píštěl na šourku. Akutní stav byl řešen exkochleací abscesu a incizí píštěle na skrotu. Při bakteriologickém vyšetření hnisavého sekretu byl vykultivován Staphylococcus aureus a po pomnožení Pseudomonas aeruginosa a Klebsiella pneumoniae. Při histologickém vyšetření z ulcerací byly nalezeny jen sekundárně zánětlivé změny sinus pilonidalis. V hlubokém podkoží poblíž hnisavé kolikvace v drobném ložisku dlaždicobuněčná výstelka až obraz pseudoepiteliózní hyperplazie. Opakované reinfekce cévních protéz při chronické perineální sepsi si vyžádaly další operační intervence cévním chirurgem (9. 7., 12. 7., 15. 7., 20. 7., 5. a 6. 8. 2001) s odstraněním koagul z ilikofemorálního bypassu vpravo Fogartyho katétrem. Bohužel na pravé dolní končetině se vyvinula ischemická nekróza a 9. 3. 2001 musela být provedena amputace v proximální jedné třetině stehna. Levou dolní končetinu se podařilo zachránit. Při histologickém vyšetření resekátu cév z PDK byly nalezeny vazivové a ateromatózní pláty a rozsáhlé kalcifikace, byla zastižena i fragmentovaná elastica interna. V roce 2002 byl nemocný opakovaně hospitalizován, stav byl hodnocen jako recidivující purulentní perineogenitální hydradenitida s extenzí do inguin a na pravé stehno. Dne 25. 11. 2002 při vyšetření anorekta byly zjištěny mnohočetné vzájemně komunikující píštěle s řídkou hnisavou sekrecí.
 Píštěle byly řešeny pomocí drenáže a aplikace antibiotik (vankomycin, cefotaxim, teikoplanin, sulperazon, gentamicin, ampicilin, linkomycin, ciprofloxacin, metronidazol). Anémie byla řešena transfuzemi erytrocytární masy, sekundární trombofilie suplementací trombinu a mražené plazmy. V pooperačním průběhu byl pacient zajištěn podáváním antikoagulačních dávek LMWH (frakcionovaného heparinu) v dávce 200 j/kg. Důvodem dalších hospitalizací na chirurgickém oddělení byla chronická purulentní perineogenitální hydradenitida. V listopadu 2004 při EUA (vyšetření anorekta v celkové anestezii) byly znovu konstatovány mnohočetné komunikující píštěle
Píštěle byly řešeny pomocí drenáže a aplikace antibiotik (vankomycin, cefotaxim, teikoplanin, sulperazon, gentamicin, ampicilin, linkomycin, ciprofloxacin, metronidazol). Anémie byla řešena transfuzemi erytrocytární masy, sekundární trombofilie suplementací trombinu a mražené plazmy. V pooperačním průběhu byl pacient zajištěn podáváním antikoagulačních dávek LMWH (frakcionovaného heparinu) v dávce 200 j/kg. Důvodem dalších hospitalizací na chirurgickém oddělení byla chronická purulentní perineogenitální hydradenitida. V listopadu 2004 při EUA (vyšetření anorekta v celkové anestezii) byly znovu konstatovány mnohočetné komunikující píštěle 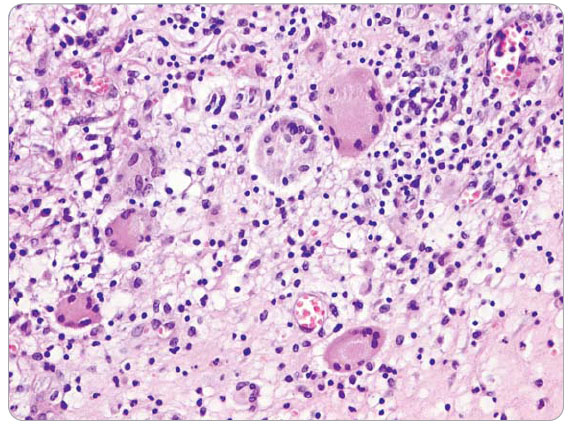 v podkoží perianální, perineální a skrotální krajiny. Anální kanál byl hladký, v místě linea dentata drobná píštěl s hnisavou sekrecí. Píštěle byly chirurgicky ošetřeny. I přes veškerou léčbu přetrvávala hnisavá sekrece z mnohočetných píštělí s těžkým poškozením perineogenitální krajiny, která byla řešena založením derivační sigmoideostomie 11. 4. 2006. Po založení se podařilo zvládnout chronickou sepsi, ale přetrvávaly rozsáhlé perineogenitální kožní defekty. Po docílení negativních výsledků z kožních stěrů a následné konzultaci s plastickým chirurgem byla plánována autologní transplantace kůže perinea. Před tímto výkonem byla znovu provedena EUA dne 11. 9. 2006, při které byla snesena hypovitální tkáň se širokou excizí do zdravé tkáně. Při histologickém vyšetření byla ve
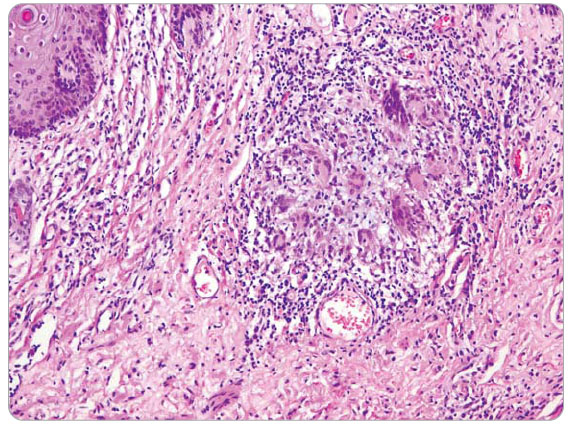
v podkoží perianální, perineální a skrotální krajiny. Anální kanál byl hladký, v místě linea dentata drobná píštěl s hnisavou sekrecí. Píštěle byly chirurgicky ošetřeny. I přes veškerou léčbu přetrvávala hnisavá sekrece z mnohočetných píštělí s těžkým poškozením perineogenitální krajiny, která byla řešena založením derivační sigmoideostomie 11. 4. 2006. Po založení se podařilo zvládnout chronickou sepsi, ale přetrvávaly rozsáhlé perineogenitální kožní defekty. Po docílení negativních výsledků z kožních stěrů a následné konzultaci s plastickým chirurgem byla plánována autologní transplantace kůže perinea. Před tímto výkonem byla znovu provedena EUA dne 11. 9. 2006, při které byla snesena hypovitální tkáň se širokou excizí do zdravé tkáně. Při histologickém vyšetření byla ve 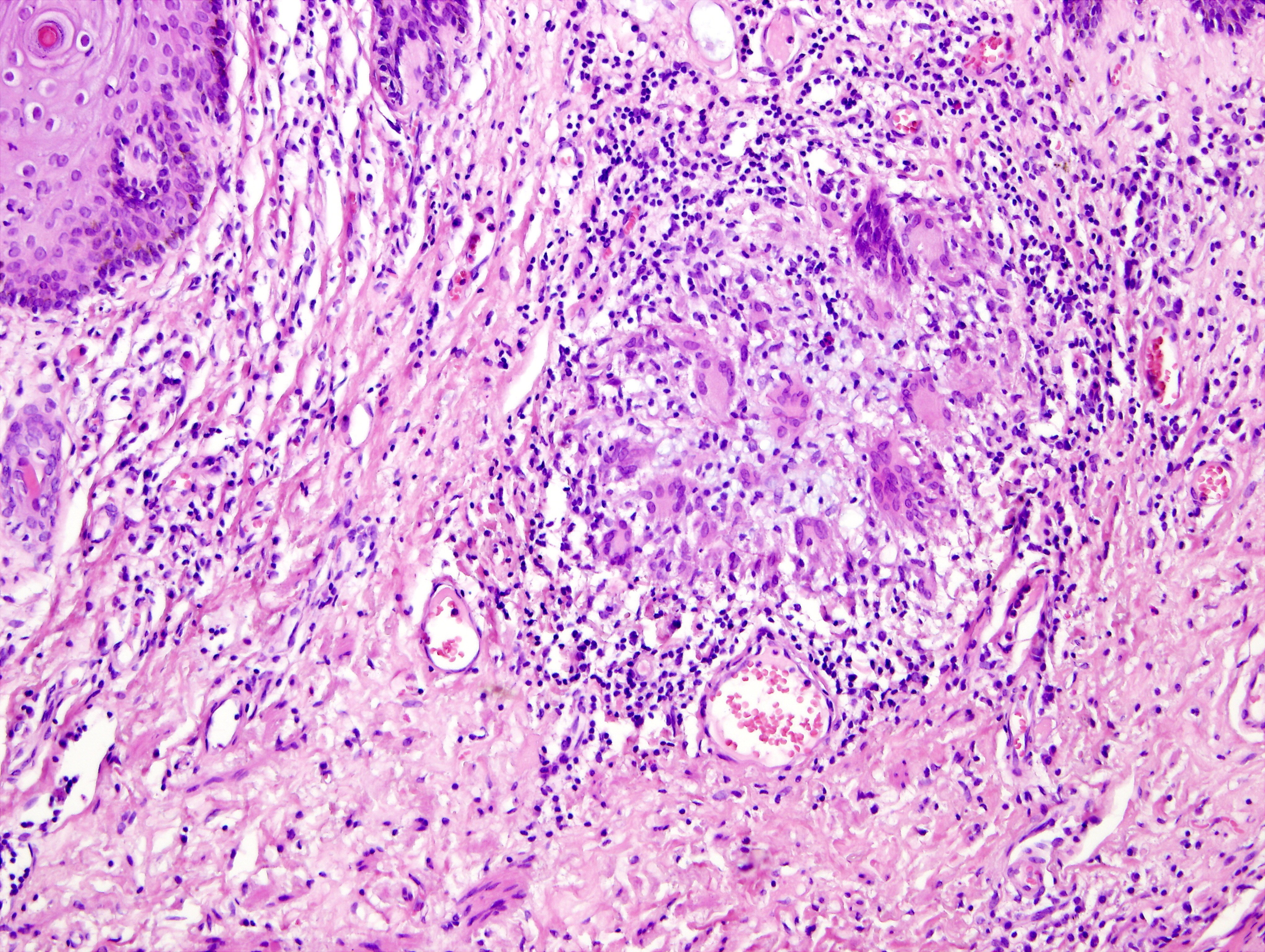 4 vzorcích zachycena kůže a podkoží s chronickým fibroproduktivním zánětem, denzními lymfoidními infiltráty s epiteloidními granulomy a obrovskými mnohojadernými buňkami typu z cizích těles. Nález odpovídal Crohnově nemoci kůže perinea, viz obr. 1 2 3 (doc. MUDr. Chlumská). V době od 26. 9. 2006 do 5. 10. 2006 byl pacient poprvé hospitalizován na interním oddělení NMSKB kvůli stagingu Crohnovy choroby a zvážení biologické léčby infliximabem. Při přijetí nemocný vážil 65 kg. Pacient byl depresivní, afebrilní, bledý, bez ikteru a cyanózy, kůže bez eflorescencí. Játra a slezina nebyly zvětšeny, klidná sigmoideostomie v levém dolním kvadrantu břicha. Pravá dolní končetina po amputaci v proximální jedné třetině stehna, pahýl klidný.
4 vzorcích zachycena kůže a podkoží s chronickým fibroproduktivním zánětem, denzními lymfoidními infiltráty s epiteloidními granulomy a obrovskými mnohojadernými buňkami typu z cizích těles. Nález odpovídal Crohnově nemoci kůže perinea, viz obr. 1 2 3 (doc. MUDr. Chlumská). V době od 26. 9. 2006 do 5. 10. 2006 byl pacient poprvé hospitalizován na interním oddělení NMSKB kvůli stagingu Crohnovy choroby a zvážení biologické léčby infliximabem. Při přijetí nemocný vážil 65 kg. Pacient byl depresivní, afebrilní, bledý, bez ikteru a cyanózy, kůže bez eflorescencí. Játra a slezina nebyly zvětšeny, klidná sigmoideostomie v levém dolním kvadrantu břicha. Pravá dolní končetina po amputaci v proximální jedné třetině stehna, pahýl klidný.
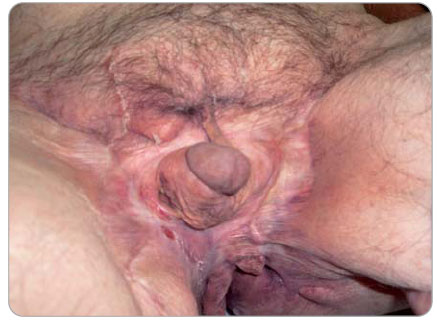 LDK po amputaci palce a 2. prstu, kůže bez trofických změn. V okolí genitálu, v obou inguinách, na skrotu, v horní třetině stehna, na perineu a v anogenitální rýze rozsáhlý kožní defekt s hladkou spodinou a mírnou serózní sekrecí. Celý penis bez kožního krytu, s obnaženou uretrou. Při laboratorním vyšetření FW 65/h, hemoglobin 110 g/l, hodnota CRP činila 98,3 mg/l, vysoké hodnoty ASCA (protilátky proti Saccharomyces cerevisiae): IgG 200 kU/l a IgA 250 kU/l, t-transglutamináza a ANCA protilátky negativní, albumin 40 g/l. Endoskopické vyšetření zažívacího traktu bylo doplněno o enteroklýzu s normálním nálezem na tenkém a tlustém střevě. V oblasti perinea jen několik drobných, klidných píštělí. Kultivace stěrů z kožních defektů byly opakovaně negativní. Při hematologickém vyšetření nebyla prokázána dosud známá hereditární trombofilie. Onemocnění bylo diagnostikováno jako
LDK po amputaci palce a 2. prstu, kůže bez trofických změn. V okolí genitálu, v obou inguinách, na skrotu, v horní třetině stehna, na perineu a v anogenitální rýze rozsáhlý kožní defekt s hladkou spodinou a mírnou serózní sekrecí. Celý penis bez kožního krytu, s obnaženou uretrou. Při laboratorním vyšetření FW 65/h, hemoglobin 110 g/l, hodnota CRP činila 98,3 mg/l, vysoké hodnoty ASCA (protilátky proti Saccharomyces cerevisiae): IgG 200 kU/l a IgA 250 kU/l, t-transglutamináza a ANCA protilátky negativní, albumin 40 g/l. Endoskopické vyšetření zažívacího traktu bylo doplněno o enteroklýzu s normálním nálezem na tenkém a tlustém střevě. V oblasti perinea jen několik drobných, klidných píštělí. Kultivace stěrů z kožních defektů byly opakovaně negativní. Při hematologickém vyšetření nebyla prokázána dosud známá hereditární trombofilie. Onemocnění bylo diagnostikováno jako 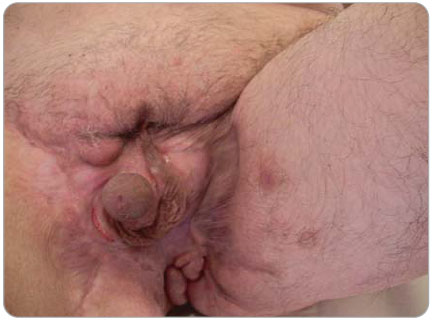 perianální forma Crohnovy nemoci komplikovaná perineální sepsí a nekrotizující fasciitidou s hnisavou infekcí cévních protéz na obou DK. U nemocného byla zahájena indukční léčba infliximabem v dávce 5 mg/kg a mesalazinem v dávce 3 g denně, píštěle byly kontrolovány chirurgem. Po ukončení indukční léčby ustala sekrece z obnažených ploch, objevily se známky granulace. Za 24 měsíců od zahájení léčby infliximabem jsme konstatovali téměř úplné zhojení kožního defektu perianogenitální krajiny (obr.4 a 5). Od září 2006 nebyla nutná hospitalizace a u pacienta se nevyskytly žádné intestinální ani extraintestinální komplikace.
perianální forma Crohnovy nemoci komplikovaná perineální sepsí a nekrotizující fasciitidou s hnisavou infekcí cévních protéz na obou DK. U nemocného byla zahájena indukční léčba infliximabem v dávce 5 mg/kg a mesalazinem v dávce 3 g denně, píštěle byly kontrolovány chirurgem. Po ukončení indukční léčby ustala sekrece z obnažených ploch, objevily se známky granulace. Za 24 měsíců od zahájení léčby infliximabem jsme konstatovali téměř úplné zhojení kožního defektu perianogenitální krajiny (obr.4 a 5). Od září 2006 nebyla nutná hospitalizace a u pacienta se nevyskytly žádné intestinální ani extraintestinální komplikace.
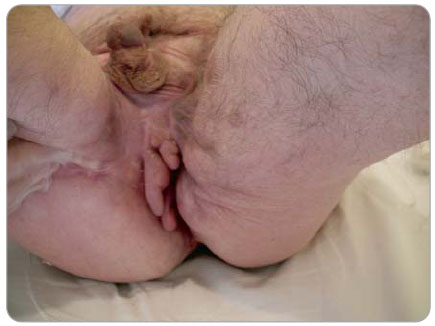 Při kontrolní hospitalizaci v dubnu 2009 se hmotnost pacienta stabilizovala na 84 kg. V biochemickém screeningu byly všechny hodnoty v normě. Při CT enterografii s normálním nálezem na kličkách tenkého střeva a colon, pouze v oblasti intergluteální rýhy se nedá vyloučit reziduální perianální píštěl. Při
Při kontrolní hospitalizaci v dubnu 2009 se hmotnost pacienta stabilizovala na 84 kg. V biochemickém screeningu byly všechny hodnoty v normě. Při CT enterografii s normálním nálezem na kličkách tenkého střeva a colon, pouze v oblasti intergluteální rýhy se nedá vyloučit reziduální perianální píštěl. Při 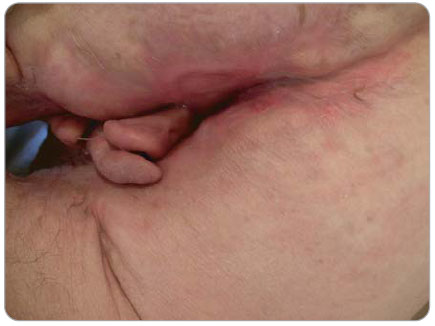 irigografii nebyl zaznamenán únik kontrastní látky mimo lumen, presakrální prostor volný, zevní svěrač je atonický. EUS (endoskopická ultrasonografie) pacient odmítl. Nemocný i nadále užívá mesalazin v dávce 3,0 g/den a infliximab ve standardní dávce 5 mg/kg v intervalech po 8 týdnech. Při této léčbě bylo dosaženo plné klinické, laboratorní a endoskopické remise onemocnění (obr.6 a 7).
irigografii nebyl zaznamenán únik kontrastní látky mimo lumen, presakrální prostor volný, zevní svěrač je atonický. EUS (endoskopická ultrasonografie) pacient odmítl. Nemocný i nadále užívá mesalazin v dávce 3,0 g/den a infliximab ve standardní dávce 5 mg/kg v intervalech po 8 týdnech. Při této léčbě bylo dosaženo plné klinické, laboratorní a endoskopické remise onemocnění (obr.6 a 7).
Diskuse
Mimostřevní manifestace idiopatických střevních zánětů (IBD), ve světovém písemnictví označovaná jako systémová, doprovází průměrně 21–35 % případů IBD. Nejčastější jsou kloubní, méně časté pak kožní a oční projevy choroby. Perianální manifestace předchází intestinální formě ve 4–10 %, u jedné třetiny pacientů onemocnění vzplane v průběhu jednoho roku, u dvou třetin nemocných během pěti let. Perianální postižení může být i jediným symptomem onemocnění. Postižení perinea se nejčastěji vyskytuje u pacientů s kolickou (zejména při postižení rekta) nebo ileokolickou formou CD [2–4]. Galandiuk a kol. provedli statistickou analýzu perianálního postižení celkem u 356 nemocných léčených pro CD v období let 1986–1997. Perianální postižení bylo zjištěno u 24 % pacientů, onemocnění bylo častější u žen, a to až v 57 % u pacientek ve věku 20–40 let a až 87 % mělo jednu a více perirektálních píštělí; 44 % mělo anální píštěle a 41 % žen mělo rektovaginální píštěle [3].
U perianální CD jsou primární léze omezeny na endoanální kůži, dále na přechodný epitel análního kanálu a pokračují 1–2 cm na sliznici rekta. Fisury análního kanálu jsou velmi často benigní a klinicky asymptomatické. Vznikají zánětlivé kožní přívěsky typu sloních uší. Typické jsou hluboce větvené píštěle otevřené do análního kanálu. Ve většině případů dochází k poškození zevního svěrače a k inkontinenci plynů a později i stolice. Kožní ulcerace jsou neobyčejně agresivní a mohou postihnout celou perineogenitální oblast, u mužů skrotum a u žen vaginu [5]. V diagnostice kromě anamnézy, klinického obrazu, endoskopického vyšetření zažívacího traktu a vyšetření pomocí zobrazovacích metod EUS, MRI, CT má důležité místo také vyšetření rekta chirurgem v EUA doplněné o histologické vyšetření kůže perinea [16]. Pro izolované formy perianální CD je patognomický nález nekaseózního granulomatózního zánětu kůže s obrovskými mnohojadernými buňkami typu z cizích těles. U perianální formy CD byla identifikována nová varianta genu OCTN (Organic Cation Transporter), sdruženého s perianální a fistulující CD. Tento gen je lokalizován na lokusu IBD-5 [7]. Podle nejnovějších genetických studií podporuje dysregulaci imunitních odpovědí na perineu. Do diferenciální diagnostiky je důležité zahrnout širokou škálu perianálního postižení, jako je perianální sepse u neadekvátně léčené purulentní hydradenitidy, ulcerózní kolitidu, sarkoidózu, tuberkulózu a další choroby a lokální infekce [6].
Purulentní hydradenitida (HS) je stafylokokový zánět potních žláz lokalizovaný v axilách, inguinách a na perineu. Při postižení aberantní potní žlázy se může vyskytnout i v análním kanálu. U CD mohou anální léze chybět, nebo mohou být zhojeny, u jedné čtvrtiny pacientů chybí granulomatózní zánět [8]. Jeho přítomnost naopak svědčí o vysoké aktivitě onemocnění. Vyšetření anu v EUA ukáže anální léze jen u jedné čtvrtiny pacientů. Při pohledu na perianální léze u CD jsou ulcerace hluboké, hojí se retrahovanými jizvami a jsou ohraničeny na perianální oblast, u těžkých případů zasahují i skrotum, slabiny a proximální část stehen [5]. Koincidence HS a CD je častější u nemocných kuřáků, častěji postihuje ženy. Na kůži těla mají komedony a přemosťující jizvy [9–11].
Nejvýznamnějším přínosem této kazuistiky pro klinickou praxi je poučení o nutnosti hledat kauzální příčinu, která je zodpovědná za přetrvávající symptomatologii pacienta. V našem případě to byla kožní forma Crohnovy nemoci s chronickou perineální sepsí, která byla i příčinou bakteriální superinfekce cévních protéz na obou DK. Přestože nemocný dostával adekvátní antikoagulační léčbu nízkomolekulárním heparinem, antibiotika a chirurgickou léčbu včetně derivační sigmoideostomie, chronická perineální sepse při neznalosti vyvolávající příčiny vedla k těžkému poškození genitofemorální krajiny. Sekundární trombofilie a vaskulitida byly příčinou opakovaných arteriálních trombóz na PDK a nakonec amputace PDK [12, 13]. Rozhodujícím vyšetřením byla široká excize z kůže před plánovanou autologní transplantací a histologické vyšetření zkušeným histopatologem.
Léčba perianální Crohnovy nemoci je komplexní (chirurgická, medikamentózní a nutriční). Léčba perineální sepse spočívá v časné adekvátní drenáži píštělí [16]. V medikamentózní léčbě mají důležité místo antibiotika (metronidazol, ciprofloxacin), imunosupresiva a biologická léčba [14–16]. U našeho pacienta byla indikována biologická léčba inhibitorem TNF-a s dobrým efektem na hojení kožních a slizničních defektů. Léčba inhibitorem TNF-a urychluje uzavření píštělí a oddaluje poškození zevního svěrače. Cílem léčby je zachování kontinence a dobré kvality života. I přesto si onemocnění u 10–20 % pacientů vyžádá stomii a proktektomii. Frekvence proktektomií na Klinice Mayo dosáhla 8,4 % u pacientů s onemocněním trvajícím nanejvýš 10 let a 17,5 % u nemocných s délkou trvání onemocnění do 20 let. Obnovení kontinuity střeva pak nastalo pouze u 9,5–21 % nemocných [11].
Závěr
Dlouhodobé podávání infliximabu u našeho pacienta udržuje onemocnění v remisi a významně zlepšilo kvalitu jeho života. Ze zpětného pohledu je škoda, že příčina perineální sepse byla objasněna až za 6 let po jejím propuknutí a biologická léčba zahájena až po vzniku závažných komplikací.
Seznam použité literatury
- [1] Mařatka Z, et al. Gastroenterologie. Nakladatelství Karolinum 1999; 22: 247–255.
- [2] Bernstein CN, Blanchard JF, Rawsthorne P, et al. The prevalence of extraintestinal diseases in inflammatory bowel disease: A population-based study. Am J Gastroenterol 2001; 96: 1116–1122.
- [3] Galandiuk S, Kimberling J, Al-Mishlab TG, Stromberg AJ. Perianal Crohn disease: predictors of need for permanent diversion. Ann Surg 2005; 241: 796–801.
- [4] Joyce M, O' Connell PR. Perianal Crohn’s Disease. Societa` Italiana di Chirurgia ColoRettale. www.siccr.org 2006, 12: 98–104.
- [5] Seksis G. Hidradenitis suppurativa and Crohn’s disease by Gregor B. E. Jemec, Chapter 7, Page 50–55. Published 2006.
- [6] Mortimer PS. Hidradenitis suppurativa – diagnostic criteria. Acne and Related Disorders. Marks R, Plewig G (Eds), 1st ed, Martin Dunitz Ltd, London 1989. p 359.
- [7] Armuzzi A, Ahmad T, Ling KL, et al. Genotype-phenotype analysis of the Crohn’s disease susceptibility haplotype on chromosome 5q31. Gut 2003; 52: 1133–1139.
- [8] Molnar TL, Tiszlavicz L, Gyulai C, et al. Clinical significance of granuloma in Crohn's disease. World J Gastroenterol 2005; 11: 3118–3121.
- [9] Roussomoustakaki M, Philippos D, Chatzicostas C, et al. Hidradenitis suppurativa asociated with Crohn’s disease and spondyl-arthropathy. Response to anti-TNF therapy. J Gastroenterol 2003; 38: 1000–1004.
- [10] Gower-Rousseau C, Maunoury V, Colombel JF, et al. Hidradenitis suppurativa and Crohn's disease in two families: a significant association? Am J Gastroenterol 1992; 87: 928.
- [11] Martinez F, Nos P, Benlloch S, et al. Hidradenitis suppurativa and Crohn's disease: response to treatment with infliximab. Inflammatory Bowel Disease 2001; 7: 323–326.
- [12] Twig G, Zandman-Goddard G, Szyper-Kravitz M, et al. Systemic thromboembolism in inflammatory disease. Ann N Y Acad Sci 2005; 1051: 166–173.
- [13] Gross WL, Trabandt A, Reinhold-Keller E. Diagnosis and evaluation of vasculitis. Rheumatology 2000; 39: 245–252.
- [14] Lukáš M, Ďuricová D, Bortlík M, et al. Biologická terapie idiopatických střevních zánětů, doporučené postupy. Pracovní skupina pro idiopatické střevní záněty ČGS. http://www.cgs-cls.cz/cps/rde/ xchg/cgscls/ xsl/index_20894.html?init=y
- [15] Zbořil Z. Infliximab v klinické léčebné praxi. Klin Farmakol Farm 2005; 19: 67–71.
- [16] Schwarts DA. Sesion II. Perianal disease and fistulae in Crohn's disease. Fifth annual advances in the Inflammatory Bowel Diseases. December 1–3, 2006, Miami Florida.