Mepolizumab – roční zkušenost s léčbou
Souhrn:
Voláková E. Mepolizumab – roční zkušenost s léčbou. Remedia 2019; 29: 505–511.
Asthma bronchiale představuje i počátkem 21. století globální problém. Důvodem je celosvětově rostoucí prevalence onemocnění, nedostupnost základních léků na astma v některých částech světa, ale také těžké refrakterní astma, které se základní antiastmatickou terapií nedaří stabilizovat. Poznání zánětlivé podstaty onemocnění a souvisejících imunopatogenetických pochodů umožnilo vývoj terapie cílené na mediátory zánětlivé odpovědi. V posledním roce je pozornost upřena zejména na interleukin 5 (IL‑5), mediátor s klíčovou rolí v patogenezi těžkého eozinofilního astmatu. Realitou se stala možnost terapie hned několika monoklonálními protilátkami nepřímo či přímo ovlivňujícími aktivitu receptoru pro IL‑5 na povrchu eozinofilu. Jednou z nich, která získala jako první v České republice úhradu, je mepolizumab. Přídatná biologická léčba astmatu je indikována s cílem snížení počtu exacerbací a redukce dávek udržovací perorální kortikoterapie. Biologickou léčbu mepolizumabem je možné indikovat a podávat po splnění indikačních kritérií v některém z center Národního centra pro těžké astma. V centru při Klinice plicních nemocí a tuberkulózy FN Olomouc bylo v roce 2019 léčeno mepolizumabem celkem 17 pacientů. Zaznamenali jsme velmi dobrou účinnost této přídatné terapie u pacientů s těžkým eozinofilním astmatem splňujících indikační kritéria k léčbě.
Summary:
Volakova E. Mepolizumab – a year‑long experience with treatment. Remedia 2019; 29: 505–511.
At the beginning of the 21st century, bronchial asthma represents a global problem. The reason is the increasing prevalence of the disease world‑wide, unavailability of basic medication for asthma in certain parts of the world and severe refractory asthma that cannot be stabilized with basic anti‑asthmatic therapy. The understanding of the inflammatory character of the disease and the associated immunopathogenic processes enabled the development of therapy targeted at the mediators of inflammatory response. In the last year the attention has been focused particularly on interleukin 5 (IL‑5), a mediator with a key role in the pathogenesis of severe eosinophilic asthma. The opportunity of therapy with several types of monoclonal antibodies indirectly or directly influencing the activity of IL‑5 receptor on the surface of eosinophil has become real. One of them is mepolizumab that acquired reimbursement in the Czech Republic as the first. Add‑on biological therapy of asthma is indicated with the goal of lowering the number of exacerbations and dose reduction of maintenance peroral corticotherapy. Biological therapy with mepolizumab can be indicated and administered after satisfying the indication criteria in one of the centers of National Center for Severe Asthma. In 2019, in total of 17 patients have been treated with mepolizumab at the Clinic of Pulmonary Diseases and Tuberculosis of the Faculty Hospital in Olomouc. We have recorded high efficacy of this add‑on therapy in patients with severe eosinophilic asthma satisfying the indication criteria for treatment.
Key words: severe asthma, eosinophilic asthma, biological therapy, mepolizumab, interleukin 5.
Úvod
Poznání zánětlivé podstaty bronchiálního astmatu položilo základ pro rozvoj nových, účinnějších léků, které změnily průběh nemoci i prognózu pacientů s astmatem. Základem terapie se od 70. let minulého století staly inhalační kortikosteroidy (IKS). V zemích, kde jsou tyto léky dobře dostupné, je dnes převážná většina astmatiků účinně léčena. Přesto asthma bronchiale zůstává, nejen kvůli narůstající prevalenci zejména v dětských věkových skupinách, globálním problémem. Cílem léčby bronchiálního astmatu je dosažení tzv. kontroly nad nemocí. Tento pojem v sobě zahrnuje absenci současných symptomů a prevenci budoucího rizika exacerbací, které jsou nejrizikovějším faktorem mortality na astma. Zvýšená pozornost je dnes věnována zejména malé skupině astmatiků, u nichž se nedaří dosáhnout kontroly nad nemocí ani vysokými dávkami IKS, často v kombinaci s jinými léky. Astma těchto pacientů označujeme jako těžké, k léčbě refrakterní, často také kortikodependentní, když lze přijatelné kontroly nad nemocí dosáhnout pouze udržovací perorální kortikoterapií. Dlouhodobá systémová kortikoterapie (SKS) však i u astmatických pacientů přináší řadu metabolických a jiných komplikací. Dle poslední revize doporučení Globální iniciativy pro astma (Global Initiative for Asthma, GINA 2019) představují pacienti s těžkým refrakterním astmatem asi 3,7 % všech astmatiků a náklady na péči o ně spojené s medikací, lékařskými kontrolami a hospitalizacemi, včetně nákladů na léčbu komplikací dlouhodobé systémové kortikoterapie, jsou podle některých britských studií vyšší než náklady na péči o pacienta s diabetem 2. typu, cévní mozkovou příhodou či chronickou obstrukční plicní nemocí. Podle kanadské studie náklady na péči o těžké astmatiky představují 60 % celkových nákladů na péči o astmatické pacienty [1].
Světová a česká doporučení pro léčbu bronchiálního astmatu
Nově vyvíjené léky pro tyto pacienty vycházejí z poznání
imunopatogeneze astmatu a cílí na mediátory zánětlivé
odpovědi. Jde o monoklonální protilátky a tato terapie
je známa jako tzv. biologická léčba, ačkoliv termín „cílená
terapie“ je přesnější. Nesourodost imunopatogenetických dějů,
které jsou zapojeny do rozvoje a udržování chronického
zánětu u astmatických pacientů, se stala základem pro
fenotypovou klasifikaci astmatu coby heterogenního onemocnění.
Český Doporučený postup pro diagnostiku a léčbu
bronchiálního astmatu nahlíží na fenotypovou klasifikaci astmatu
prizmatem přítomnosti alergie a eozinofilie (tab. 1) [2]. Pro oba typy eozinofilního astmatu (alergický
i nealergický) je charakteristický Th2 typ zánětlivé
odpovědi, pro non eozinofilní typ astmatu naopak non Th2
typ zánětlivého procesu. Globální iniciativa pro astma, založená
v roce 1993, každoročně od roku 2002 aktualizuje svá
doporučení na základě nových poznatků evidence based
medicine. U pacientů s těžkým refrakterním astmatem,
u kterých se nedaří dosáhnout kontroly nad nemocí pomocí
vysokých dávek IKS v kombinaci s dlouhodobě působícími
beta2 agonisty (long acting beta2
agonists, LABA) či s další přídatnou medikací, jednoznačně
v poslední revizi (GINA 2019) doporučuje zahájit cílenou
terapii na základě fenotypového hodnocení před zahájením
(ev.) udržovací systémové kortikoterapie. V České
republice spadají indikace a vedení této terapie
do kompetencí některého z center Národního centra pro
těžké astma (NCTA) při plicních a alergologických
odděleních napříč republikou.
Biologická terapie u pacientů s astmatem
Rok 2018 se stal pro pacienty s těžkým astmatem průlomovým. Po zhruba deseti letech biologické léčby jedinou monoklonální protilátkou ‒ omalizumabem (anti IgE), určeným k léčbě těžkého alergického astmatu ‒ se stávají dostupnými nová biologická léčiva, tentokrát pro nemocné s těžkým eozinofilním astmatem. Jde o monoklonální protilátky, které cílí na interleukin 5 (IL 5), tedy cytokin s klíčovou rolí v diferenciaci a zrání eozinofilů (mepolizumab, reslizumab), čí přímo na receptor pro IL 5 na povrchu eozinofilu (benralizumab).
Mepolizumab je humanizovaná monoklonální IgG1 protilátka vyráběná na ovariálních buňkách čínských křečíků rekombinantní DNA technologií. Váže se na IL 5 a znemožňuje tak jeho vazbu na alfa podjednotku receptoru pro IL 5 na povrchu eozinofilu. Tím je snížena biologická aktivita IL 5 a blokován jeho účinek na dozrávání a diferenciaci eozinofilu.
Účinnost a bezpečnost mepolizumabu
Účinnost a bezpečnost terapie mepolizumabem byla hodnocena v několika randomizovaných klinických studiích. Studie MENSA, DREAM a COLUMBA hodnotily vliv terapie mepolizumabem na četnost exacerbací [3‒5]. Ve studii MENSA došlo k poklesu počtu klinicky významných exacerbací při terapii mepolizumabem v dávce 100 mg subkutánně o 53 % ve srovnání s placebem v průběhu sledování po dobu 32 týdnů (0,81 vs. 1,75 exacerbace; p < 0,001). Podobný výsledek byl zaznamenán také ve studii DREAM, kde v průběhu 52týdenního sledování byla četnost exacerbací u pacientů léčených mepolizumabem nižší o 51 % ve srovnání s placebovou větví (1,07 vs. 2,18 exacerbace). Primárním cílem dalších studií bylo prokázat tzv. kortikoid šetřící efekt terapie mepolizumabem při zachování stupně kontroly u pacientů s těžkým eozinofilním astmatem. Ve studii SIRIUS bylo randomizováno 135 pacientů starších 12 let s těžkým astmatem podstupujících udržovací terapii SKS po dobu nejméně šesti měsíců před vstupem do studie, přičemž průměrná udržovací denní dávka SKS odpovídala ekvivalentu 5‒35 mg prednisonu. Přítomnost eozinofilního zánětu byla hodnocena stanovením počtu eozinofilů v periferní krvi a byla vyžadována hodnota nejméně 300 eozinofilů/μl periferní krve zachycená v posledních 12 měsících před první studijní návštěvou. Z vyřazovacích kritérií nutno zmínit aktivní kuřáctví s historií kouření 10 balíčkoroků a více a taktéž terapii omalizumabem zahájenou nejméně 130 dnů před screeningem. Přidání mepolizumabu ke standardní léčbě snížilo statisticky významně udržovací dávku SKS v porovnání s placebem, bez zhoršení kontroly nad astmatem (p = 0,008). U více než poloviny pacientů (54 %) byla denní dávka SKS snížena o 50 % a více (p = 0,03) a u stejného počtu pacientů byla denní dávka SKS snížena na méně než 5 mg prednisonu denně [6]. Navazující otevřené studie COSMOS a COSMEX prokázaly dlouhodobý, prakticky trvalý efekt terapie mepolizumabem na redukci denní dávky SKS, přičemž s přibývající délkou léčby v průběhu sledování (po dobu celkem 4,5 roku) vzrostl počet nemocných, u nichž se podařilo podávání SKS přerušit [7,8]. Podobně jako prokázala studie COSMEX dlouhodobý efekt na redukci SKS, doložila studie COLUMBA dlouhodobý efekt terapie mepolizumabem na redukci počtu exacerbací. Studie MUSCA hodnotila přínos terapie mepolizumabem ke zlepšení kvality života posuzované pomocí standardizovaných dotazníků ‒ St George’s Respiratory Questionnaire (SGRQ), Asthma Control Questionnaire (ACQ) ‒, přičemž prokázala přínos léčby mepolizumabem také k signifikantnímu zlepšení kvality života [9]. Všechny studie současně potvrdily dobrý bezpečnostní profil terapie mepolizumabem, a to i v dlouhodobém sledování. Nejčastěji hlášenými nežádoucími účinky léčby byly bolest hlavy a lokální reakce v místě aplikace – otok, bolest, zarudnutí.
Praktické zkušenosti s léčbou mepolizumabem
Mepolizumab je v České republice dostupný pro dospělé pacienty s těžkým refrakterním eozinofilním astmatem jako přípravek Nucala inj., s úhradou od 1. září 2018. Léčbu je možné zahájit u pacientů s nedostatečně kontrolovaným astmatem při terapii vysokými dávkami IKS v kombinaci s přídavnou antiastmatickou léčbou, kteří dodržují zákaz kouření a současně prodělali v průběhu 12 měsíců před zahájením aplikace mepolizumabu nejméně čtyři těžké exacerbace, případně užívají perorální kortikosteroidy v ekvivalentu 5 mg prednisonu denně po dobu nejméně šest měsíců před zahájením terapie mepolizumabem. Exacerbace musejí být zaznamenány ve zdravotní dokumentaci. Jako těžká exacerbace astmatu je hodnocena ta, která vyžaduje podání SKS či navýšení jejich dávky pro zhoršení astmatických obtíží s trváním po dobu nejméně tří dnů. Pacienti indikovaní k terapii mepolizumabem musejí mít současně dokumentovanou periferní eozinofilii v hodnotě nejméně 300 eozinofilů/μl periferní krve. U nemocných s dlouhodobou perorální kortikoterapií je vyžadována odpovídající periferní eozinofilie dokumentovaná v období 12 měsíců před zahájením této terapie. Hodnocení účinnosti léčby se provádí po 12 měsících, přičemž je potřeba terapii ukončit u pacientů, u nichž nedojde k 50% redukci počtu exacerbací či k významnému poklesu dávky SKS při zachované kontrole astmatu.
V centru při Klinice plicních nemocí a tuberkulózy ve Fakultní nemocnici Olomouc jsme v roce 2019 mepolizumabem léčili celkem 17 pacientů. Jeden z těchto pacientů je takto léčen již od roku 2012, kdy byla u něho terapie zahájena v rámci klinického hodnocení a následně bylo pokračování v terapii možné v rámci open label hodnocení. U dalších 16 pacientů byla tato terapie zahájena na základě splnění indikačních kritérií v období mezi listopadem 2018 až červnem 2019.
Charakteristika sledovaného souboru pacientů a průběh terapie
V našem souboru pacientů převažovali muži (10) nad
ženami (7). Průměrný věk pacientů byl 56,8 roku (42–71 let).
Průměrný body mass index (BMI) činil 27,2 (17–37). U třetiny
pacientů byla terapie mepolizumabem indikována pro čtyři a více
exacerbací v posledním roce, u téměř poloviny pacientů
to byla udržovací terapie SKS, zbývající pětina pacientů
vykazovala 2‒4 exacerbace i přes dlouhodobou terapii SKS
(graf 1).
V prvních měsících převažovala indikace z důvodu
dlouhodobé perorální kortikoterapie. Byli to pacienti, jimž před
příchodem anti IL 5 cílené terapie nebylo možné
nabídnout jinou alternativu ke snížení počtu exacerbací.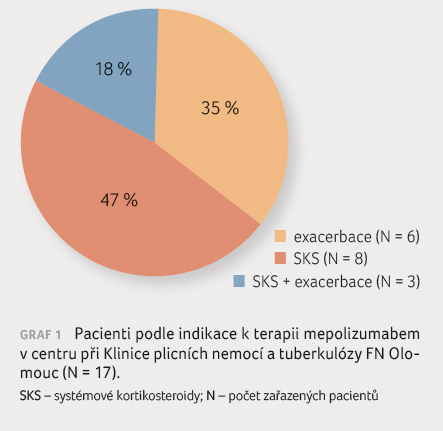
Nemocní v souboru byli léčeni průměrnou dávkou SKS odpovídající ekvivalentu 11,8 mg prednisonu (5–25 mg) denně. U exacerbujících nemocných byly zaznamenány v průměru 4,4 těžké exacerbace v posledních 12 měsících před zahájením terapie (2–11 exacerbací). Méně než čtyři exacerbace se objevily u nemocných současně léčených SKS, jež byly rozhodujícím kritériem pro indikaci k zahájení terapie mepolizumabem. Průměrná hodnota eozinofilů před zahájením terapie činila 642 (330–1 170)/μl periferní krve.
Dle očekávání a v souladu s výsledky
klinických hodnocení byl při terapii mepolizumabem zaznamenán
pokles periferní eozinofilie, a to asi desetinásobný –
celkově na 65 (10–130) eozinofilů/μl periferní krve
(graf 2).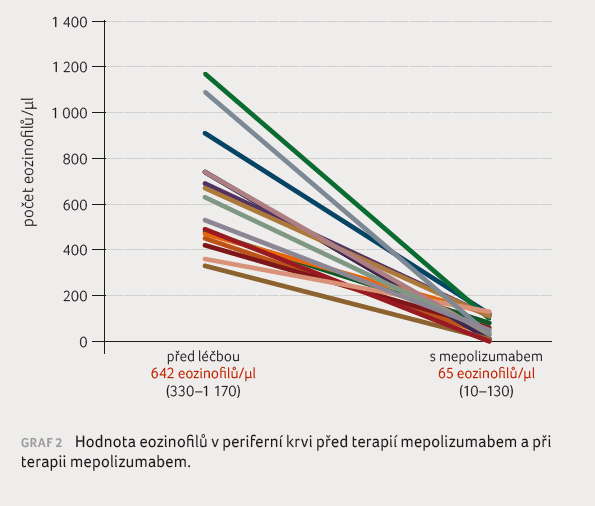
U všech pacientů došlo ke klinickému zlepšení,
ačkoliv systematické hodnocení pomocí některého
ze standardizovaných dotazníků není k dispozici. U 15
pacientů z celkového počtu 17 léčených došlo po zahájení
terapie ke zlepšení ventilačních hodnot. Hodnoceným
parametrem byl objem vzduchu vydechnutý v průběhu první
sekundy usilovného výdechu (forced expiratory volume, FEV1).
U většiny pacientů zůstala tato hodnota navýšena
i v dalších měsících. Ve srovnání s předchozím
obdobím byla zaznamenána také nižší intraindividuální
variabilita FEV1, což lze považovat za projev
stabilizace astmatu (graf 3).
U nemocných léčených dlouhodobou perorální kortikoterapií
se při léčbě mepolizumabem podařilo dávku SKS zredukovat
na průměrné 3,0 mg (0–10 mg) prednisonu denně, přičemž
u šesti z celkového počtu 11 p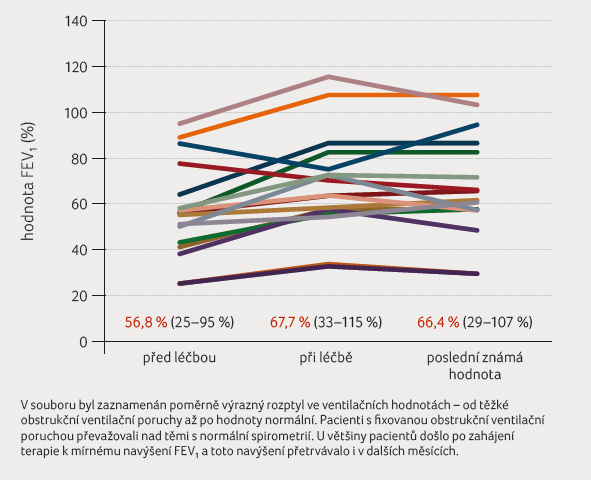 acientů bylo podávání
SKS ukončeno. U pacientů i nadále léčených SKS
poklesla jejich průměrná denní dávka při terapii mepolizumabem
na 6,5 mg (2,5–10 mg) prednisonu (graf 4).
acientů bylo podávání
SKS ukončeno. U pacientů i nadále léčených SKS
poklesla jejich průměrná denní dávka při terapii mepolizumabem
na 6,5 mg (2,5–10 mg) prednisonu (graf 4).
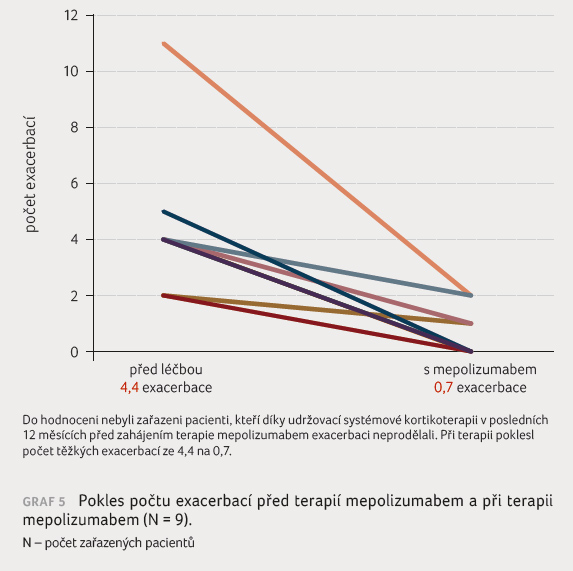
Pokud jde o hodnocení vlivu terapie mepolizumabem na počet
exacerbací, u více než poloviny pacientů (5 z 9) před
léčbou opakovaně exacerbujících nebyla při terapii
mepolizumabem zaznamenána žádná exacerbace,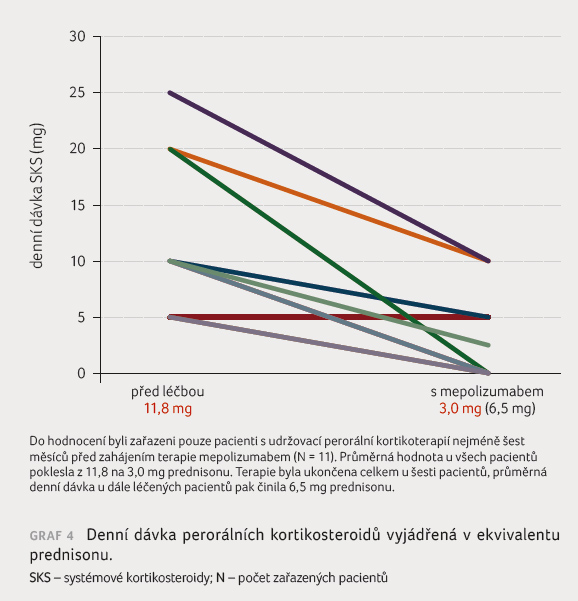 u zbývajících
čtyř pacientů to bylo průměrně 1,5 exacerbace. Celkově počet
exacerbací poklesl z průměrných 4,4 těžké exacerbace
během 12 měsíců před zahájením terapie na průměrných
0,7 exacerbace při terapii mepolizumabem (graf 5). Je však nutno poznamenat, že ne všichni nemocní
byli v době hodnocení léčeni mepolizumabem 12 měsíců
a počet těžkých exacerbací při terapii mepolizumabem se
ještě může změnit, i když nepředpokládáme změnu
významnou. Exacerbace při terapii mepolizumabem měly mírnější
průběh ve srovnání s exacerbacemi před zahájením
terapie. Došlo ke stabilizaci astmatu v kratším čase
a s menší celkovou dávkou SKS.
u zbývajících
čtyř pacientů to bylo průměrně 1,5 exacerbace. Celkově počet
exacerbací poklesl z průměrných 4,4 těžké exacerbace
během 12 měsíců před zahájením terapie na průměrných
0,7 exacerbace při terapii mepolizumabem (graf 5). Je však nutno poznamenat, že ne všichni nemocní
byli v době hodnocení léčeni mepolizumabem 12 měsíců
a počet těžkých exacerbací při terapii mepolizumabem se
ještě může změnit, i když nepředpokládáme změnu
významnou. Exacerbace při terapii mepolizumabem měly mírnější
průběh ve srovnání s exacerbacemi před zahájením
terapie. Došlo ke stabilizaci astmatu v kratším čase
a s menší celkovou dávkou SKS.
Komorbidity
V souboru pacientů jsme provedli rovněž hodnocení komorbidit (graf 6). Jako nejčastější komorbidity byly zaznamenány gastroezofageální refluxní nemoc a chronická rinosinusitida, dominantně s nosní polypózou. Obě tyto komorbidity,
s astmatem často asociované, byly zaznamenány u 11 z celkového počtu 17 pacientů. Kardiovaskulární komorbidity či hypotyreóza patřily mezi méně časté. Některé z komorbidit (osteoporóza, diabetes mellitus) náležejí spíše mezi komplikace dlouhodobé systémové kortikoterapie či ke snížené kvalitě života (deprese).
Celkové hodnocení
V celkovém hodnocení byla v našem souboru terapie
mepolizumabem přínosná u 88 % pacientů s těžkým
eozinofilním astmatem k terapii indikovaných (graf 7). Léčba byla ukončena u dvou pacientů. Pouze
jeden nemocný byl hodnocen jako non respondér, kdy se při
terapii mepolizumabem nepodařilo zredukovat dávku dlouhodobě
užívaného prednisonu a nedošlo ke klinickému zlepšení.
Důvodem ukončení terapie u druhého nemocného byl nově
diagnostikovaný bronchogenní adenokarcinom, progredující i přes
dvě linie léčby, jenž vedl k úmrtí pacienta za pouhých
pět měsíců od stanovení diagnózy.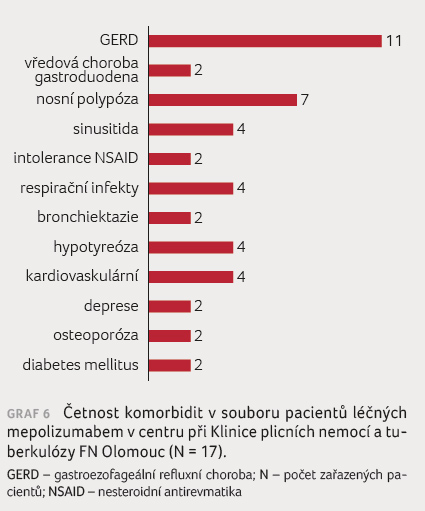
Naše zkušenosti s terapií mepolizumabem jsou v souladu
s výsledky randomizovaných i pokračovacích open label
klinických studií. Jsou v souladu také s předběžnými
výsledky probíhající observační kohortové studie REALITI A,
která si klade za cíl ve dvouletém prospektivním
sledování zhodnotit účinnost terapie mepolizumabem u pacientů
s těžkým eozinofilním astmatem v reálné klinické
praxi a jejíž předběžné výsledky byly prezentovány
na kongresu Evropské respirační společnosti (European
Respiratory Society, ERS) 2019 v Madridu. Dle těchto
předběžných výsledků došlo v reálné klinické praxi
v průběhu sledování po dobu 12 měsíců k poklesu
četnosti těžkých exacerbací při terapii mepolizumabem o 69 %
(ze 4,63 na 1,43 exacerbace; p
< 0,001) [10]. V našem souboru se tento pokles jeví ještě
výraznější, ačkoliv přesné hodnocení bude možné až
po ukončení 12 měsíců terapie u každého z pacientů.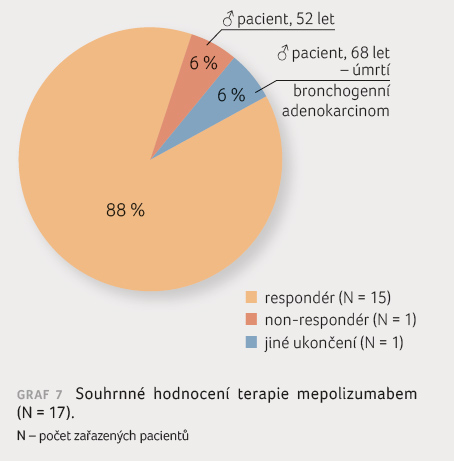
Závěr
Biologická léčba mepolizumabem v klinickém hodnocení i v reálné klinické praxi vykazuje velmi dobrou účinnost. Výhodou cílené terapie monoklonálními protilátkami je také to, že vykazuje dobrou toleranci s minimem výskytu nežádoucích účinků a prakticky žádné interakce s dalšími léky. Tato terapie přináší novou naději a mění prognózu pacientů s těžkým eozinofilním astmatem.
Seznam použité literatury
- [1] GINA (Global Initiative for Asthma) 2019. Difficult‑to‑treat and Severe asthma in adolescent and adult Patients. Diagnosis and Management. Dostupné na: https://ginasthma.org/wp‑content/uploads/2019/04/GINA‑Severe‑asthma‑Pocket‑Guide‑v2.0‑wms‑1.pdf
- [2] Teřl M, Čáp P, Dvořáková R, et al. Doporučený postup pro diagnostiku a léčbu bronchiálního astmatu, aktualizace 2016. Dostupné na: http://www.pneumologie.cz/guidelines/
- [3] Ortega HG, Liu MC, Pavord ID, et al. Mepolizumab Treatment in Patients with Severe Eosinophilic Asthma. N Engl J Med 2014, 371: 1198‒1207.
- [4] Pavord ID, Korn S, Howarth P, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double‑blind, placebo‑controlled trial. Lancet 2012; 380: 651‒659.
- [5] Khatri S, Moore W, Gibson PG, et al. Assessment of the long‑term safety of mepolizumab and durability of clinical response in patients with severe eosinophilic asthma. J Allergy Clin Immunol 2019; 143: 1742−1751.
- [6] Bel EH, Wenzel SE, Thompson PJ, et al. Oral Glucocorticoid‑Sparing Effect of Mepolizumab in Eosinophilic Asthma. N Engl J Med 2014; 371: 1189‒1197.
- [7] Lugogo N, Domingo C, Chanez P, et al. Long‑term Efficacy and Safety of Mepolizumab in Patients With Severe Eosinophilic Asthma: A Multi‑center, Open‑label, Phase IIIb Study. Clin Ther 2016; 38: 2058–2070.
- [8] Khurana S, Brusselle GG, Bel EH, et al. Long‑term Safety and Clinical Benefit of Mepolizumab in Patients With the Most Severe Eosinophilic Asthma: The COSMEX Study. Clin Ther 2019; 41: 2041‒2056.
- [9] Chupp GL, Bradford ES, Albers FC, et al. Efficacy of mepolizumab add‑on therapy on health‑related quality of life and markers of asthma control in severe eosinophilic asthma (MUSCA): a randomised, double‑blind, placebo‑controlled, parallel‑group, multicentre, phase 3b trial. Lancet Respir Med 2017; 5: 390–400.
- [10] Harrison T, Canonica GW, Gemzoe K, et al. Effectiveness and safety of mepolizumab in real‑world clinical practice: the REALITI‑A Study. Eur Res J 2019; 54(Suppl 63; Abstr OA2104).