Migréna a duševní nemoci
Jak vnímají psychiatři migrénu a problematiku tohoto onemocnění v souvislosti s duševními chorobami? Migréna je druhým nejvíce handicapujícím onemocněním, které postihuje více než 12 % světové populace. Chronická migréna je nejčastější chronickou bolestí hlavy, která postihuje celosvětově 1–2 % populace. Každý rok přibližně 2,5 % pacientů s epizodickou migrénou progreduje do chronické migrény, nejtěžší formy migrény co do počtu dní s bolestí hlavy, zátěže z doprovodných příznaků a negativního dopadu na kvalitu života pacientů. Reprezentuje také vyšší náklady pro systém zdravotní péče. Spolu s migrénou se mnohdy objevují přidružená onemocnění, komorbidity. K těm nejvýznamnějším patří psychiatrická onemocnění a poruchy spánku [1].
Migréna a psychiatrické komorbidity
Tématu migrény a psychiatrických komorbidit se v rámci letošního brněnského XIV. sympozia o léčbě bolesti věnoval MUDr. Pavel Doubek, Ph.D., z Psychiatrické kliniky 1. LF UK a VFN v Praze.
Migréna s aurou je výrazným rizikovým faktorem počátku poruchy nálady v mladším věku. Tuto skutečnost si psychiatři málokdy uvědomují a migrénu u mladších osob za rizikový faktor nepovažují. Nicméně data prokazují, že migréna v mladším věku je významným rizikovým faktorem rozvoje afektivní poruchy. Migréna se nejčastěji vyskytuje společně s depresivními poruchami, úzkostnými poruchami a somatoformními poruchami. Vysoká je prevalence migrény u pacientů s bipolární afektivní poruchou typu II (77 %); signifikantně nižší je u pacientů s bipolární afektivní poruchou typu I (14 %). Migréna má tedy nějakým způsobem vazbu spíše na depresivní pól a čistě depresivní symptomatiku, která je přítomna u bipolární poruchy typu II. U bipolární poruchy typu I, která reprezentuje spíše čistý maniodepresivní model, je výskyt migrény signifikantně nižší. U pacientů trpících migrénou (zejména u žen a u osob s migrénou s aurou) je oproti běžné populaci signifikantně vyšší riziko sebevraždy [2–4].
Dlouhodobá sledování u migrény popisují v jejím klinickém průběhu kognitivní dysfunkci, která není plně vysvětlitelná komorbidními psychiatrickými poruchami, jako jsou například deprese nebo úzkost, a uvažuje se o samostatném mechanismu kognitivního poklesu v průběhu chronické migrény [2]. Mechanismus účinku však není objasněn a není ani známa symptomatická léčba.
Pravidelné, každodenní chronické bolesti hlavy se často vyskytují spolu s příznaky anhedonie, poruchami soustředění, se snížením libida, poklesem celkové energie a poruchami spánku stejnými jako u depresivních poruch. Jedná se vlastně o shodnou příznakovou kategorii nebo množinu. Bolesti hlavy nejsou proto považovány pouze za příznak deprese, ale spolu s depresivními a úzkostnými poruchami za poruchy s podobným patofyziologickým mechanismem vzniku (narušení serotonergní transmise) [5,6].
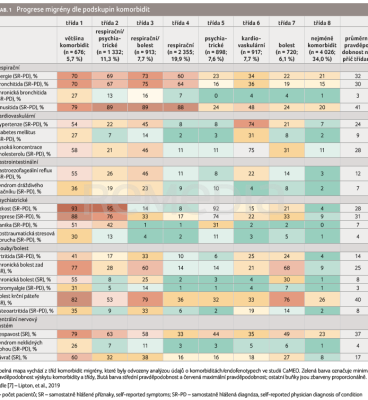 Zajímavé výsledky v kontextu migrény a komorbidit (respirační, kardiovaskulární, digestivní, psychiatrické, muskuloskeletální, neurologické) přinesla studie CaMEO (Chronic Migraine Epidemiology and Outcomes), která definovala podskupiny migrény na základě profilu komorbidit. Takto definované podskupiny migrény předpovídaly přechod z epizodické migrény (s ≥ 1 komorbiditou na počátku) do chronické migrény. Výsledky ukázaly, že každá třída komorbidit významně predikovala nástup chronické migrény (tab. 1) [7].
Zajímavé výsledky v kontextu migrény a komorbidit (respirační, kardiovaskulární, digestivní, psychiatrické, muskuloskeletální, neurologické) přinesla studie CaMEO (Chronic Migraine Epidemiology and Outcomes), která definovala podskupiny migrény na základě profilu komorbidit. Takto definované podskupiny migrény předpovídaly přechod z epizodické migrény (s ≥ 1 komorbiditou na počátku) do chronické migrény. Výsledky ukázaly, že každá třída komorbidit významně predikovala nástup chronické migrény (tab. 1) [7].
Migréna a poruchy spánku
Existence vztahu mezi migrénou a poruchami spánku je již dlouho známa. Nicméně přesná povaha této asociace, základní mechanismy a interakce jsou složité a nejsou zcela objasněny. Struktury centrálního nervového systému a neurotransmitery, které se podílejí na patofyziologii migrény, jsou také důležité pro regulaci normální architektury spánku. Je zde tedy jakási kompetence o stejné struktury mozku. Mohlo by se jednat o příčinnou roli v patogenezi obou poruch dysregulace těchto dvou onemocnění. Do patogeneze migrény a regulace cyklu spánku a bdění jsou nejvíce zapojeny diencefalické oblasti a oblasti mozkového kmene. Nejspíše existuje obousměrný vztah mezi migrénou a poruchami spánku, i když z psychiatrického hlediska to dosud není popsáno. Poruchy spánku jsou rizikovým faktorem pro nástup migrény a pro zvýšený dopad migrény, intenzitu bolesti a chronifikaci [3]. Kromě toho jsou migrenici vystaveni zvýšenému riziku vzniku poruch spánku. Tato souvislost však nemusí být specifická pro migrénu, protože poruchy spánku jsou obecněji spojovány s bolestí hlavy.
Léčba migrény s panickou poruchou
Při krátkodobé léčbě, tedy v řádu 6–8 týdnů, používáme benzodiazepiny (alprazolam, klonazepam). Benzodiazepiny jsou považovány za potenciálně návykové léky a dlouhodobé užívání nese s sebou riziko zvyšování tolerance, a tedy vznik závislosti. Toto riziko je u léčby benzodiazepiny vysoké. Při dlouhodobé léčbě migrény s panickou poruchou volíme valproát, stejně tak jako u migrény s panickou poruchou a bipolární poruchou. Pokud je migréna s panickou poruchou spojena se sekundární depresí, nasazujeme antidepresiva se sedativními účinky, tj. amitriptylin, paroxetin, fluvoxamin a mirtazapin. U pacientů s převládajícími úzkostnými příznaky podáváme antidepresiva se sedativním účinkem, tj. amitriptylin, paroxetin, fluvoxamin, trazodon. Antidepresiva bez sedativních účinků (fluoxetin) používáme při léčbě pacientů, u nichž převládá psychomotorické zpomalení [2].
Léčba migrény s depresivním syndromem
Preventivní léčba migrény s depresí a úzkostnými příznaky zahrnuje antidepresiva se sedativními účinky, tj. amitriptylin, paroxetin, fluvoxamin, mirtazapin. U migrény s depresí a psychomotorickým zpomalením podáváme antidepresiva bez sedativních účinků (fluoxetin). Betablokátory nebo flunarizin se nedoporučují [2].
Léčbu migrény s depresivní poruchou hodnotila studie UNITE. Jednalo se o dvojitě zaslepenou, randomizovanou, placebem kontrolovanou studii fáze IV, kde pacienti dostávali fremanezumab nebo placebo. V týdnu 12 měli pacienti užívající fremanezumab průměrné snížení o 6,7 na Hamiltonově hodnoticí škále pro depresi (HAM‑D 17). Tento rozdíl byl statisticky signifikantní (p = 0,0228) oproti placebu [8].
Základy klinického přístupu v léčbě migrény u psychiatrických komorbidit
Psychiatrické komorbidity u migrény jsou často invalidizující, vedou k chronifikaci obou nemocí a snižují odpověď na léčbu. Jsou spojeny s horší kvalitou života a vyššími suicidálními sklony. Odebírání anamnézy a diagnostické postupy související s migrénou by měly být vždy provedeny pečlivě a je třeba brát v úvahu existenci komorbidit. Terapeutické vedení a léčba migrény by měly být individualizovány tak, aby zvážily přítomnost psychiatrických komorbidit s přihlédnutím k potenciálním příznivým nebo synergickým účinkům a také k léčbě nežádoucích účinků [6]. Vzájemná spolupráce psychiatra a neurologa je důležitá nejen z hlediska účinné léčby, ale také pro dosažení celkově lepší kvality života těchto pacientů.
Migréna a depresivní pacientky
Co lékaři při léčbě pacientů s migrénou a psychiatrickými komorbiditami upřednostňují, migrénu, nebo psychiatrické komorbidity? Jaká léčba by byla vhodná k ovlivnění obou těchto entit? Tyto otázky přinesl kvíz prezentovaný na evropském sjezdu; lékaři měli vyjádřit své názory hlasováním. „To je hezké, ale problémy mohou nastat při výběru medikace,“ uvedla svůj příspěvek MUDr. Jolana Marková, FEAN, z Neurologické kliniky 3. LF UK a FTN, Praha.
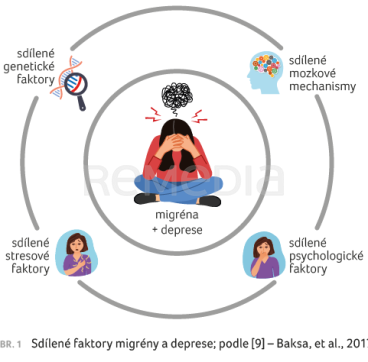 Společný výskyt migrény a deprese je dost pravděpodobný, neboť zde fungují sdílené mozkové mechanismy – např. serotonin jako hormon dobré nálady, blokátory zpětného vychytávání serotoninu jako antidepresiva a současně jeden z hlavních mediátorů rozbíhajícího se migrenózního záchvatu. Sdílené psychologické faktory jsou rovněž velmi pravděpodobné, o sdílených stresových faktorech není pochyb – stres migrénu zhoršuje a depresi prohlubuje. Sdílené genetické vlivy zatím považujeme za nejisté, ale zřejmě bude souvislost také brzy prokázána. V případě migrény je genetický vliv doložen pouze u familiární hemiplegické migrény, jinak předpokládáme, že jde spíše o sdílené dispozice pro migrénu. Totéž zřejmě bude platit i pro depresi (obr. 1) [9].
Společný výskyt migrény a deprese je dost pravděpodobný, neboť zde fungují sdílené mozkové mechanismy – např. serotonin jako hormon dobré nálady, blokátory zpětného vychytávání serotoninu jako antidepresiva a současně jeden z hlavních mediátorů rozbíhajícího se migrenózního záchvatu. Sdílené psychologické faktory jsou rovněž velmi pravděpodobné, o sdílených stresových faktorech není pochyb – stres migrénu zhoršuje a depresi prohlubuje. Sdílené genetické vlivy zatím považujeme za nejisté, ale zřejmě bude souvislost také brzy prokázána. V případě migrény je genetický vliv doložen pouze u familiární hemiplegické migrény, jinak předpokládáme, že jde spíše o sdílené dispozice pro migrénu. Totéž zřejmě bude platit i pro depresi (obr. 1) [9].
Krátce k psychologickému vyšetření
Každého pacienta s chronickými denními bolestmi hlavy nebo i s velmi frekventní migrénou posíláme v našem centru k psychologovi. Je velmi důležité právě z hlediska volby další medikace, pokud víme, co se za potížemi skrývá. Psycholog má více času na důkladný rozhovor s pacientem.
„Následující zpráva od psychologa pacientky dokumentuje, jak je takovéto psychologické vyšetření důležité pro naši další komunikaci s pacientem a pro další postup,“ uvedla MUDr. Marková.
Diagnostická rozvaha: 56letá vysokoškolačka, pracuje jako účetní. Psychologicky a psychiatricky byla vyšetřena v roce 2007, kdy jí byla diagnostikována bipolární porucha. Aktuálně neužívá žádnou medikaci, „protože nemá klasické příznaky bipolárky“ a nerada užívá léky. Výsledky vyšetření ukazují na sociální introvertovanou osobnost, aktuálně depresivní, podrážděná, nedůvěřivá, netrpělivá, hostilní, i když si udržuje fasádu otevřeného a pozitivního člověka. Má nízké sebevědomí, necítí se pohodlně v interpersonálních vztazích. Pacientka se snaží prezentovat se jako bezproblémová, pozitivní osoba, z klinického obrazu je ale patrné, že je v nepohodě. Její psychický stav může vyplývat z její pracovní situace, kdy musí jako introvert vést podřízené, kteří mají mezi sebou spory. Chtěla by tuto situaci změnit a najít si nové zaměstnání. Frustrace a pocity bezmoci mohou být příčinou dekompenzace jejího psychického stavu a zhoršení bolesti hlavy. Není však aktuálně ochotna si to připustit.
Závěr: Sociální introvertovaná osobnost, aktuálně depresivní, zahlcená zlobou.
Některé léky specifické pro profylaxi migrény mohou být pro léčbu pacientů s psychiatrickými komorbiditami nevhodné [10]. Víme, že betablokátory jsou efektivní v prevenci epizodické migrény, ale u chronické migrény neprokázaly účinnost. Mohou zhoršovat příznaky deprese a u některých pacientů mohou vyvolat kardiovaskulární nežádoucí účinky a snížit libido.
Flunarizin a cinarizin jsou efektivní u epizodické migrény, ale nemají prokázanou účinnost s koexistující depresí. U citlivých jedinců mohou způsobovat denní ospalost, ale naopak zlepšují noční spánek. Hlavní nevýhodou je, že způsobují zvýšenou chuť k jídlu, a tedy i přírůstek hmotnosti.
Topiramát je vysoce účinný v prevenci migrény u některých pacientů, ale v dávce vyšší než 50 mg zhoršuje paměť a koncentraci, což ohrožuje profesní aktivity pacientů, kteří musejí být pozorní nebo se učit. Topiramát může zhoršovat příznaky deprese a riziko sebevraždy, vyvolává parestezie končetin a ztrátu hmotnosti.
Amitriptylin je výhodný v tom, že profylaxi migrény lze vést daleko nižšími dávkami než léčbu deprese. Léčba je spojena s rizikem anticholinergních nežádoucích účinků (např. sucho v ústech) a se špatnou tolerancí [10].
Aktuálním trendem v terapii migrény je cílení na calcitonin gene‑related peptide (CGRP). Monoklonální protilátky s afinitou k CGRP nebo jeho receptoru jsou schopny zablokovat aktivaci trigeminovaskulárního komplexu, a tedy i rozvoj bolestí hlavy.
Účinnost monoklonální protilátky, v tomto případě fremanezumabu, hodnotila studie UNITE. Jednalo se o dvojitě zaslepenou, randomizovanou, placebem kontrolovanou studii fáze IV u 353 dospělých pacientů s epizodickou nebo chronickou migrénou a komorbidní středně těžkou nebo velkou depresivní poruchou. Studie probíhala 12 týdnů s následnou otevřenou prodlouženou fází, kdy pacienti dostávali fremanezumab v dávce 675 mg jednou za tři měsíce. Jedním z hlavních cílů studie bylo snížení počtu dní s migrénou v měsíci (monthly migraine days, MMD) oproti výchozí hodnotě. Během 12 týdnů byla zaznamenána redukce MMD –5,1 pro fremanezumab a pouze –2,9 pro placebo [11,12].
Probíhající studie PEARL (Pan‑European Real Life) přináší ještě lepší výsledky v parametru MMD, kdy po roce léčby fremanezumabem nastává zlepšení o 8–9 dní. Tato studie probíhá v 87 centrech v 11 zemích Evropy u zhruba 1 100 pacientů s chronickou nebo epizodickou migrénou. Jedná se tak o doposud nejrozsáhlejší studii běžné klinické praxe hodnotící fremanezumab. Dosavadní data prokazují, že výsledky testu zaměřeného na hodnocení úrovně bolesti hlavy, tj. Headache Impact Test (HIT), který signalizuje tíži nejhoršího migrenózního záchvatu za minulé období i celkový dojem pacienta, byly pozitivní a statisticky významné oproti placebu [13].
Kazuistiky
Uvádíme dvě kazuistiky pacientek srovnatelného věku, hmotnosti a srovnatelného počtu MMD, které jsou léčeny fremanezumabem. U obou pacientek došlo ke snížení MMD, nicméně u jedné byla redukce razantní, druhá pacientka má stále 1–3 dny s migrénou měsíčně.
Pacientka 1
Pacientka narozená v roce 1974 byla do specializovaného centra odeslána psychiatričkou v roce 2016. Pacientka byla léčena pro deprese, pro něž byla také hospitalizována v Psychiatrické nemocnici Bohnice. Diagnostický závěr: frekventní epizodická migréna bez aury, deprese na terapii. Od března 2016 do ledna 2021 měla pacientka profylaktickou terapii migrény (valproát sodný, metoprolol), která však byla neefektivní. V lednu 2021 při stavu MMD 11 byla zahájena léčba fremanezumabem. Při této terapii bylo dosaženo MMD 3, ale zcela bez migrény žena není. Pacientka je velmi spokojena, cítí se dobře, redukci počtu atak vnímá jako výbornou, nežádoucí účinky nemá, aplikuje bez problémů. Lék pro případ ataky – sumatriptan v dávce 50 mg – je s efektem a vyhovuje jí. Pacientka je dále sledována na psychiatrii pro deprese, její stav je stabilizovaný a další ústavní léčba nebyla již potřebná.
Pacientka 2
Pacientka je lékařka narozená v roce 1975. V péči specializovaného centra je od února 2021. V anamnéze má revmatoidní artritidu (2017), pro kterou je léčena metotrexátem; depresivní stavy na terapii vortioxetinem. Profylaxe migrény byla zahájena až v srpnu 2021 a dosud je žena léčena venlafaxinem, který má dobrý efekt na depresi, ale je zcela neúčinný na frekvenci migrén. Valproát i topiramát jsou kontraindikovány vzhledem ke komorbiditě, betablokátory nelze podat z důvodu hypotenze. Léčba fremanezumabem byla zahájena v březnu 2022, kdy měla pacientka MMD 12 a počet se stále snižoval, přičemž v únoru letošního roku byl MMD 1 a od té doby je žena zcela bez migrény. Pacientka je velmi spokojena, cítí se dobře, nežádoucí účinky se nevyskytly. Lék pro případ ataky – eletriptan v dávce 40 mg – je s efektem a vyhovuje jí. Pro deprese je pacientka i nadále sledována na psychiatrii, její stav je dle hodnocení psychiatričky stabilizovaný.
Závěr
Zatímco mnoho tradičních preventivních přípravků proti migréně je často nevhodných pro léčbu pacientů s psychiatrickými komorbiditami, údaje z reálné praxe ve světě naznačují, že monoklonální protilátky proti CGRP jsou u této populace nemocných účinné.
Jedinou studií, která byla provedena právě na tomto souboru pacientů, to znamená pacientů s frekventní epizodickou migrénou a střední nebo velkou depresí, byla studie UNITE, která hodnotila účinnost fremanezumabu oproti placebu. Fremanezumab prokázal účinnost ve zmírnění příznaků migrény i symptomů deprese.
Literatura
[1] Burch RC, Buse DC, Lipton RB. Migraine: Epidemiology, Burden, and Comorbidity. Neurol Clin 2019; 37: 631–649.
[2] Pompili M, Di Cosimo D, Innamorati M, et al. Psychiatric comorbidity in patients with chronic daily headache and migraine: a selective overview including personality traits and suicide risk. J Headache Pain 2009; 10: 283–290.
[3] Tiseo C, Vacca A, Felbush A, et al. Migraine and sleep disorders: a systematic review. J Headache Pain 2020; 21: 126.
[4] Vuralli D, Ayata C, Bolay H. Cognitive dysfunction and migraine. J Headache Pain 2018; 19: 109.
[5] Scheftell FD, Atlas SJ. Migraine and psychiatric comorbidity: from theory and hypotheses to clinical application. Headache 2002; 42: 934–944.
[6] Dresler T, Caratozzolo S, Guldolf K, et al. Understanding the nature of psychiatric comorbidity in migraine: a systematic review focused on interactions and treatment implications. J Headache Pain 2019; 20: 51.
[7] Lipton RB, Fanning KM, Buse DC, et al. Migraine progression in subgroups of migraine based on comorbidities: Results of the CaMEO Study. Neurology 2019; 93: e2224–e2236.
[8] Lipton RB, Barbanti P, Ramirez Campos V, et al. Efficacy of fremanezumab in reducing depression in patients with migraine and major depressive disorder: results of the UNITE study. Presented at World Congress of Neurology (WCN); 15–19 October 2023; Montreal, 121661.
[9] Baksa D, Gonda X, Juhasz G. Why are migraineurs more depressed? A review of the factors contributing to the comorbidity of migraine and depression. Neuropsychopharmacol Hung 2017; 19: 37–44.
[10] Stepień A, Domitrz I, Kozubski W, et al. Experts and national consultants’ recommendations regarding management of patients treated for migraine with comorbid depression. Diagnosis. Therapeutic Strategies. Part 2. Psychiatr Pol 2022; 56: 711–728.
[11] Lipton R, Barbanti P, Ramirez Campos V, et al. Efficacy of fremanezumab in reducing depression in patients with migraine and major depressive disorder: results of the UNITE study. Presented at AHS Annual Meeting; 15–18 June 2023; Austin, TX. IO‑05.
[12] Ramirez Campos V, Lipton RB, Krasenbaum LJ, et al. UNITE: Efficacy and Impact of Fremanezumab in Patients with Migraine and Major Depressive Disorder. Presented at International Headache Congress (IHC); 1417 September 2023; Seoul, South Korea, IHC23‑IND‑014.
[13] Ashina M, Mitsikostas D, Amin F, et al. Real‑world effectiveness & safety of fremanezumab in migraine: 3rd interim analysis of the pan‑European PEARL study. Presented at European Academy of Neurology (EAN); 1–4 July 2023; Budapest, EAN‑EPR‑045.