Natalizumab v léčbě roztroušené sklerózy
Od roku 2007 je v České republice registrována monoklonální protilátka natalizumab, která představuje dosud nejúčinnější lék využívaný v terapii relabující-remitující roztroušené sklerózy. Jedná se o velmi dobře tolerovaný preparát, jehož podávání nicméně vzácně přináší riziko vzniku závažné infekční komplikace – progresivní multifokální leukoencefalopatie. Toto riziko je nutno před zahájením léčby i v jejím průběhu pečlivě vyhodnocovat a diskutovat s pacientem. V článku předkládáme tři krátké kazuistiky pacientů s roztroušenou sklerózou léčených natalizumabem k lepšímu pochopení současné indikace této léčby i monitorace takto léčených pacientů.
Úvod
Natalizumab je humanizovaná monoklonální protilátka namířená proti adhezní molekule a4-integrinu, který je exprimován na povrchu leukocytů. Blokádou této molekuly natalizumab významným způsobem redukuje přestup zánětlivých imunitních buněk přes hematoencefalickou bariéru do centrálního nervového systému (CNS). Tím dochází ke snížení aktivity zánětu u roztroušené sklerózy (RS), která je etiologicky chápána jako autoimunitní onemocnění CNS [1].
Natalizumab je indikován u relabující-remitující RS (RR-RS), kde prokázal jednoznačný vliv na snížení počtu relapsů, snížení aktivity onemocnění na magnetické rezonanci (MR) i oddálení progrese neurologického deficitu [2]. Je využíván jako lék druhé volby pro pacienty s neefektivitou či intolerancí léků první volby (interferony beta a glatiramer acetát) nebo jako lék první volby pro pacienty s vysoce aktivním onemocněním a hrozícím rychlým nárůstem invalidity. K nežádoucím účinkům natalizumabu řadíme alergickou infuzní reakci, vyšší frekvenci výskytu běžných infektů (dýchací a močové cesty) a tvorbu protilátek proti natalizumabu (3–6 % pacientů), které znamenají, ![Obr. 1 Stratifikace rizika progresivní multifokální leukoencefalopatie při léčbě natalizumabem; podle [3] – Kappos, et al., 2011.](https://www.remedia.cz/photo-a-28648---.jpg) že léčba tímto preparátem není efektivní. Vzácnou komplikaci představuje oportunní virová infekce – progresivní multifokální leukoencefalopatie (PML) s možnými následky v podobě trvalého neurologického rezidua (zrak, hybnost, kognice) i úmrtí. Výše tohoto rizika je podle současných znalostí dána přítomností patogenetického JC viru v organismu (50–60 % populace), délkou podávání natalizumabu (naprostá většina případů PML byla zaznamenána po 24. měsíci léčby) a předchozí imunosupresivní léčbou [3]. U pacientů s negativními protilátkami proti JC viru (test STRATIFY JCVTM) je riziko PML 0,11 : 1000. Naproti tomu u pacientů se všemi výše uvedenými riziky představuje po 24 měsících léčby riziko PML 7,8 : 1000 (obr. 1).
že léčba tímto preparátem není efektivní. Vzácnou komplikaci představuje oportunní virová infekce – progresivní multifokální leukoencefalopatie (PML) s možnými následky v podobě trvalého neurologického rezidua (zrak, hybnost, kognice) i úmrtí. Výše tohoto rizika je podle současných znalostí dána přítomností patogenetického JC viru v organismu (50–60 % populace), délkou podávání natalizumabu (naprostá většina případů PML byla zaznamenána po 24. měsíci léčby) a předchozí imunosupresivní léčbou [3]. U pacientů s negativními protilátkami proti JC viru (test STRATIFY JCVTM) je riziko PML 0,11 : 1000. Naproti tomu u pacientů se všemi výše uvedenými riziky představuje po 24 měsících léčby riziko PML 7,8 : 1000 (obr. 1).
Kazuistika 1Dlouhodobá efektivita natalizumabu
28letá žena byla poprvé neurologem vyšetřena v březnu roku 2000 (v 18 letech věku) s příznaky dysestezií a neobratnosti pravé horní končetiny. Obtíže byly uzavřeny jako vertebrogenní etiologie, nebyla indikována další vyšetření. V témže roce pacientka prodělala dále optickou neuritidu, následně jí byla v lednu 2001 stanovena diagnóza RR-RS dle McDonaldových kritérií s jednoznačným nálezem na MR i v likvoru (12 oligoklonálních pásů v likvoru bez korelátu v séru). Po standardním zaléčení ataky kortikoidy byla u pacientky zahájena v únoru 2001 léčba imunosupresivem azathioprinem (pacientka odmítla nabízenou terapii léky 1. volby kvůli strachu z injekčního podávání). Tuto léčbu však bylo nutno během 6 týdnů ukončit, protože u pacientky došlo k rozvoji dřeňového útlumu. Byla zjištěna homozygocie pro alelickou variantu TPMT*3A, která s sebou nese nulovou aktivitu enzymu thiopurin methyltransferázy (TPMT) [4]. Chybění tohoto enzymu vede ke zpracovávání azathioprinu alternativní cestou s tvorbou myelotoxických metabolitů (Pozn. Dnes představuje genetické vyšetření alel genu TPMT standardní vyšetření u všech pacientů před zahájením terapie azathioprinem).
Následně byla pacientka léčena pouze nízkou dávkou perorálně podávaných kortikoidů, léčba probíhala bez další ataky až do dubna 2003, kdy byla po atace paraparézy dolních končetin nemocná zařazena do klinické studie s i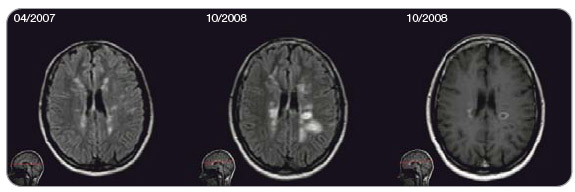 ntravenózními imunoglobuliny. V roce 2004 prodělala 2 ataky parézy pravé dolní končetiny a od října 2004 u ní byla zahájena léčba interferonem beta-1a v dávce 44 mg subkutánně 3krát týdně. Při podávání této léčby bylo dosaženo stabilizace až do března 2007, kdy byla zaznamenána ataka centrálního vestibulárního syndromu. I přes aktivitu onemocnění pacientka neplánovaně v témže roce otěhotněla, následně pak ve 2. trimestru v lednu 2008 proběhla další motorická ataka. Po porodu kojila 3 měsíce, od září 2008 opět zahájila terapii interferonem beta-1a jako před graviditou, nicméně v listopadu 2008 byla konstatována ataka parestezií pravostranných končetin společně s výraznou progresí a aktivitou zánětlivého procesu na MR (obr. 2). Pacientce byla proto nabídnuta léčba natalizumabem, kterou zahájila v lednu 2009 při stupni EDSS (Expanded Disability Status Scale) 4,0, což odpovídá schopnosti chůze 500 metrů bez opory a bez zastavení.
ntravenózními imunoglobuliny. V roce 2004 prodělala 2 ataky parézy pravé dolní končetiny a od října 2004 u ní byla zahájena léčba interferonem beta-1a v dávce 44 mg subkutánně 3krát týdně. Při podávání této léčby bylo dosaženo stabilizace až do března 2007, kdy byla zaznamenána ataka centrálního vestibulárního syndromu. I přes aktivitu onemocnění pacientka neplánovaně v témže roce otěhotněla, následně pak ve 2. trimestru v lednu 2008 proběhla další motorická ataka. Po porodu kojila 3 měsíce, od září 2008 opět zahájila terapii interferonem beta-1a jako před graviditou, nicméně v listopadu 2008 byla konstatována ataka parestezií pravostranných končetin společně s výraznou progresí a aktivitou zánětlivého procesu na MR (obr. 2). Pacientce byla proto nabídnuta léčba natalizumabem, kterou zahájila v lednu 2009 při stupni EDSS (Expanded Disability Status Scale) 4,0, což odpovídá schopnosti chůze 500 metrů bez opory a bez zastavení.
Pacientka je aktuálně léčena natalizumabem (září 2011) již 31 měsíců, dosud bez další ataky RS, bez nárůstu neurologického deficitu (EDSS zůstává na stupni 4,0), bez progrese či známek aktivity na MR. Léčba není provázena nežádoucími účinky. Z hlediska rizika PML je tato pacientka aktuálně léčena natalizumabem déle než 24 měsíců, má zjištěny pozitivní protilátky proti JC viru, v minulosti prakticky nebyla léčena imunosupresivy. Riziko PML lze v tomto případě odhadnout na 2,5 : 1000, viz obr. 1. Z jiných léčebných možností lze pacientce teoreticky nabídnout některý z dosud nepodávaných léků 1. volby nebo pulzní léčbu kortikoidy, u nichž však nepředpokládáme dostatečnou účinnost. Další možnost změny terapie bude v nejbližší budoucnosti (po registraci) představovat perorálně podávaný fingolimod. Po rozhovoru s pacientkou a s jejím souhlasem zatím pokračujeme v léčbě natalizumabem při častých klinických i MR kontrolách.
Kazuistika 2Pacient neodpovídající na léčbu natalizumabem
25letá žena byla poprvé vyšetřena oftalmologem pro bolest za pravým bulbem v lednu 2003 (v 17 letech věku), nebyla shledána žádná patologie. V prosinci 2004 pak byla vyšetřena s obdobnými příznaky včetně poruchy vizu na levém oku, kdy již byla konstatována optická neuritida a dle MR (mnohočetné ložiskové postižení supra- i infratentoriálně včetně ložiska v krční míše) a likvoru (24 oligoklonálních pásů v likvoru bez korelátu v séru) bylo 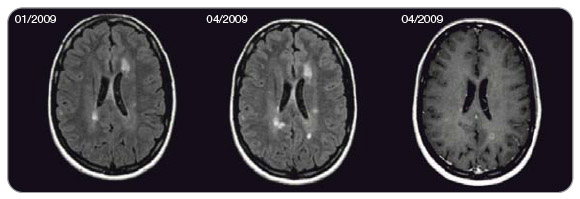 vysloveno podezření na demyelinizační onemocnění typu RR-RS. Diagnostická kritéria pak byla naplněna atakou v červnu 2005. Pacientka byla poté odeslána do specializovaného centra a od března 2006 zahájila terapii léky 1. volby (interferonem beta-1a v dávce 30 mg intramuskulárně 1krát týdně) v kombinaci s perorálně podávaným azathioprinem. V době zahájení léčby byla bez zjevného neurologického deficitu se stupněm EDSS 1,5 (atrofie papil na očním pozadí a kvadruhyperreflexie). V srpnu 2006 vyvinula ataku paraparézy dolních končetin a následně v květnu 2007 kmenové příznaky, proto byla léčba eskalována nejprve na interferon beta-1a v dávce 22 mg subkutánně 3krát týdně, po další motorické atace v září 2007 na interferon beta-1a v dávce 44 mg subkutánně 3krát týdně. Paralelně byl zaměněn azathioprin za methotrexát v dávce 2,5 mg perorálně 3krát týdně. I přes zintenzivnění léčby došlo k rozvoji další motorické ataky, neurologický nález se v listopadu 2008 zhoršil na stupeň EDSS 3,5 a u pacientky byla v únoru 2009 zahájena léčba natalizumabem. Subjektivně se při této léčbě cítila více unavená, hlásila pokles výkonnosti. Na MR mozku byla v dubnu 2009 prokázána progrese ložiskového postižení i gadolinium enhancement jako další známka pokračující aktivity RS (obr. 3). V květnu 2009 (3 měsíce po zahájení léčby natalizumabem) pak vyvinula ataku paraparézy dolních končetin, která si vyžádala přeléčení methylprednisolonem. Protilátky proti natalizumabu, které by vysvětlovaly neúčinnost preparátu, byly negativní. Pacientka byla zhodnocena jako non-respondent na terapii natalizumabem, léčba byla po 4 měsících podávání při EDSS 3,5 ukončena.
vysloveno podezření na demyelinizační onemocnění typu RR-RS. Diagnostická kritéria pak byla naplněna atakou v červnu 2005. Pacientka byla poté odeslána do specializovaného centra a od března 2006 zahájila terapii léky 1. volby (interferonem beta-1a v dávce 30 mg intramuskulárně 1krát týdně) v kombinaci s perorálně podávaným azathioprinem. V době zahájení léčby byla bez zjevného neurologického deficitu se stupněm EDSS 1,5 (atrofie papil na očním pozadí a kvadruhyperreflexie). V srpnu 2006 vyvinula ataku paraparézy dolních končetin a následně v květnu 2007 kmenové příznaky, proto byla léčba eskalována nejprve na interferon beta-1a v dávce 22 mg subkutánně 3krát týdně, po další motorické atace v září 2007 na interferon beta-1a v dávce 44 mg subkutánně 3krát týdně. Paralelně byl zaměněn azathioprin za methotrexát v dávce 2,5 mg perorálně 3krát týdně. I přes zintenzivnění léčby došlo k rozvoji další motorické ataky, neurologický nález se v listopadu 2008 zhoršil na stupeň EDSS 3,5 a u pacientky byla v únoru 2009 zahájena léčba natalizumabem. Subjektivně se při této léčbě cítila více unavená, hlásila pokles výkonnosti. Na MR mozku byla v dubnu 2009 prokázána progrese ložiskového postižení i gadolinium enhancement jako další známka pokračující aktivity RS (obr. 3). V květnu 2009 (3 měsíce po zahájení léčby natalizumabem) pak vyvinula ataku paraparézy dolních končetin, která si vyžádala přeléčení methylprednisolonem. Protilátky proti natalizumabu, které by vysvětlovaly neúčinnost preparátu, byly negativní. Pacientka byla zhodnocena jako non-respondent na terapii natalizumabem, léčba byla po 4 měsících podávání při EDSS 3,5 ukončena.
Vzhledem k vysoké aktivitě onemocnění byl pacientce navržen off-label léčebný postup – vysokodávkovaná imunoablace s podporou hematopoetických kmenových buněk. Do jejího zahájení v únoru 2010 byla ještě léčena methylprednisolonem a cyklofosfamidem pro protrahovanou ataku z víceložiskového postižení krční míchy.
Po provedení autologní transplantace kmenových buněk byla ještě sérií plazmaferéz doléčena symptomatika předchozí míšní ataky. Od března 2010 do současné doby (září 2011) je pacientka bez další ataky, bez progrese neurologického nálezu (EDSS 3,0). Preventivně aplikuje glatiramer acetát v dávce 20 mg subkutánně denně. Stabilizace bylo dosaženo taktéž na MR. Pacientka úspěšně pokračuje ve studiu vysoké školy.
Kazuistika 3Natalizumab jako 1. volba u aktivní relabující-remitující RS
22letý muž byl přijat akutně na naše neurologické oddělení v květnu roku 2011 pro 14 dní progredující poruchu chůze a stability. Objektivně byla konstatována centrální paraparéza dolních končetin, hranice čití L1, paleocerebelární syndrom a sfinkterová dysfunkce, stupeň EDSS 5,0. Jednalo se o první neurologické symptomy v životě pacienta.
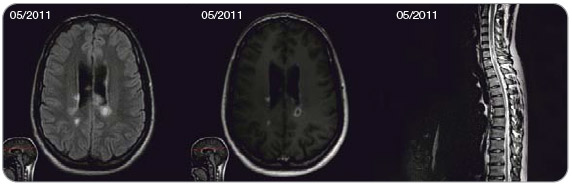 Dle doplněného vyšetření na MR bylo potvrzeno mnohočetné ložiskové postižení mozku i míchy s vícečetným gadolinium enhancementem (obr. 4). Podle aktuálně revidovaných diagnostických kritérií [5] je přítomnost gadolinium enhancujících ložisek současně s ložisky neenhancujícími ekvivalentem průkazu diseminace procesu v čase. U pacienta byla tedy již na základě vstupní MR verifikována diagnóza RR-RS. Podporující byly i výsledky vyšetření likvoru (lymfocytární pleiocytóza 47/1 ml s aktivací v lymfocytární řadě, 8 oligoklonálních pásů v likvoru bez korelátu v séru). Pacient byl přeléčen methylprednisolonem v celkové dávce 4 g. Kontrolní MR mozku s měsíčním odstupem v červnu 2011 prokázala progresi nálezu včetně nových gadolinium enhancujících ložisek. Taktéž klinicky došlo opět po více než 30 dnech od první ataky k dalšímu zhoršení paraparézy dolních končetin. U pacienta se jedná jednoznačně o velmi aktivní RS, bylo mu proto nabídnuto podávání natalizumabu jako léčba 1. volby. Léčba byla zahájena v červenci 2011. Po 2 aplikacích je zatím pacient bez nové neurologické symptomatiky, subjektivně s pokračující úpravou motorického deficitu. Pacient má negativní protilátky proti JC viru, riziko PML je tedy v tomto případě prakticky zanedbatelné (≤ 0,11 : 1000 léčených pacientů, viz obr. 1). Pozitivita protilátek bude kontrolována jedenkrát ročně (sérokonverze nastává u 2–3 % pacientů za rok [3]).
Dle doplněného vyšetření na MR bylo potvrzeno mnohočetné ložiskové postižení mozku i míchy s vícečetným gadolinium enhancementem (obr. 4). Podle aktuálně revidovaných diagnostických kritérií [5] je přítomnost gadolinium enhancujících ložisek současně s ložisky neenhancujícími ekvivalentem průkazu diseminace procesu v čase. U pacienta byla tedy již na základě vstupní MR verifikována diagnóza RR-RS. Podporující byly i výsledky vyšetření likvoru (lymfocytární pleiocytóza 47/1 ml s aktivací v lymfocytární řadě, 8 oligoklonálních pásů v likvoru bez korelátu v séru). Pacient byl přeléčen methylprednisolonem v celkové dávce 4 g. Kontrolní MR mozku s měsíčním odstupem v červnu 2011 prokázala progresi nálezu včetně nových gadolinium enhancujících ložisek. Taktéž klinicky došlo opět po více než 30 dnech od první ataky k dalšímu zhoršení paraparézy dolních končetin. U pacienta se jedná jednoznačně o velmi aktivní RS, bylo mu proto nabídnuto podávání natalizumabu jako léčba 1. volby. Léčba byla zahájena v červenci 2011. Po 2 aplikacích je zatím pacient bez nové neurologické symptomatiky, subjektivně s pokračující úpravou motorického deficitu. Pacient má negativní protilátky proti JC viru, riziko PML je tedy v tomto případě prakticky zanedbatelné (≤ 0,11 : 1000 léčených pacientů, viz obr. 1). Pozitivita protilátek bude kontrolována jedenkrát ročně (sérokonverze nastává u 2–3 % pacientů za rok [3]).
Závěr
Natalizumab představuje dosud nejúčinnější lék u relabující-remitující roztroušené sklerózy. Jeho využití lege artis zahrnuje správnou a včasnou indikaci společně s pečlivým průběžným hodnocením efektu i možných rizik po celou dobu léčby.
Poděkování za zapůjčení MR snímků patří prof. MUDr. Z. Seidlovi, CSc., a doc. MUDr. M. Vaněčkové, Ph.D., z Radiodiagnostické kliniky 1. LF UK a VFN v Praze.
Podpořeno výzkumným záměrem MSM 0021620849.
Seznam použité literatury
- [1] Havrdová E. Neuroimunologie. Praha, Maxdorf 2001; 180–263.
- [2] Havrdova E, Galetta S, Hutchinson M, et al. Effect of natalizumab on clinical and radiological disease activity in multiple sclerosis: a retrospective analysis of the Natalizumab Safety and Efficacy in Relapsing-Remitting Multiple Sclerosis (AFFIRM) study. Lancet Neurol 2009; 8: 254–260.
- [3] Kappos L, Bates D, Edan G, et al. Natalizumab treatment for multiple sclerosis: updated recommendations for patient selection and monitoring. Lancet Neurol 2011; 10: 745–758.
- [4] Frohman EM, Havrdova E, Levinson B, et al. Azathioprine myelosuppression in multiple sclerosis: characterizing thiopurine methyltransferase polymorphisms. Mult Scler 2006; 12: 108–111.
- [5] Polman CH, Reingold SC, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011; 69: 292–302.