Novinky v léčbě bolesti
Ve dnech 13.–15. dubna 2023 se v Brně konalo již XIII. sympozium o léčbě bolesti s mezinárodní účastí. Odborné akce se zúčastnila řada našich kliniků, kteří diskutovali aktuální témata z oblasti algeziologie. Sympozium společnosti Stada se zaměřilo na novinky ve farmakoterapii bolesti.
Dlouho očekávaná novinka v léčbě chronické bolesti
První přednášky se ujala doc. MUDr. Jitka Fricová, Ph.D., (Centrum pro léčbu bolesti, Klinika anesteziologie, resuscitace a intenzivní medicíny 1. LF UK a VFN v Praze), která představila novinku pro terapii chronické bolesti. V úvodu připomněla novou definici, která charakterizuje bolest jako nepříjemný smyslový a emocionální zážitek spojený se skutečným nebo potenciálním poškozením tkáně nebo je tomuto zážitku podobná. Jako třetí patofyziologický typ bolesti byla definována nociplastická bolest s cílem zdůraznit význam změn v procesu zapojením nocicepce zejména v oblasti centrálních mechanismů. Tento typ bolesti vzniká na podkladě změny nocicepce, a to i bez jasného důkazu skutečného nebo hrozícího poškození tkáně, které způsobuje aktivaci periferních nociceptorů, nebo i bez důkazu o nemoci nebo lézi somatosenzorického nervového systému způsobujícího bolest. Farmakoterapie musí být individualizována s větším uplatněním koanalgetik.
Léčba silnými opioidy je aktuálně podrobena důslednější kontrole. Bez podání silných opioidů si léčbu silné chronické bolesti nelze představit, nicméně je zapotřebí řídit se několika doporučeními správné indikace a vedení léčby. V případě nepříznivých účinků, kdy je pomyslná analgetická rovnice vychýlena směrem k nežádoucím účinkům navzdory dostatečné adjuvantní léčbě, se doporučuje rotace opioidu. Nahrazení jednoho opioidu za druhý a používání nižších dávek je možné ve většině případů.
Přednášející upozornila na posun v klasifikaci opioidů. Oproti dřívějšímu dělení na slabé a silné opioidy nyní častěji rozlišujeme konvenční a atypické opioidy. Konvenční opioidy jsou silní agonisté na µ‑opioidních receptorech. Patří sem fentanyl, oxykodon, hydromorfon, morfin. Atypické opioidy se neopírají výlučně o µ‑receptorový agonismus a mají různé žádoucí i nežádoucí účinky s odlišným profilem toxicity a rizika závislosti. Patří sem buprenorfin, tramadol a tapentadol. Tato léčiva představují analgetika pro chronickou bolest, která vyžaduje farmakologickou léčbu.
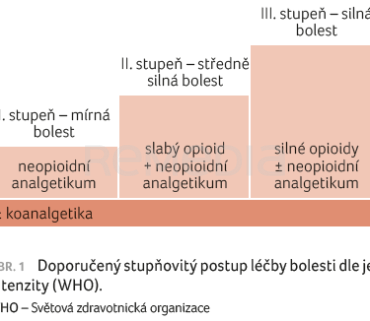 Doporučený postup pro léčbu bolesti dle žebříčku Světové zdravotnické organizace (World Health Organization, WHO) je založen na stupňovitém navyšování analgetik dle míry bolesti (obr. 1). V prvním stupni se u mírné bolesti využívají analgetika‑antipyretika (paracetamol, metamizol) nebo nesteroidní antiflogistika klasická (ibuprofen, diklofenak) či preferenční (nimesulid, meloxikam), ve druhém stupni u středně silné bolesti jsou to kombinované přípravky s obsahem paracetamolu, kodeinu, tramadolu či dexketoprofenu nebo opioidy tramadol a dihydrokodein označované jako slabé. U silné bolesti ve třetím stupni jsou pak doporučovány silné opioidy buprenorfin, fentanyl, oxykodon, hydromorfon, tapentadol a morfin.
Doporučený postup pro léčbu bolesti dle žebříčku Světové zdravotnické organizace (World Health Organization, WHO) je založen na stupňovitém navyšování analgetik dle míry bolesti (obr. 1). V prvním stupni se u mírné bolesti využívají analgetika‑antipyretika (paracetamol, metamizol) nebo nesteroidní antiflogistika klasická (ibuprofen, diklofenak) či preferenční (nimesulid, meloxikam), ve druhém stupni u středně silné bolesti jsou to kombinované přípravky s obsahem paracetamolu, kodeinu, tramadolu či dexketoprofenu nebo opioidy tramadol a dihydrokodein označované jako slabé. U silné bolesti ve třetím stupni jsou pak doporučovány silné opioidy buprenorfin, fentanyl, oxykodon, hydromorfon, tapentadol a morfin.
Docentka Fricová dále upřela pozornost na buprenorfin. Tento parciální µ‑receptorový agonista byl dosud dostupný v transdermálních náplastech pro léčbu středně silné až silné chronické bolesti nádorového i nenádorového původu. Dostupný je v náplastech s řízeným uvolňováním 35 µg/h, 52,5 µg/h nebo 70 µg/h. Při potřebě uvolňování dávky nižší než 35 µg/h byl dosud v praxi využíván postup off‑label; náplast je možné rozstřihnout na dva (17,5 µg/h) nebo čtyři (8,75 µg/h) stejné díly, aniž by bylo porušeno řízené uvolňování léčivé látky. Nižší dávka buprenorfinu byla využívána zejména u středně silných nenádorových vertebrogenních bolestí nebo u bolestí kloubů.
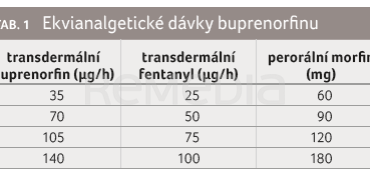 Buprenorfin má vysokou míru afinity k plazmatickým proteinům (96–98 %), nicméně váže se přednostně na alfa a beta globuliny a méně na albumin, díky čemuž má nižší interakční potenciál s jinými léky. V důsledku zvýšené lipofility prostupuje přes hematoencefalickou bariéru. Je metabolizován v játrech systémem cytochromu P450 (CYP3A4 a CYP2C8) za vzniku aktivního metabolitu norbuprenorfinu a dále prostřednictvím uridindifosfát glukuronosyltransferáz (UGT2B7 a UGT1A1) za vzniku neaktivního metabolitu norbuprenorfin glukuronidu. Zhruba 50–70 % léčiva se vylučuje stolicí, pouze 15 % močí, buprenorfin je proto možné využít u pacientů s renální insuficiencí a u nemocných s mírným a středně závažným jaterním selháváním bez nutnosti úpravy dávek. Ekvianalgetické dávky shrnuje tabulka 1.
Buprenorfin má vysokou míru afinity k plazmatickým proteinům (96–98 %), nicméně váže se přednostně na alfa a beta globuliny a méně na albumin, díky čemuž má nižší interakční potenciál s jinými léky. V důsledku zvýšené lipofility prostupuje přes hematoencefalickou bariéru. Je metabolizován v játrech systémem cytochromu P450 (CYP3A4 a CYP2C8) za vzniku aktivního metabolitu norbuprenorfinu a dále prostřednictvím uridindifosfát glukuronosyltransferáz (UGT2B7 a UGT1A1) za vzniku neaktivního metabolitu norbuprenorfin glukuronidu. Zhruba 50–70 % léčiva se vylučuje stolicí, pouze 15 % močí, buprenorfin je proto možné využít u pacientů s renální insuficiencí a u nemocných s mírným a středně závažným jaterním selháváním bez nutnosti úpravy dávek. Ekvianalgetické dávky shrnuje tabulka 1.
Výběr opioidu byl měl být individualizován pro konkrétního pacienta. Neexistuje jeden opioid, který by byl nadřazen ostatním, důležité je uvážit možné interakce a v úvahu vzít komorbidity nemocného. Například u pacienta s anamnézou prodloužení QT intervalu a/nebo při strukturálním onemocnění srdce či při arytmiích je doporučeno se vyhnout metadonu a buprenorfinu. Transdermální aplikace opioidu se nepovažuje za vhodnou pro pacienty s akutní nebo obtížně kontrolovatelnou bolestí. Pacientovu reakci na opioid nelze předvídat, je třeba též respektovat preference pacienta. Již od zahájení opioidní léčby je doporučeno podávat laxativa s cílem minimalizovat opioidy indukovanou dysfunkci střev. U pacientů s konstituční obstipací je doporučeno primárně využít periferního antagonistu opioidních receptorů (fixní kombinace oxykodon/naloxon).
Při zahájení léčby silným opioidem je doporučen pečlivý lékařský dohled, zejména během počáteční titrační fáze. Terapii by měl vést jeden lékař a přípravek by si měl pacient ideálně vyzvedávat v jedné lékárně. Pacienta je nutné edukovat ohledně pravidelné monitorace bolesti, aktivit a vedlejších účinků léčby. Počáteční léčebnou fázi je doporučeno vést jako terapeutický test po dobu několika týdnů až měsíců. Přednášející upozornila na nutnost pamatovat na možné interakce buprenorfinu s některými nádorovými léčivy (enzalutamid, ribociklib).
V závěru prezentace představila docentka Fricová nově dostupné přípravky pro léčbu bolesti (od 1. dubna 2023) – transdermální náplasti s obsahem buprenorfinu. Úhradu ze zdravotního pojištění mají aktuálně náplasti uvolňující dávky 5, 20, 30 a 40 µg/h. Jsou indikovány k terapii středně silné nenádorové bolesti u dospělých pacientů v případech, kdy je k dosažení dostatečné analgezie nutné podání opioidů. Nejsou vhodné k léčbě akutní bolesti. Během zahájení léčby může být potřeba podávat pacientům krátkodobě působící doplňková analgetika až do doby plné účinnosti přípravku. Medián doby, za kterou transdermální náplast o síle uvolňování 10 µg buprenorfinu/h dosáhne detekovatelné koncentrace, představuje 17 hodin. Dávku buprenorfinu je možné zvyšovat dle indikace po třech dnech, kdy se ustálí účinek podané dávky. Při zvyšování dávky se používaná dávka transdermální náplasti nahradí náplastí o vyšší síle nebo se k dosažení požadované dávky aplikuje na různá místa kombinace náplastí. Maximální celková uvolňovaná dávka buprenorfinu je 40 µg/h. Nedoporučuje se aplikovat více než dvě náplasti ve stejnou dobu. Přípravek se aplikuje každý sedmý den, což představuje pro pacienty i ošetřující personál jistě velkou výhodu.
Přednášející v závěru prezentace shrnula, proč pro léčbu zvolit buprenorfin. Buprenorfin má unikátní farmakologické vlastnosti a nabízí příznivější léčbu chronické bolesti. Působí jako parciální agonista na µ‑opioidních receptorech a jako antagonista na κ‑ a δ‑opioidních receptorech. Pravděpodobně působí více na míšní opioidní receptory než na mozkové, což potenciálně omezuje klasické nežádoucí účinky, které provázejí léčbu opioidy (euforie, závislost, respirační deprese). Buprenorfin má dostatečnou analgetickou účinnost, představuje bezpečnou a dobře tolerovanou léčbu bolesti. Výhodou terapie je jednoduchá manipulace s náplastí s prodlouženým intervalem výměny a snadná titrace dávky buprenorfinu.
Novinky v použití tapentadolu v léčbě akutní a chronické bolesti
MUDr. Marek Hakl, Ph.D., (Centrum léčby bolesti, Medicinecare s.r.o.), který navázal druhou přednáškou, v úvodu auditoriu připomněl definici bolesti a připojil, že bolest je vždy subjektivní. Zdůraznil, že bolest je to, co člověk cítí, když říká, že ho to bolí, a takto je třeba k pacientovi přistupovat – uvěřit mu jeho bolest a snažit se mu pomoci.
Akutní bolest je fyziologická a zachovává si svoji ochrannou funkci (bolest je symptomem). Je spojena se stimulací sympatiku, nastupuje okamžitě po podnětu a její trvání nepřekračuje tři měsíce. Má většinou ostrý, pálivý, řezavý charakter a emočně je spojena s úzkostí. Patří sem i chronicky se opakující záchvaty akutní bolesti (kolikovité). V léčbě je obvykle dostačující monoterapie analgetiky dle síly projevů.
Chronická bolest naproti tomu ztrácí svoji ochrannou funkci a stává se nemocí (bolest je syndromem). Trvá déle než tři měsíce, je spjata s aktivací parasympatiku a emočně s depresí. Nemusí vznikat bezprostředně po podnětu, často vzniká přechodem z bolesti akutní a emoce u ní hrají mnohem výraznější roli. Její léčba je obvykle komplikovanější.
Přednášející se dále zaměřil na tapentadol hydrochlorid, který je v České republice dostupný již od roku 2011. Jedná se o poslední objevenou molekulu ze skupiny opioidů. Má duální analgetický efekt – působí jako µ‑opioidní agonista a zároveň ovlivňuje zpětné vychytávání noradrenalinu (µ‑opioid receptor agonist‑noradrenalin reuptake inhibitor, MOR‑NRI). Stojí na pomezí mezi silným a slabým opioidem, jeho výdej je vázán na recept s modrým pruhem/e‑recept s označením „vysoce návyková látka“. Je indikován k terapii silné nenádorové bolesti. K dispozici je v lékové formě s postupným uvolňováním (retard) v dávkách 50–250 mg s dávkováním po 12 hodinách, ale rovněž v lékové formě s okamžitým uvolňováním v dávkách 50–100 mg, což je jeho velkou výhodou. Dle slov přednášejícího má bohužel systém dvojí úhrady ze zdravotního pojištění, vybrané odbornosti jej mohou předepisovat bez doplatku, ostatní lékaři s doplatkem. Jeho stropový efekt je 500 mg, což je dle zkušenosti MUDr. Hakla plně dostačující.
Na analgezii se podílejí oba mechanismy účinku. Bylo prokázáno, že MOR komponenta je významnější u nociceptivní bolesti a NRI komponenta u neuropatické bolesti. Tapentadol má velmi příznivý farmakologický profil. Nejedná se o proléčivo ani racemát, do těla se dostává již účinná látka, což se projeví rychlým nástupem účinku. Tapentadol hydrochlorid nemá aktivní metabolity, není tedy závislý na jaterních funkcích (není potřeba metabolická aktivace ani nehrozí jeho kumulace v organismu v důsledku tvorby aktivních metabolitů) a má nízký interakční potenciál (je nezávislý na systému cytochromu P450 a má nízkou vazebnost na plazmatické proteiny).
Přednášející vyzdvihl pozitiva léčby tapentadol hydrochloridem a upozornil na jeho široké využití: „Toto léčivo vyniká nízkým výskytem nežádoucích účinků, proto je indikováno jako šetrný opioid v případě gastrointestinální intolerance opioidů nebo při obstipaci indukované opioidy. Jako jeden z mála opioidů působí a má využití u neuropatické a smíšené bolesti – diabetické polyneuropatie, postherpetické neuralgie, bolesti zad u osteoartróz, osteoartritidy; dále v terapii akutní a chronické perzistentní bolesti pooperační a poúrazové. Indikací je středně silná až silná bolest akutní i chronická. Tapentadol hydrochlorid, na pomezí slabých a silných opioidů, lze použít jako opioid první volby u opioid naivních pacientů.“
Při srovnání s tramadolem vynikají vlastnosti tapentadol hydrochloridu. Tapentadol hydrochlorid je silný opioid a přináší lepší nociceptivní analgezii, tramadol patří mezi opioidy slabé. Tapentadol hydrochlorid inhibuje zpětné vychytávání noradrenalinu bez většího ovlivnění vychytávání serotoninu. Naproti tomu tramadol ovlivňuje vychytávání noradrenalinu i serotoninu, s čímž se pojí vyšší výskyt nežádoucích účinků. Tapentadol hydrochlorid má rychlý nástup účinku, u tramadolu je třeba jeho demetylace, účinek proto nastupuje až zhruba do jedné hodiny. Tapentadol hydrochlorid není metabolizován systémem cytochromu P450, a má proto nízký interakční potenciál. Naproti tomu tramadol je metabolizován CYP2D6, vstupuje do více lékových interakcí a vykazuje vyšší interindividuální variabilitu.
Přednášející na závěr připojil kazuistiku 67leté pacientky. Žena s nevýznamnou rodinnou anamnézou trpí koxartrózou III. stupně I. sin. a II. stupně I. dx., operační řešení zatím neindikováno. Dále byla u nemocné doložena dna, přítomny jsou degenerativní změny na bederní páteři. U praktického lékaře byla léčena tramadolem s postupným uvolňováním v dávce 150 mg 2× denně a indometacinem 100 mg v čípku aplikovaným večer. Dřívější pokusy o nasazení gabapentinu pacientka netolerovala pro ospalost, opakovaně prodělala rehabilitace, ale bez pravidelného cvičení. Dlouhodobě ji trápily bolesti bederní páteře s distribucí do pravé dolní končetiny, bolesti v oblasti kyčelního kloubu zejména při zatížení, s propagací bolesti do třísla. Stav byl farmakologicky kompenzován do doby před osmi měsíci, kdy po prodělané viróze došlo k významnému zhoršení, které přetrvává. Nemocná byla objednána k infuzní terapii – bez většího efektu. Následně došlo ke změně medikace: tramadol byl nahrazen oxykodonem 10 mg po 12 hodinách s dobrým analgetickým efektem (ústup bolesti o 30 %), avšak dva týdny přetrvávaly vertigo a nauzea. Indometacin byl nahrazen meloxikamem, indikována rotace opioidu, zahájena léčba transdermálním fentanylem 12 µg/h. Nicméně došlo ke zhoršení analgetického efektu pro velmi špatnou adhezi náplasti kvůli nadměrnému pocení pacientky. Pacientka se sama vrátila k tramadolu, ale následně byla převedena na tapentadol hydrochlorid 50 mg s prodlouženým uvolňováním, který byl podáván v intervalu 12 hodin. První týden pacientka uvádí přetrvávání vertiga, které následně ustupuje, bolesti zmírněny o 20 %. Po třech týdnech byla dávka navýšena na 100 mg 2× denně bez výskytu nežádoucích účinků, se zmírněním bolesti o 40–50 % a zlepšením funkční kapacity. Při další kontrole byl stav nezměněn a pacientka spokojena.
Druhá kazuistika představila 59letou pacientku, která se léčí pro arteriální hypertenzi dvojkombinací antihypertenziv a pro hypofunkci štítné žlázy dostává substituční terapii. Před šesti měsíci se náhle bez zjevné vyvolávající příčiny objevuje neuralgiformní bolest v oblasti 2. větve levého trigeminu. Praktický lékař nasadil tramadol v dávce 100 mg 2× denně a gabapentin s postupným tolerovaným navýšením v průběhu měsíce na 3× 300 mg. Bolesti však po dvou měsících přetrvávaly v nezměněné intenzitě, pacientka byla odeslána do centra bolesti, udává záchvatovitou bolest v oblasti 2. větve trigeminu, ostré, palčivé bolesti trvající 4–6 hodin, většinou ráno, VAS 7–9, se zhoršením při změnách počasí a stresu. Bylo zvažováno navýšení dávek gabapentinu (900 mg je minimální udržovací dávka) nebo výměna za karbamazepin 2× 200 mg, který je u neuralgie trigeminu lékem první volby. Vybrán byl karbamazepin, tramadol zatím ponechán pro odlišení nežádoucích účinků opioidů. Při kontrole pacientka udává částečné mírné zlepšení bolesti, při záchvatu stále VAS 6–7. Vzhledem k záchvatovitému charakteru bolesti byl vysazen tramadol a zahájena léčba tapentadol hydrochloridem 50 mg s okamžitým nástupem účinku („rychlý“ tapentadol hydrochlorid) s plánem výhledově přidat na noc amitriptylin. Při kontrole za tři týdny byla pacientka spokojená, VAS max. 4, amitriptylin nepřidán. V tomto případě se tapentadol hydrochlorid stal vhodnou záchrannou medikací u pacientky se záchvatovitou neuropatickou bolestí.
Doktor Hakl v závěru shrnul, že v současné době existuje řada léků, které pomáhají v boji s léčbou akutní i chronické bolesti. Inovace v oblasti farmakoterapie se soustřeďují zejména na redukci nežádoucích účinků, případně na posílení analgetického efektu. Tapentadol hydrochlorid jako nové analgetikum vyniká velmi dobrým analgetickým efektem i u neuropatické bolesti, zároveň s minimálním výskytem nežádoucích účinků.
Literatura
1. Schug SA. The atypical opioids: buprenorphine, tramadol and tapentadol. Medicine Today 2018; 19(9 Suppl): 5–11.
2. Ettienne EB, Chapman E, Maneno M, et al. Pharmacogenomics‑guided policy in opioid use disorder (OUD) management: An ethnically‑diverse case‑based approach. Addict Behav Rep 2017; 6: 8–14.
3. Likar R. Transdermal buprenorphine in the management of persistent pain – safety aspects. Ther Clin Risk Manag 2006; 2: 115–125.
4. Souhrn údajů o přípravku Buprenorfin Stada. Dostupné na: https://www.sukl.cz
5. Gudin J, Fudin J. A Narrative Pharmacological Review of Buprenorphine: A Unique Opioid for the Treatment of Chronic Pain. Pain Ther 2020; 9: 41–54.
6. Metodické pokyny pro farmakoterapii chronické bolesti, Kolektiv autorů (Fricová, Hakl, Hřib, Kozák, Lejčko, Sláma, Slíva). Bolest 2022; 25(Suppl 1).
7. Tzschentke TM, Jahnel U, Kogel B, et al. Tapentadol hydrochloride: a next‑generation, centrally acting analgesic with two mechanisms of action in a single molecule. Drugs Today (Barc) 2009; 45: 483–496.