Omezená pohyblivost cípů bioprotézy po katetrizační náhradě aortální chlopně – studie GALILEO‑4D
Souhrn:
Malý M. Omezená pohyblivost cípů bioprotézy po katetrizační náhradě aortální chlopně – studie GALILEO‑4D. Remedia 2020; 30: 133–135.
Subklinické ztluštění a omezená pohyblivost cípů bioprotézy po katetrizační náhradě aortální chlopně byla dokumentována pomocí 4D‑CT vyšetření. Studie zkoumala, zda výskyt tohoto fenoménu může být ovlivněn antikoagulační léčbou rivaroxabanem. V této podstudii hlavní studie GALILEO byli pacienti, kteří neměli indikaci k antikoagulační léčbě, po úspěšné katetrizační náhradě randomizováni k tříměsíční léčbě kombinací 10 mg rivaroxabanu s kyselinou acetylsalicylovou nebo k léčbě kombinační protidestičkovou léčbou klopidogrelem s kyselinou acetylsalicylovou. Kombinovaná léčba rivaroxabanem byla ve snížení výskytu abnormalit cípů účinnější než duální protidestičková léčba. Nicméně v hlavní studii byla léčba rivaroxabanem spojena s vyšší mortalitou a vyšším výskytem tromboembolických a krvácivých komplikací.
Summary:
Maly M. Reduced leaflet motion after transcatheter aortic valve replacement – GALILEO-4D trial. Remedia 2020; 30: 133–135.
Subclinical leaflet thickening and reduced leaflet motion of bioprosthetic aortic valves have been documented using four‑dimensional computed tomography (4D‑CT). The aim of this study was to establish whether anticoagulation with rivaroxaban can reduce these phenomena after transcatheter aortic‑valve replacement. In this substudy of the main GALILEO trial, the patients were randomized to the 3‑month treatment with combination of 10 mg rivaroxaban and aspirin or treatment with combination of clopidogrel with aspirin. Treatment with rivaroxaban was more effective than an antiplatelet‑based strategy in preventing subclinical leaflet motion abnormalities. However, in the main trial, the rivaroxaban‑based strategy was associated with a higher risk of death or thromboembolic complications and a higher risk of bleeding than the antiplatelet‑based strategy.
Key words: transcatheter aortic valve replacement, TAVR, rivaroxaban, 4D‑CT
Úvod
Katetrizační náhrada aortální chlopně (transcatheter aortic valve replacement, TAVR) se postupně stala standardem léčby významné aortální stenózy a spektrum jejích indikací se nadále rozšiřuje [1−3]. U biologických protéz – jak chirurgických, tak katetrizačních – bylo pomocí čtyřrozměrné výpočetní tomografie (4D CT) identifikováno ztluštění cípů a snížení jejich mobility. Několik observačních studií naznačovalo spojení tohoto fenoménu se zvýšeným rizikem ischemických cerebrovaskulárních příhod a vedlo k hypotéze možného prospěchu z perorální antikoagulační léčby [4]. Nicméně data z randomizovaných klinických studií dosud chyběla.
Rivaroxaban, přímý inhibitor faktoru Xa, byl registrován pro prevenci cévní mozkové příhody u pacientů s fibrilací síní a pro prevenci a léčbu žilní tromboembolické nemoci. Studie GALILEO (Global Study Comparing a Rivaroxaban Based Antithrombotic Strategy to an Antiplatelet Based Strategy after Transcatheter Aortic Valve Replacement to Optimize Clinical Outcome) zkoumala výsledek terapeutické strategie spočívající v podávání rivaroxabanu v dávce 10 mg denně pacientům, kteří neměli indikaci k antikoagulační léčbě a s úspěchem podstoupili TAVR, ve vztahu k výskytu tromboembolických příhod [5]. GALILEO 4D, podstudie hlavní studie GALILEO, sledovala vliv antikoagulační léčby rivaroxabanem na ztluštění cípů a jejich pohyblivost u pacientů s TAVR.
Metodika
GALILEO 4D byla randomizovaná podstudie s otevřeným uspořádáním a vlastním protokolem hodnotící výsledky léčby pomocí zobrazovacích metod. Do podstudie byli zařazeni pacienti starší 18 let, kteří úspěšně podstoupili TAVR v rámci hlavní studie a byli schopni a ochotni podrobit se vyšetření pomocí 4D CT. Vyloučeni byli pacienti s renální insuficiencí (definovanou jako vypočtená glomerulární filtrace < 30 ml/min/1,73 m2 povrchu těla), dialyzovaní pacienti, pacienti s alergickou reakcí na jodovou kontrastní látku nebo s dalšími kontraindikacemi k CT vyšetření. Pacienti byli randomizováni ve větvi s rivaroxabanem k léčbě rivaroxabanem podávaným v dávce 10 mg 1× denně spolu se 75–100 mg kyseliny acetylsalicylové 1× denně po dobu tří měsíců s následnou monoterapií rivaroxabanem v dávce 10 mg 1× denně. Ve větvi pouze s protidestičkovou léčbou byli pacienti po dobu tří měsíců léčeni kombinací 75–100 mg kyseliny acetylsalicylové 1× denně s klopidogrelem v dávce 75 mg 1× denně a poté monoterapií kyselinou acetylsalicylovou.
Zobrazovací protokol zahrnoval
kontrastní EKG gatované CT vyšetření srdce zachycující celý
srdeční cyklus, tzv. 4D CT, a transtorakální
echokardiografické vyšetření (TTE) během tříměsíční
kontroly. Radiační zátěž se pohybovala v rozsahu od 5
do 15 mS. Pohyblivost cípů byla klasifikována škálou 0−4
(čím vyšší hodnota, tím větší restrikce) a ztluštění
bylo posuzováno na základě multiplanárních řezů (obr. 1).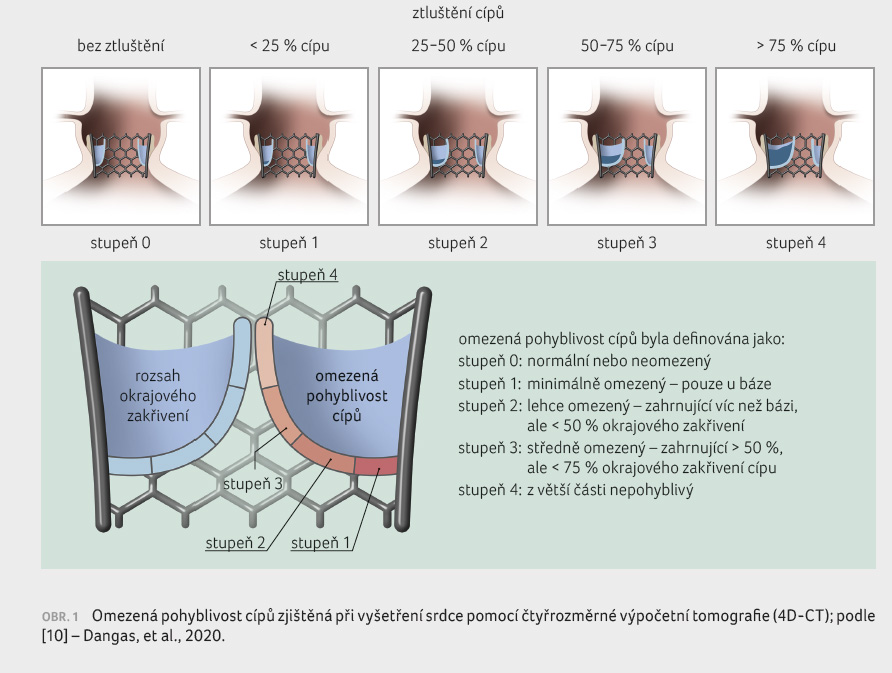
Všechny cílové ukazatele byly zaznamenány k 90. dni – v čase provádění 4D CT. Primárním cílovým ukazatelem byl podíl pacientů s omezením pohyblivosti alespoň jednoho cípu chlopně s hodnotou alespoň 3 na čtyřstupňové škále (zahrnující více než 50 % cípu). Sekundárními cílovými ukazateli byly procento cípů chlopní s omezením pohyblivosti ≥ 3, podíl pacientů s alespoň jedním ztluštělým cípem, procento ztluštělých cípů, transprotetický střední tlakový gradient na základě TTE a účinnostní a bezpečnostní ukazatele identické s hlavní studií GALILEO.
Výsledky
Na základě kalkulace statistické síly studie bylo plánováno zařadit 246 pacientů. Nakonec bylo zařazeno 231 pacientů, z nichž 115 bylo randomizováno do větve s rivaroxabanem a 116 do větve protidestičkové léčby.
Primární cílový ukazatel na základě
intention to treat analýzy (alespoň jeden cíp chlopně
s omezením pohyblivosti stupně 3 a více) ve skupině
léčené rivaroxabanem byl doložen u 2 z 97 pacientů
(2,1 %) a u 11 ze 101 pacientů (10,9 %)
ve skupině léčené protidestičkovou léčbou (p = 0,01),
graf 1.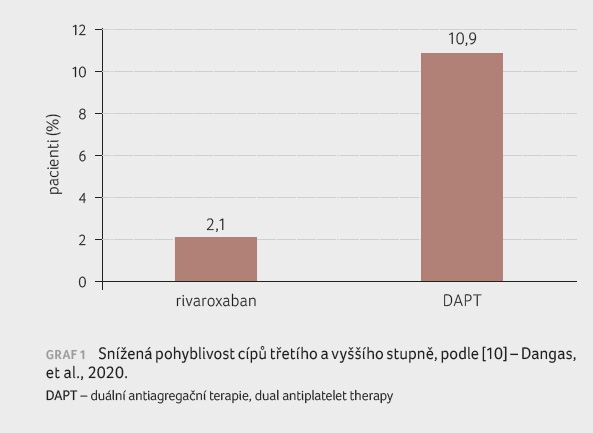
Sekundární cílový ukazatel na základě intention to treat analýzy – ztluštění alespoň jednoho cípu – byl ve skupině léčené rivaroxabanem zaznamenán u 12 z 97 pacientů (12,4 %) ve srovnání s 33 ze 102 pacientů (32,4 %) ve skupině léčené protidestičkovou léčbou, graf 2.
Výsledky TTE vyšetření se v různých echokardiografických parametrech nelišily. Středně závažná hemodynamická strukturální deteriorace chlopně byla identifikována u 4 z 207 pacientů (1,9 %). Dva pacienti měli nárůst středního tlakového gradientu alespoň o 10 mm Hg ve vztahu k základnímu vyšetření a jeden pacient měl trombózu cípů s projevy srdečního selhání.
Klinické příhody ve smyslu
velkého krvácení, tromboembolických příhod nebo úmrtí v 90
dnech se odehrály s frekvencí nižší než 3 % v obou
větvích a pouze tři pacienti v podstudii prodělali
ischemickou cévní mozkovou příhodu. Nízká frekvence výskytu
příhod neumožňovala statistickou analýzu.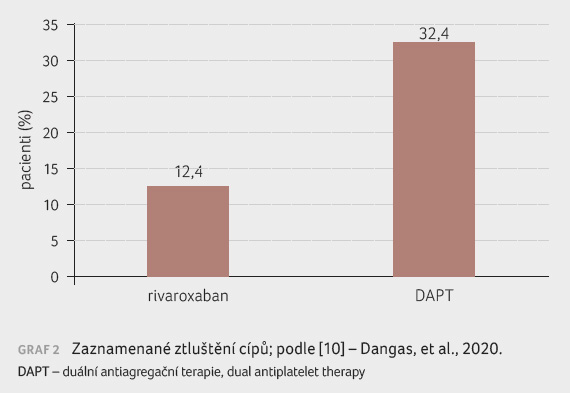
Diskuse
Studie GALILEO srovnávala kombinační léčbu rivaroxabanem s kyselinou acetylsalicylovou a kombinační protidestičkovou léčbu u pacientů po TAVR ve smyslu prevence tromboembolických příhod. Podstudie GALILEO 4D za použití 4D CT vyšetření zjišťovala stav bioprotézy 90. den od implantace. Bylo zjištěno, že celkový podíl pacientů s omezenou pohyblivostí cípů (stupeň 3 a vyšší) byl 6,6 % a ztluštění cípů bylo přítomno u 22,6 % pacientů. Oba nálezy se vyskytovaly s nižší frekvencí ve skupině pacientů léčených rivaroxabanem a echokardiografické vyšetření tyto rozdíly neidentifikovalo.
Subklinické ztluštění cípů a jejich omezená pohyblivost byly popsány v různém stupni jak u chirurgických, tak u katetrizačních bioprotéz [4,6]. Incidence ztluštění cípů je popisována v rozmezí od 7 do 15 %, ale v některých sděleních dosahovala až 38 % [7,8]. Nálezy ze studie GALILEO 4D nejsou zcela reprezentativní, neboť se jednalo o populaci, která neměla indikaci k antikoagulaci, na rozdíl od pacientů s fibrilací síní, jichž je mezi nemocnými podstupujícími TAVR 30−40 %, dále byli zařazeni pouze pacienti po úspěšné implantaci TAVR a byla podávána léčba 10 mg rivaroxabanu.
Předchozí observační data ukazují, že antikoagulace je spojena s nižším výskytem ztluštění cípů než antiagregační léčba [9]. Navíc, ve vztahu k tomuto jevu není duální antiagregace (která je po TAVR standardem léčby) účinnější než monoterapie [6]. Nicméně v těchto registrech nejsou data randomizována a byly použity různé antitrombotické režimy a různá dávkovací schémata.
V této randomizované studii byl podíl pacientů s omezenou pohyblivostí cípů a jejich ztluštěním nižší ve skupině léčené kombinací rivaroxabanu a kyseliny acetylsalicylové. Bez ohledu na pozitivní efekt léčby rivaroxabanem na 4D CT byla v hlavní studii GALILEO tato léčba ve srovnání s pouze protidestičkovou léčbou spojena s vyšším rizikem úmrtí nebo vzniku tromboembolických komplikací (poměr rizik, hazard ratio [HR] 1,35) a s vyšším rizikem život ohrožujících, invalidizujících nebo velkých krvácení (HR 1,5) [10]. Vzhledem k nízkému výskytu klinických příhod ve skupině pacientů podstupujících 4D CT vyšetření není možné omezení pohyblivosti či ztluštění cípů vztáhnout ke klinickým příhodám. Nedostatečná citlivost TTE pro tyto fenomény byla popsána již dříve a touto podstudií byla opětovně potvrzena.
Limitací studie je velikost souboru neumožňující interpretaci klinických příhod ve vztahu k omezené pohyblivosti a ztluštění cípů. Dále 4D CT vyšetření bylo provedeno pouze jednou, a to v době ukončení podávání kombinační léčby (ať už antikoagulační, či duální antiagregační), a tudíž nejsou data o dalším vývoji při monoterapii (rivaroxabanem nebo kyselinou acetylsalicylovou).
Závěrem lze tedy shrnout, že léčba kombinací 10 mg rivaroxabanu se 75−100 mg kyseliny acetylsalicylové je účinnější než duální protidestičková léčba v prevenci subklinické omezené pohyblivosti a ztluštění cípů bioprotézy po úspěšné TAVR 90 dnů od implantace. Nicméně kombinační antikoagulační léčbu v prevenci tohoto jevu nelze doporučit vzhledem k negativnímu výsledku hlavní studie GALILEO.
Seznam použité literatury
- [1] Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic‑valve replacement in high‑risk patients. N Engl J Med 2011; 364: 2187−2198.
- [2] Leon MB, Smith CR, Mack MJ, et al. Transcatheter or surgical aortic‑valve replacement in intermediate‑risk patients. N Engl J Med 2016; 374: 1609−1620.
- [3] Mack MJ, Leon MB, Thourani VH, et al. Transcatheter aortic‑valve replacement with a balloon‑expandable valve in low‑risk patients. N Engl J Med 2019; 380: 1695−1705.
- [4] Makkar RR, Fontana G, Jilaihawi H, et al. Possible subclinical leaflet Thrombosis in bioprosthetic aortic valves. N Engl J Med 2015; 373: 2015−2024.
- [5] Windecker S, Tijssen J, Giustino G, et al. Trial design: rivaroxaban for the prevention of major cardiovascular events after transcatheter aortic valve replacement: rationale and design of the GALILEO study. Am Heart J 2017; 184: 81–87.
- [6] Chakravarty T, Sřndergaard L, Friedman J, et al. Subclinical leaflet Thrombosis in surgical and transcatheter bioprosthetic aortic valves: an observational study. Lancet 2017; 389: 2383−2392.
- [7] Yanagisawa R, Hayashida K, Yamada Y, et al. Incidence, predictors, and mid‑term outcomes of possible leaflet Thrombosis after TAVR. JACC Cardiovasc Imaging 2016; 10: 1−11.
- [8] Vollema EM, Kong WKF, Katsanos S, et al. Transcatheter aortic valve thrombosis: the relation between hypo‑attenuated leaflet thickening, abnormal valve haemodynamics, and stroke. Eur Heart J 2017; 38: 1207−1217.
- [9] Ruile P, Jander N, Blanke P, et al. Course of early subclinical leaflet Thrombosis after transcatheter aortic valve implantation with or without oral anticoagulation. Clin Res Cardiol 2017; 106: 85−95.
- [10] Dangas GD, Tijssen JGP, Wöhrle J, et al. A controlled trial of rivaroxaban after transcatheter aortic‑valve replacement. N Engl J Med 2020; 382: 120−129.