Pacient s folikulárním lymfomem a subkutánní aplikací rituximabu
Rituximab – chimérická monoklonální protilátka proti antigenu CD20 – představuje v současné době standardní součást léčby nemocných s CD20 pozitivními nehodgkinskými lymfomy a chronickou lymfocytární leukemií. Je podáván jak v kombinaci s chemoterapií v rámci vstupní imunochemoterapie, tak i v rámci udržovací léčby s cílem prodloužit období bez progrese a v některých případech i celkové přežití nemocných. Standardní je dosud intravenózní podání léku. Existují ale již velmi slibná klinická data potvrzující jeho bezpečnost a účinnost při subkutánním podání. Cílem této publikace je popsat případ nemocné, která již byla v našich podmínkách léčena podkožní aplikací rituximabu, a okomentovat některé aspekty subkutánního podání rituximabu oproti dosud standardnímu intravenóznímu podání.
Úvod
Nehodgkinské lymfomy (NHL) jsou z hlediska incidence pátým nejčastějším zhoubným nádorem v naší populaci a jejich výskyt každým rokem narůstá asi o 4 %. V současné době je v České republice ročně diagnostikováno přes 1300 nemocných s NHL. Zavedení rituximabu, chimérické monoklonální protilátky anti-CD20, do léčby nehodgkinských B-lymfomů v roce 1997 dramaticky změnilo léčebné výsledky. Rituximab v kombinaci s chemoterapií se stal standardní léčbou u prakticky všech nemocných s CD20 pozitivními lymfomy. Velmi dobrá efektivita společně s minimální toxicitou vedly k tomu, že se udržovací léčba rituximabem (po dvou nebo třech měsících) stala standardní léčbou u nemocných s folikulárním lymfomem nebo u pacientů s lymfomem z buněk plášťové zóny. Standardní dávkování rituximabu představuje 375 mg/m2 podávaných formou intravenózní (i.v.) infuze. Při prvním podání je délka infuze cca 4–5 hodin, pokud se nevyskytnou během aplikace nežádoucí účinky v rámci první infuze, lze od druhé dávky v případě nemocných s lymfomy zkrátit podání na 90 minut [1].
Popis případu
V březnu 2010 byla odeslána na naše pracoviště, IV. interní hematologickou kliniku Fakultní nemocnice v Hradci Králové, 46letá pacientka s nově diagnostikovaným folikulárním lymfomem. U nemocné byly v rámci pravidelných mammologických kontrol zjištěny lehce zvětšené uzliny v axilách do 15 mm již v roce 2004. Nález byl sledován a postupně došlo k progresi velikosti uzlin až na 30 mm a v únoru 2010 byla nemocná odeslána na exstirpaci pravostranné axilární uzliny. V ní byl prokázán folikulární lymfom, grade 2, s typickým profilem dle imunohistochemického vyšetření (CD10 pozitivní, CD20 a bcl-2 pozitivní). Vstupně byla provedena standardní stagingová vyšetření, která prokázala kromě axilární i mnohočetnou paketující nitrobřišní lymfadenopatii s maximální velikostí uzlin 65 mm × 45 mm retroperitoneálně, současně i fokální postižení kostní dřeně dle trepanobiopsie. Systémové B-symptomy onemocnění nebyly přítomny. Stav onemocnění byl uzavřen jako pokročilé stadium IVA. Prognostické FLIPI (Follicular Lymphoma International Prognostic Index) skóre bylo 2 (střední riziko). Od 9. 4. 2010 byla zahájena standardní léčba režimem R-CHOP (rituximab 375 mg/m2 D1, cyklofosfamid 750 mg/m2 D1, doxorubicin 50 mg/m2 D1, vinkristin 2 mg D1 a prednison 100 mg D1-5). Celkem bylo podáno šest cyklů R-CHOP a následně dvě dávky rituximabu v monoterapii. Léčbou bylo dosaženo kompletní remise – výstupní vyšetření CT/PET (počítačová tomografie, pozitronová emisní tomografie) bylo negativní, stejně jako kontrolní vyšetření kostní dřeně. Vzhledem k velmi dobrému efektu indukční léčby byla následně od září 2010 zahájena udržovací léčba rituximabem, a to v dávkování 375 mg/m2 podávaných jednou za dva měsíce s plánem podávání po dobu dvou let (celkem 12 dávek).
Počátkem roku 2010 byla našemu centru nabídnuta účast v rámci mezinárodní randomizované klinické studie BP22333 (SparkThera). Studie měla dvě fáze. Do první fáze bylo zařazeno 124 pacientů s folikulárním lymfomem (nově diagnostikovaným nebo v relapsu), kteří byli po skončení indukční léčby imunochemoterapií léčeni minimálně jednou dávkou i.v. rituximabu v rámci udržovací léčby (ve frekvenci po 2 nebo 3 měsících). Tito nemocní byli randomizovaně rozděleni do skupin mezi standardní intravenózní a tři různě vysoké dávky podkožní (subkutánní, s.c.) aplikace rituximabu:
- rameno A: 375 mg/m2,
- rameno B: 625 mg/m2,
- rameno C: 800 mg/m2.
Cílem bylo zjistit, jaká dávka rituximabu s.c. je z farmakokinetického (PK) hlediska ekvivalentní dávce 375 mg/m2 pro i.v. podání. Z výsledků studie bylo na základě PK měření a výpočtů zjištěno, že ekvivalentní je fixní dávka 1400 mg s.c. Tato dávka pak byla testována dále ve druhé fázi studie, do níž bylo zařazeno dalších 154 nemocných randomizovaně rozdělených v poměru 1 : 1 mezi s.c. a i.v. podání v rámci udržovací léčby (po dvou nebo po třech měsících). Účast v uvedené fázi II studie byla nabídnuta také této nemocné. Pacientka souhlasila a po splnění veškerých vstupních kritérií studie byla následně randomizována, a to do ramene s dávkou rituximabu 1400 mg s.c. Rituximab byl podán formou krátké, přibližně 6minutové podkožní injekce. Jedinou komplikací bylo mírné zarudnutí v místě aplikace léku, které se objevilo za několik minut po prvním podání léku a mělo průměr cca 8 cm, ale postupně spontánně do dvou dnů zcela vymizelo. Následně dle protokolu pacientka dostala dalších 10 dávek rituximabu s.c. podávaných po dvou měsících, léčba probíhala bez dalších komplikací. Díky tomu, že léčba podkožní aplikací rituximabu nebyla pro pacientku nijak časově náročná, mohla nemocná již v průběhu terapie znovu nastoupit do práce, což pro ni představovalo velké psychické povzbuzení a návrat do normálního života.
Celkově bylo v našem centru v Hradci Králové odléčeno 11 pacientů subkutánním rituximabem v rámci fáze I a II studie SparkThera. Kromě výše zmíněných přechodných lokálních reakcí po subkutánním podání, které jsme zaznamenali u 4 z 11 nemocných, se nevyskytly žádné jiné podstatné komplikace.
Diskuse
Popsaný případ nemocné léčené podkožní formou podání rituximabu v rámci klinické studie SparkThera představoval v České republice zatím jedinou cestu, jak si nemocní mohli vyzkoušet tuto inovativní formu podání. V rámci studie SparkThera byly v ČR léčeny sice takřka tři desítky nemocných, přesto praktické zkušenosti s tímto podáním jsou zatím omezené. Dle publikovaných výsledků několika mezinárodních klinických studií se ale tato forma jeví pro běžnou praxi v blízké budoucnosti jako velmi zajímavá. Hlavním problémem s.c. aplikace byla v případě rituximabu nutnost podat relativně velký objem léku (celkem cca 11 ml) do podkoží. Extracelulární matrix je schopna bez problémů pojmout jen cca 1–2 ml roztoku, při větším objemu již dochází k poškození podkožní tkáně, což způsobuje nemocnému bolest. Tento problém byl v případě s.c. podání rituximabu vyřešen dosažením zhruba 12násobné koncentrace léku pro s.c. podání oproti i.v. formě a současně jeho kombinací s rekombinantní hyaluronidázou (rHuPH20). Tento enzym je schopen pomocí hydrolýzy hyaluronanu (glykosaminoglykan, součást extracelulární matrix) dosáhnout přechodného, reverzibilního rozvolnění podkoží a zajistit tak optimální vstřebání léku do oběhu i při podání většího objemu [2].
Vývoj s.c. podání rituximabu byl zahájen standardními klinickými hodnoceními fáze I. Cílem farmakokinetických studií tak bylo zjistit, zda s.c. podání rituximabu je z tohoto pohledu minimálně srovnatelné s i.v. podáním. Klíčovým ukazatelem pro toto porovnání je tzv. ctrough koncentrace léku. Jedná se o nejnižší úroveň koncentrace léku, na kterou klesne jeho hladina mezi jednotli![Obr. 1 Ukázka mírné lokální reakce po s.c. podání rituximabu; podle [7] – Salar, et al., 2010.](https://www.remedia.cz/photo-a-29750---.jpg) vými cykly [3]. Jak již bylo zmíněno výše, rituximabu 375 mg/m2 i.v. je ekvivalentní fixní dávka 1400 mg s.c. [4]. Nejčastějšími nežádoucími účinky při s.c. podání byly mírné lokální reakce charakteru lokálního erytému (u 31 % pacientů při s.c. podání ve fázi I studie BP22333 oproti 4 % při i.v. podání). Vesměs se ale jednalo o přechodné a mírné lokální reakce – viz obr. 1 – podobné, jaké jsme pozorovali u pacientky v kazuistice. Tolerance s.c. podání u pacientů v klinických studiích byla celkově velmi dobrá [5].
vými cykly [3]. Jak již bylo zmíněno výše, rituximabu 375 mg/m2 i.v. je ekvivalentní fixní dávka 1400 mg s.c. [4]. Nejčastějšími nežádoucími účinky při s.c. podání byly mírné lokální reakce charakteru lokálního erytému (u 31 % pacientů při s.c. podání ve fázi I studie BP22333 oproti 4 % při i.v. podání). Vesměs se ale jednalo o přechodné a mírné lokální reakce – viz obr. 1 – podobné, jaké jsme pozorovali u pacientky v kazuistice. Tolerance s.c. podání u pacientů v klinických studiích byla celkově velmi dobrá [5].
Jaké jsou potenciální praktické dopady a potenciální výhody s.c. aplikace rituximabu? Ročně je v České republice léčeno rituximabem zhruba 1300 nemocných. Standardní i.v. podání trvá při první infuzi přibližně 4 hodiny. Pokud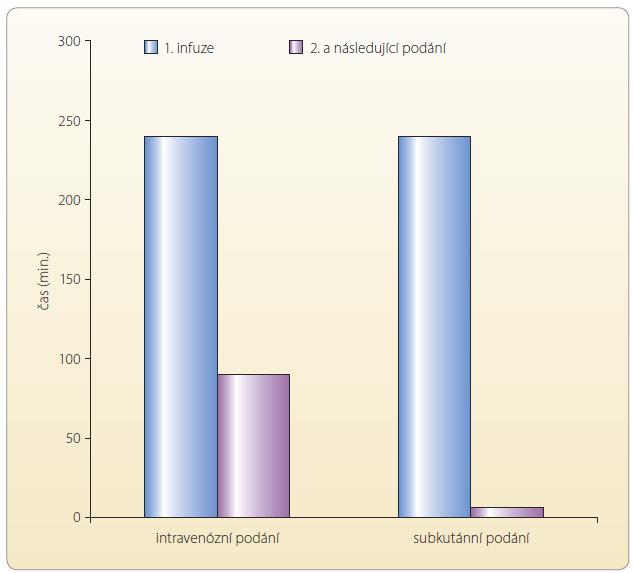 se nevyskytnou komplikace, lze při dalších cyklech rituximab bezpečně podat během cca 1,5 hodiny. I v případě plánovaného s.c. podání bude nutno první infuzi podat intravenózně. Samotnou s.c. aplikaci je doporučováno podat během cca 6minutové pomalé podkožní injekce. Časová úspora z pohledu nemocného, ale i z pohledu obsluhujícího personálu se tak jeví jako velmi významná – viz graf 1 [6]. Abychom si mohli představit, o jak významnou úsporu času se může v běžném klinickém provozu jednat, zkusíme namodelovat oba tyto přístupy z hlediska časové náročnosti a porovnat je. Během roku 2013 bylo na IV. interní hematologické klinice FN Hradec Králové léčeno rituximabem celkem asi 200 nemocných s lymfomy. Medián počtu dávek rituximabu podaných v kombinaci s chemoterapií i při udržovací léčbě byl 6 (6–12). Za předpokladu, že by všichni nemocní v budoucnu dostali první dávku intravenózně (4 hod.) a ostatní cykly subkutánně (6 min.), vychází porovnání časové náročnosti obou postupů pro tuto skupinu ve prospěch subkutánního podání – viz tab. 1.
se nevyskytnou komplikace, lze při dalších cyklech rituximab bezpečně podat během cca 1,5 hodiny. I v případě plánovaného s.c. podání bude nutno první infuzi podat intravenózně. Samotnou s.c. aplikaci je doporučováno podat během cca 6minutové pomalé podkožní injekce. Časová úspora z pohledu nemocného, ale i z pohledu obsluhujícího personálu se tak jeví jako velmi významná – viz graf 1 [6]. Abychom si mohli představit, o jak významnou úsporu času se může v běžném klinickém provozu jednat, zkusíme namodelovat oba tyto přístupy z hlediska časové náročnosti a porovnat je. Během roku 2013 bylo na IV. interní hematologické klinice FN Hradec Králové léčeno rituximabem celkem asi 200 nemocných s lymfomy. Medián počtu dávek rituximabu podaných v kombinaci s chemoterapií i při udržovací léčbě byl 6 (6–12). Za předpokladu, že by všichni nemocní v budoucnu dostali první dávku intravenózně (4 hod.) a ostatní cykly subkutánně (6 min.), vychází porovnání časové náročnosti obou postupů pro tuto skupinu ve prospěch subkutánního podání – viz tab. 1.
Takto významná potenciální časová úspora představuje vzhledem k velkému počtu nemocných léčených rituximabem z provozního hlediska velmi zajímavý aspekt. Věříme, že tuto úsporu času jistě ocení i samotní pacienti. Mnohým z nich tak nový způsob podání rituximabu umožní pokračovat v běžné práci i během léčby. Závěrem lze konstatovat, že podkožní aplikace rituximabu představuje do budoucna velmi nadějnou formu podání léku, která přináší celou řadu potenciálních výhod oproti intravenóznímu podání. Jedná se o rychlý, praktický, ale zároveň bezpečný a z hlediska porovnání účinnosti s i.v. aplikací srovnatelný způsob podání léku. Tato forma může být do budoucna velkým posunem jak pro nemocné, tak i pro ošetřující personál. Nezanedbatelné nejsou ani časové a finanční úspory spojené s podkožním podáním. Rituximab s.c. je nyní schválen pro použití v kombinaci s chemoterapií u pacientů s difuzním B-velkobuněčným a folikulárním lymfomem a dále pro udržovací léčbu pacientů s folikulárním lymfomem, kteří odpověděli na indukční léčbu. V České republice se očekává, že s.c. forma rituximabu bude k dispozici pro naše nemocné v závěru roku 2014.
časová úspora představuje vzhledem k velkému počtu nemocných léčených rituximabem z provozního hlediska velmi zajímavý aspekt. Věříme, že tuto úsporu času jistě ocení i samotní pacienti. Mnohým z nich tak nový způsob podání rituximabu umožní pokračovat v běžné práci i během léčby. Závěrem lze konstatovat, že podkožní aplikace rituximabu představuje do budoucna velmi nadějnou formu podání léku, která přináší celou řadu potenciálních výhod oproti intravenóznímu podání. Jedná se o rychlý, praktický, ale zároveň bezpečný a z hlediska porovnání účinnosti s i.v. aplikací srovnatelný způsob podání léku. Tato forma může být do budoucna velkým posunem jak pro nemocné, tak i pro ošetřující personál. Nezanedbatelné nejsou ani časové a finanční úspory spojené s podkožním podáním. Rituximab s.c. je nyní schválen pro použití v kombinaci s chemoterapií u pacientů s difuzním B-velkobuněčným a folikulárním lymfomem a dále pro udržovací léčbu pacientů s folikulárním lymfomem, kteří odpověděli na indukční léčbu. V České republice se očekává, že s.c. forma rituximabu bude k dispozici pro naše nemocné v závěru roku 2014.
Seznam použité literatury
- [1] Dakhil S, Hermann R, Schreeder MT, et al. Phase III safety study of rituximab administered as a 90-minute infusion in patients with previously untreated diffuse large B-cell and follicular lymphoma. Leuk Lymphoma 2014 Mar 7. [Epub ahead of print].
- [2] Bookbinder LH, Hofer A, Haller MF, et al. A recombinant human enzyme for enhanced interstitial transport of therapeutics. J Control Release 2006; 114: 230–241. Epub 2006 Jun 7.
- [3] Shpilberg O, Jackisch C. Subcutaneous administration of rituximab (MabThera) and trastuzumab (Herceptin) using hyaluronidase. Br J Cancer 2013; 109: 1556–1561. doi: 10.1038/bjc.2013.371. Epub 2013 Sep 3.
- [4] Salar A, et al. Final results of stage 1 of a phase IB Study to investigace the pharmacokinetics (PK), Safety, and Tolerability of subcutaneous rituximab in follicular lymphoma (FL) as part of maintenance treatment. Hematologica 2012; 97: s. 325, abstrakt 0794.
- [5] Salar A, Avivi I, et al. Final results of the BP 22333 study demonstrate non inferior pharmacokinetics and safety of subcutaneous versus intravenous rituximab as maintenance therapy for follicular lymphoma. Hematol Oncol 2013; 31 (dopl. 1): s. 195.
- [6] Gilbert D, Cothran D. SC versus IV delivery: reducing costs while increasing patient satisfaction. Hematol Oncol News Issues. Dec 25–27.
- [7] Salar A, Bouabdallah R, McIntyre C, et al. A two-stage phase Ib study to investigate the pharmacokinetics, safety and tolerability of subcutaneous rituximab in patients with follicular lymphoma as part of maintenance treatment. Program and abstracts of the 2010 ASH Annual Meeting, December 4–7, 2010; Orlando, Florida, USA: Abstract 2858 (poster).