Palbociklib v léčbě karcinomu prsu
Souhrn:
Kubeček O. Palbociklib v léčbě karcinomu prsu. Remedia 2018; 28: 353–356.
Karcinom prsu je nejčastějším zhoubným nádorem u žen. Přibližně v 70 % lze prokázat expresi hormonálních receptorů. Hormonální léčba by měla být vzhledem ke svému příznivému toxikologickému profilu preferovanou léčebnou alternativou všude tam, kde lze očekávat její účinnost. Inhibitory cyklin‑dependentních kináz 4/6 (CDK4/6) jsou novou farmakologickou skupinou, která významně zvyšuje účinnost hormonální terapie a představuje jeden z prostředků pro překonání hormonální rezistence. Palbociklib je prvním zástupcem této skupiny schváleným v klinické praxi. Jedná se o perorálně podávaný, vysoce selektivní, reverzibilní inhibitor CDK4/6, který prokázal svoji účinnost v první i druhé linii léčby metastatického, hormonálně dependentního, HER2 negativního karcinomu prsu v kombinaci s letrozolem, respektive fulvestrantem. Článek shrnuje výsledky uskutečněných klinických studií, současné postavení palbociklibu v léčebném algoritmu a perspektivy jeho dalšího využití.
Summary:
Kubecek O. Palbociclib in the treatment of breast cancer. Remedia 2018; 28: 353–356.
Breast cancer is the most common malignancy and the leading cause of cancer‑related death in women worldwide. Approximately 70% of breast cancer cases are hormone receptor‑positive. Considering its favorable toxicity profile, endocrine therapy should be the preferred treatment option in all appropriate cases. Inhibitors of cyclin‑dependent kinase 4/6 (CDK4/6) comprise a new class of drugs that enhance the efficacy of endocrine therapy and represent an effective strategy in overcoming endocrine resistance. In this regard, palbociclib is a first‑in‑class, highly selective inhibitor of CDK4/6 that has gained approval in the treatment of hormone receptor‑positive, HER2‑negative advanced or metastatic breast cancer in combination with letrozole or fulvestrant during first and second line settings, respectively. This review provides information on key clinical trials, current state of the treatment algorithm and future perspectives.
Key words: breast cancer, metastasis, cyclin‑dependent kinases, drug resistance, palbociclib.
Úvod
Karcinom prsu je celosvětově nejčastějším zhoubným nádorem u žen. Přibližně u 70 % lze prokázat expresi hormonálních receptorů (luminální typ A nebo B) [1]. Přítomnost a míra exprese estrogenových (ER) a progesteronových (PR) receptorů určuje nejen biologické vlastnosti nádoru, ale slouží i jako významný prediktor odpovědi na hormonální léčbu [2]. Oproti chemoterapii představuje hormonální léčba lépe tolerovanou alternativu, která zachovává dobrou kvalitu života a lze ji nabídnout i pacientkám se závažnějšími komorbiditami. U nemocných s generalizovaným onemocněním tak představuje první volbu všude tam, kde lze očekávat její účinnost. Určitým úskalím hormonální terapie je poměrně dlouhý časový interval nutný pro dosažení léčebné odpovědi, což vylučuje její použití v případě tzv. viscerální krize, tedy stavu charakterizovaného hrozícím orgánovým selháním z důvodu rozsáhlého metastatického postižení [3]. Naopak prostá přítomnost viscerálních metastáz není překážkou pro použití hormonální léčby. Druhým úskalím je fakt, že po určité době dochází prakticky bez výjimky ke ztrátě citlivosti nádorových buněk k léčbě, k tzv. sekundární rezistenci. Část pacientek je navíc k hormonální léčbě rezistentní de novo (primární rezistence). Existuje několik mechanismů, které jsou za rozvoj rezistence zodpovědné, jako např. inaktivace přirozených inhibitorů cyklin dependentních kináz a aktivace signálních drah nezávislých na ER (dráhy PI3K/AKT a HER2), které vedou ke zvýšené aktivitě cyklin dependentních kináz 4 a 6 (CDK4/6). Právě inhibice CDK4/6 se v současnosti jeví jako perspektivní přístup pro zvrácení rezistence k hormonální léčbě.
Palbociklib je historicky vůbec prvním zástupcem skupiny inhibitorů CDK4/6 uvedeným do klinické praxe. Jedná se o perorálně podávaný, vysoce selektivní, reverzibilní inhibitor CDK4/6, který v mikromolárních koncentracích inhibuje komplexy CDK4/cyklin D1, CDK4/cyklin D3 a CDK6/cyklin D2, zatímco aktivita ostatních proteinkináz není ovlivněna [4]. Bylo prokázáno, že účinek palbociklibu je synergický s hormonální blokádou zprostředkovanou účinkem tamoxifenu, letrozolu i fulvestrantu [5,6]. Obdobný synergický efekt byl zaznamenán i v případě kombinace s trastuzumabem u HER2 pozitivního luminálního karcinomu prsu [5]. Palbociklib je podáván v dávce 125 mg jednou denně po dobu 21 dní, po kterých následuje týdenní pauza v rámci 28denního cyklu. V případě toxicity lze dávku redukovat na 100 mg, respektive 75 mg denně [7].
Klinické zkušenosti
Studie PALOMA 1/TRIO 18
Pilotní studie fáze II PALOMA 1/TRIO 18 hodnotila bezpečnost a efektivitu kombinace palbociklibu s letrozolem v první linii ER pozitivního, HER2 negativního (ER+/HER2 ) metastatického karcinomu prsu [8]. Do studie mohly být zařazeny pacientky, které v minulosti nebyly léčeny hormonální terapií nebo ukončily adjuvantní hormonální terapii alespoň jeden rok před zařazením. Pacientky byly v počátcích studie děleny do dvou kohort. Kritériem pro zařazení do první kohorty byla pouze přítomnost ER+/HER2– onemocnění. Pacientky ve druhé kohortě musely navíc splňovat podmínku přítomnosti amplifikace genu pro cyklin D1 (CCND1), ztrátu proteinu p16 (INK4A nebo CDKN2A) nebo obojí. Cílem tohoto uspořádání bylo zhodnotit, zda má smysl pacientky dále selektovat na základě výše uvedených biomarkerů. Nábor do druhé kohorty byl však předčasně ukončen po neplánované interim analýze. Ta byla provedena poté, kdy investigátoři zaznamenali téměř dvojnásobný počet nemocných vyřazených ze studie z důvodu progrese v kontrolní skupině. Byla zaznamenána klinicky významná účinnost palbociklibu v kombinaci s letrozolem (poměr rizik [HR] 0,35; 95% interval spolehlivosti [CI] 0,17‒0,72; p = 0,006) [8]. Tato interim analýza také prokázala, že další selekce pacientů založená na stanovení amplifikace CCND1 a na ztrátě p16 pravděpodobně nepovede ke zlepšení výsledků.
Finální statistické zhodnocení bylo provedeno po sloučení obou kohort. Celkem bylo zařazeno 165 pacientek, 84 do ramene s palbociklibem a letrozolem, 81 do ramene s letrozolem. Studie splnila svůj primární cíl ‒ pacientky léčené palbociklibem dosáhly téměř dvojnásobné délky přežití bez progrese (progression free survival, PFS) ‒ 10,2 měsíce vs. 20,2 měsíce; HR 0,488; 95% CI 0,319–0,748; p = 0,0004. Prodloužení PFS zůstalo signifikantní i po vyhodnocení obou kohort zvlášť a bylo statisticky významné u všech podskupin pacientek. Léčebná odpověď (response rate, RR) byla vyšší v rameni s palbociklibem a letrozolem než v rameni s letrozolem (55 % vs. 39 %; p = 0,047), stejně tak i klinický přínos (81 % vs. 58 %; p = 0,0009) [8]. Studie nebyla uspořádána pro průkaz rozdílu v celkovém přežití (overall survival, OS), nicméně byl patrný trend ve prospěch ramene s kombinací palbociklibu a letrozolu (medián OS 37,5 měsíce vs. 34,5 měsíce; HR 0,897; 95% CI 0,623‒1,294; p = 0,281) [9]. Na základě studie PALOMA 1 byl palbociklib schválen Úřadem pro kontrolu potravin a léčiv (FDA) pro léčbu první linie ER+/HER2- metastatického karcinomu prsu.
Studie PALOMA 2
Stejnou léčebnou kombinaci hodnotila randomizovaná, placebem kontrolovaná klinická studie fáze III PALOMA 2 [10]. Celkem 666 postmenopauzálních pacientek, které v minulosti nepodstoupily léčbu pro pokročilé onemocnění, bylo zařazeno v poměru 2 : 1 do ramene s palbociklibem a letrozolem, respektive s letrozolem a placebem. Pacientky byly stratifikovány podle lokalizace metastatického postižení (viscerální vs. nonviscerální), podle intervalu od dokončení (neo)adjuvantní léčby (≤ 12 měsíců vs. > 12 měsíců vs. pacientky s primárně metastatickým onemocněním) a podle předléčenosti hormonální terapií. Studie dosáhla svého primárního cíle, PFS bylo prodlouženo o přibližně 10 měsíců ve prospěch experimentálního ramene (24,8 měsíce vs. 14,5 měsíce; HR 0,58; 95% CI 0,46‒0,72; p < 0,001). Kombinace s palbociklibem vedla také ke zlepšení RR (35 % vs. 42 %) a klinického přínosu (70 % vs. 85 %). Výsledky této studie jsou tedy konzistentní s výsledky studie PALOMA 1.
Z léčby měly prospěch všechny skupiny pacientek bez ohledu na stratifikační faktory a další charakteristiky, jakými byly např. věk, rasa, předchozí chemoterapie, viscerální postižení nebo onemocnění omezené na skelet [10]. Poolovaná analýza studií PALOMA 1 a PALOMA 2 potvrdila přínos přidání palbociklibu ve smyslu prodloužení PFS v celkové populaci i ve skupině starších pacientek [11]. Analýzou biomarkerů spjatých s buněčným cyklem (ER, Rb, p16, cyklin D1 a Ki 67) se nepodařilo identifikovat žádný, který by predikoval větší přínos z léčby palbociklibem [12].
Studie PALOMA 3
PALOMA 3 byla randomizovaná klinická studie fáze III hodnotící efektivitu palbociklibu v kombinaci s fulvestrantem oproti fulvestrantu s placebem u pacientek s ER+/HER2– karcinomem prsu po progresi na hormonální terapii [13]. Na rozdíl od předchozích dvou studií mohly být zařazeny i pacientky peri a premenopauzální, které tvořily celkem 21 % studijní populace. Podmínkou pro jejich zařazení byla alespoň čtyři týdny trvající terapie goserelinem, analogem hormonu uvolňujícího luteinizační hormon (LHRH). Povolena byla jedna předchozí linie chemoterapie pro pokročilé onemocnění. Pacientky byly randomizovány v poměru 2 : 1 do ramene s léčbou palbociklibem a fulvestrantem (n = 347) nebo s fulvestrantem a placebem (n = 174). Stratifikace proběhla podle citlivosti na předchozí hormonální terapii, podle menopauzálního stavu v době zahájení studie a přítomnosti viscerálních metastáz. I tato studie prokázala signifikantní prodloužení PFS v rameni s palbociklibem (PFS 9,5 měsíce vs. 4,6 měsíce; HR 0,46; 95% CI 0,36‒0,59; p < 0,0001). Prospěch byl zaznamenán napříč všemi predefinovanými podskupinami pacientek bez ohledu na menopauzální stav, míru hormonální rezistence a přítomnost mutace genů PIK3CA a ESR1 stanovenou z cirkulující DNA. Ve shodě s výsledky studie PALOMA 2 nebyla efektivita palbociklibu závislá na míře exprese hormonálních receptorů [12,13].
Výsledky studie PALOMA 3 ukazují, že terapie palbociklibem u premenopauzálních pacientek, které současně užívají analoga LHRH, je stejně účinná jako u pacientek postmenopauzálních. Léčebná odpověď byla zaznamenána u 24,6 % pacientů v rameni s palbociklibem a fulvestrantem vs. u 10,9 % pacientů v rameni s fulvestrantem a placebem (poměr šancí [OR] 2,69; 95% CI 1,43‒5,26; p = 0,0012) [13]. Z dostupných dat vyplývá, že prospěch z léčby palbociklibem přetrvává i po progresi onemocnění [14]. Terapie palbociklibem a fulvestrantem vedla k prodloužení času do zahájení následující linie léčby a nesnižovala její přínos [14].
Přes konzistentní a velice povzbudivé výsledky prodloužení PFS napříč zmíněnými klinickými studiemi doposud nemáme důkaz o tom, že by se tento parametr promítl do prodloužení OS. Zatím jediné dostupné výsledky týkající se OS pocházejí ze studie PALOMA 1, kde byl zaznamenán pozitivní trend ve smyslu prodloužení OS v rameni s palbociklibem a letrozolem. Ten však nedosáhl statistické významnosti [9]. Dostupné studie fáze III nemají statistickou sílu prokázat rozdíl v OS, možností tak do budoucna zůstává provedení metaanalýzy. Je však otázkou, zda je validní analýza OS vůbec realizovatelná. Generalizovaný karcinom prsu je onemocnění s dlouhým časovým průběhem a pacientky zpravidla podstoupí velké množství léčebných režimů, jejichž variabilita v rámci sledovaných kohort může výsledky zkreslit.
Toxicita
Obecně lze říci, že léčba
palbociklibem je dobře tolerována. Toxikologický profil
palbociklibu je dán zejména jeho účinkem na proliferující
hematopoetické buňky. Nejčastějším nežádoucím účinkem
palbociklibu jsou neutropenie a leukopenie, které však jen
velmi zřídka vedou k rozvoji febrilní neutropenie (< 2 %).
Neutropenie byla v rámci zmíněných klinických studií
zaznamenána u 74‒81 % pacientek, v 54‒67 % se
jednalo o neutropenii 3.‒4. stupně [8‒10,13]. Přes
poměrně vysokou incidenci neutropenie je však výskyt infekčních
komplikací vzácný. Příčinou je fakt, že charakter neutropenie
indukované palbociklibem se liší od neutropenie doprovázející
cytostatickou léčbu. Zatímco chemoterapie vyvolává apoptózu
progenitorových buněk krvetvorby, efekt palbociklibu na kostní
dřeň je reverzibilní, odezní po přerušení léčby a nemá
kumulativní charakter [15]. Chemoterapie je navíc častěji
komplikována mukozitidou a kožní toxicitou, které usnadňují
průnik infekčních patogenů [16]. Neutropenie indukovaná
palbociklibem je poměrně snadno zvládnutelná přeruš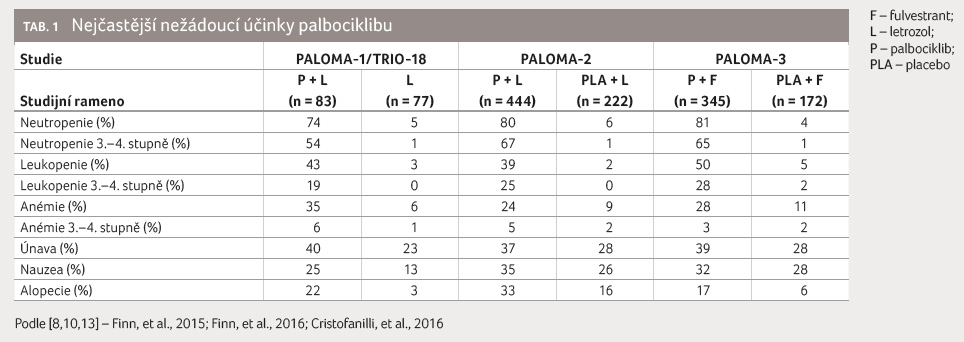 ením léčby
nebo snížením dávky, což nevede ke zhoršení výsledků
terapie [17]. Mezi další častější nežádoucí účinky užívání
palbociklibu patří anémie, únava, nauzea a alopecie (tab. 1).
ením léčby
nebo snížením dávky, což nevede ke zhoršení výsledků
terapie [17]. Mezi další častější nežádoucí účinky užívání
palbociklibu patří anémie, únava, nauzea a alopecie (tab. 1).
Postavení v léčbě
Podle aktuálních doporučení NCCN (National Comprehensive Cancer Network) je palbociklib v kombinaci s letrozolem indikován v první linii léčby metastatického ER+/HER2– karcinomu prsu. V kombinaci s fulvestrantem jej lze použít ve druhé linii léčby po selhání hormonální terapie, a to jak u premenopauzálních, tak u postmenopauzálních pacientek. U premenopauzálních pacientek je však nutná současná chirurgická kastrace nebo užívání LHRH analog [18]. Subanalýza studií PALOMA 2 a PALOMA 3 nenalezla biomarkery, které by byly spjaty s lepší odpovědí na léčbu palbociklibem [12,13]. Dosud tak nemáme spolehlivý prediktor účinnosti a otázkou zůstává, u kterých pacientek se ke kombinované léčbě přiklonit. U pacientek s metastatickým onemocněním omezeným na skelet bude pravděpodobně dostatečná samotná hormonální léčba (fulvestrant, inhibitory aromatázy, případně tamoxifen u premenopauzálních pacientek). Naopak pacientky s viscerálním postižením se zdají být ke kombinované léčbě vhodné.
U části z nich lze navíc v kombinaci palbociklibu s hormonální terapií spatřit účinnou a lépe tolerovanou alternativu chemoterapie. Metaanalýza z roku 2016 ukázala, že v porovnání s některými chemoterapeutickými režimy dosahuje kombinovaná hormonální terapie s palbociklibem lepších výsledků ve smyslu PFS a doby do progrese onemocnění [19]. Také léčebná odpověď, která při podávání kombinace palbociklibu s fulvestrantem dosahovala 25 %, je srovnatelná s historickými daty pro cytotoxickou léčbu [20]. U skupiny pacientek s tzv. viscerální krizí však chemoterapie zůstává první volbou [21]. Důvodem je fakt, že doba do dosažení klinické odpovědi je u kombinované léčby s palbociklibem delší než u chemoterapie (přibližně čtyři měsíce pro palbociklib s fulvestrantem) [13].
Perspektivy
Přes počáteční účinnost léčby inhibitory CDK4/6 u pacientek po určité době dochází k rozvoji rezistence. Její mechanismy nejsou doposud zcela objasněny, jako možné bývají označovány ztráta funkce Rb (retinoblastomového) genu, zvýšená aktivita CDK6 a mutace dalších genů (ESR1, PIK3CA, TP53) [22]. Mutace genu Rb by mohla být, alespoň zčásti, zodpovědná za vznik sekundární rezistence. U 4,8 % pacientek léčených kombinací palbociklibu s fulvestrantem došlo ke vzniku de novo mutace genu Rb, zatímco u pacientek léčených pouze fulvestrantem nové mutace nalezeny nebyly [23]. Relativní rezistence k palbociklibu byla zaznamenána v případě vyšší exprese genu CCNE1 pro cyklin E1 v nádorové tkáni. Pacientky s vyšší expresí CCNE1 léčené kombinací fulvestrantu s palbociklibem dosahovaly v rámci klinické studie PALOMA 3 signifikantně kratšího PFS než pacientky s nižší expresí tohoto genu (7,6 měsíce vs. 14,1 měsíce; p = 0,00238) [24]. Podkladem je aktivace alternativní dráhy fosforylace Rb cestou komplexu cyklin E1/CDK2, která tak představuje potenciální terapeutický cíl [25].
Nadějná se zdá být kombinace s inhibitory kontrolních bodů imunitní odpovědi (tzv. checkpoint inhibitory). Bylo prokázáno, že inhibitory CDK4/6 indukují aktivaci T lymfocytů, zvyšují produkci cytokinů, zvyšují prezentaci nádorových antigenů a v preklinických modelech prokázaly synergii s inhibitory programované buněčné smrti (PD 1) [26,27]. V současnosti probíhající studie fáze II PACE randomizuje pacientky po progresi při terapii palbociklibem s hormonální léčbou do ramene s fulvestrantem, s kombinací fulvestrant/palbociklib a fulvestrant/palbociklib/avelumab (anti PD L1 protilátka) [28]. Dále je ověřována účinnost palbociklibu v léčbě HER2 pozitivních luminálních nádorů v rámci studie PATINA, která randomizuje pacientky do ramene s kombinací anti HER2 cílená léčba/hormonální léčba s palbociklibem nebo bez něj [29]. Kromě metastatického onemocnění je ověřována účinnost palbociklibu i v adjuvantní léčbě (studie PALLAS) [30].
Závěr
Uvedení inhibitorů CDK4/6 do klinické praxe je významným mezníkem v léčbě pokročilého hormonálně dependentního, HER2 negativního karcinomu prsu. Palbociklib je vůbec prvním zástupcem této nové skupiny léků. V rámci klinických studií dosahoval významného prodloužení PFS v první i v druhé linii léčby v kombinaci s letrozolem, respektive s fulvestrantem. Léčba bývá dobře tolerovaná, nejčastější toxicitu představuje neutropenie. Mechanismus jejího vzniku je však odlišný od klasické cytostatické terapie a toxicita bývá dobře zvládnutelná úpravou dávky či přerušením léčby. Prokázaná klinická účinnost (téměř dvojnásobné PFS oproti hormonální terapii samotné) a příznivý toxikologický profil vedly k rychlé registraci přípravku v USA i v Evropě. V České republice je palbociklib registrován, doposud však nemá stanovenu úhradu. Probíhají další klinické studie, jež budou muset přinést odpověď na otázky, které pacientky jsou k léčbě nejvhodnější, jaká je optimální sekvence léčby a jak postupovat v případě progrese onemocnění. Již nyní je však jisté, že inhibitory CDK4/6 představují významný krok kupředu v terapii tohoto doposud nevyléčitelného onemocnění.
Seznam použité literatury
- [1] Stanford JL, Szklo M, Brinton LA. Estrogen receptors and breast cancer. Epidemiol Rev 1986; 8: 42‒59.
- [2] Henriksen KL, Sonne‑Hansen K, Kirkegaard T, et al. Development of new predictive markers for endocrine therapy and resistance in breast cancer. Acta Oncol 2008; 47: 795‒801.
- [3] Barrios CH, Sampaio C, Vinholes J, et al. What is the role of chemotherapy in estrogen receptor‑positive, advanced breast cancer? Ann Oncol 2009; 20: 1157‒1162.
- [4] Fry DW, Harvey PJ, Keller PR, et al. Specific inhibition of cyclin‑dependent kinase 4/6 by PD 0332991 and associated antitumor activity in human tumor xenografts. Mol Cancer Ther 2004; 3: 1427‒1438.
- [5] Finn RS, Dering J, Conklin D, et al. PD 0332991, a selective cyclin D kinase 4/6 inhibitor, preferentially inhibits proliferation of luminal estrogen receptor‑positive human breast cancer cell lines in vitro. Breast Cancer Res 2009; 11: R77.
- [6] Koehler M, Van Arsdale TL, Shields D, et al. Mechanism of action for combined CDK4/6 and ER inhibition in ER positive breast cancer. Ann Oncol 2014; 25(Suppl 1): i21‒i21.
- [7] IBRANCE 75 mg hard capsules. Summary of Product Characteristics (SPC) ‒ (eMC), 2018. Dostupné na: https://www.medicines.org.uk/emc/product/4449/smpc
- [8] Finn RS, Crown JP, Lang I, et al. The cyclin‑dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first‑line treatment of oestrogen receptor‑positive, HER2‑negative, advanced breast cancer (PALOMA‑1/TRIO‑18): a randomised phase 2 study. Lancet Oncol 2015; 16: 25‒35.
- [9] Finn RS, Crown J, Lang I, et al. Overall survival results from the randomized phase II study of palbociclib (P) in combination with letrozole (L) vs letrozole alone for frontline treatment of ER+/HER2– advanced breast cancer (PALOMA‑1; TRIO‑18). J Clin Oncol 2017; 35(Suppl 15): 1001‒1001.
- [10] Finn RS, Martin M, Rugo HS, et al. Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med 2016; 375: 1925‒1936.
- [11] Rugo HS, Turner NC, Finn RS, et al. Abstract P4‑22‑03: Palbociclib in combination with endocrine therapy in treatment‑naive and previously treated elderly women with HR+, HER2– advanced breast cancer: a pooled analysis from randomized phase 2 and 3 studies. Cancer Res 2017; 77(Suppl 4): P4‑22‑03‑P24‑22‑03.
- [12] Finn R, Jiang Y, Rugo H, et al. Biomarker analyses from the phase 3 PALOMA‑2 trial of palbociclib (P) with letrozole (L) compared with placebo (PLB) plus L in postmenopausal women with ER+/HER2– advanced breast cancer (ABC). Ann Oncol 2016; 27(Suppl 6): LBA15‒LBA15.
- [13] Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone‑receptor‑positive, HER2‑negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA‑3): final analysis of the multicentre, double‑blind, phase 3 randomised controlled trial. Lancet Oncol 2016; 17: 425‒439.
- [14] Turner NC, Andre F, Cristofanilli M, et al. [P4‑22‑06] Treatment Postprogression in Women with Endocrine‑Resistant HR+ HER2– Advanced Breast Cancer Who Received Palbociclib Plus Fulvestrant in PALOMA‑3. In 39th Annual San Antonio Breast Cancer Symposium (SABCS). San Antonio, TX, USA: 2016.
- [15] Hu W, Sung T, Jessen BA, et al. Mechanistic Investigation of Bone Marrow Suppression Associated with Palbociclib and its Differentiation from Cytotoxic Chemotherapies. Clin Cancer Res 2016; 22: 2000‒2008.
- [16] Finn RS, Aleshin A, Slamon DJ. Targeting the cyclin‑dependent kinases (CDK) 4/6 in estrogen receptor‑positive breast cancers. Breast Cancer Res 2016; 18: 17.
- [17] Verma S, Bartlett CH, Schnell P, et al. Palbociclib in Combination with Fulvestrant in Women with Hormone Receptor‑Positive/HER2‑Negative Advanced Metastatic Breast Cancer: Detailed Safety Analysis from a Multicenter, Randomized, Placebo‑Controlled, Phase III Study (PALOMA‑3). Oncologist 2016; 21: 1165‒1175.
- [18] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Breast Cancer Version 1.2018. In 2018. Dostupné na: http://www.jnccn.org/content/8/2.toc.pdf
- [19] Wilson FR, Varu A, Mitra D, et al. Systematic review and network meta‑analysis comparing palbociclib with chemotherapy agents for the treatment of postmenopausal women with HR‑positive and HER2‑negative advanced/metastatic breast cancer. Breast Cancer Res Treat 2017; 166: 167‒177.
- [20] Cortes J, O’Shaughnessy J, Loesch D, et al. Eribulin monotherapy versus treatment of physician’s choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open‑label randomised study. Lancet 2011; 377: 914‒923.
- [21] Cardoso F, Bedard PL, Winer EP, et al. International guidelines for management of metastatic breast cancer: combination vs sequential single‑agent chemotherapy. J Natl Cancer Inst 2009; 101: 1174‒1181.
- [22] Garrido‑Castro AC, Goel S. CDK4/6 Inhibition in Breast Cancer: Mechanisms of Response and Treatment Failure. Curr Breast Cancer Rep 2017; 9: 26‒33.
- [23] Turner NC, O’Leary B, Cutts R, et al. Genetic landscape of resistance to CDK4/6 inhibition in circulating tumor DNA (ctDNA) analysis of the PALOMA3 trial of palbociclib and fulvestrant versus placebo and fulvestrant. J Clin Oncol 2018; 36(Suppl 15): 1001‒1001.
- [24] Turner NC, Liu Y, Zhu Z, et al. [Abstract CT039] Cyclin E1 (CCNE1) expression associates with benefit from palbociclib in metastatic breast cancer (MBC) in the PALOMA3 trial. In AACR. Chicago, IL: 2018.
- [25] Herrera‑Abreu MT, Palafox M, Asghar U, et al. Early Adaptation and Acquired Resistance to CDK4/6 Inhibition in Estrogen Receptor‑Positive Breast Cancer. Cancer Res 2016; 76: 2301‒2313.
- [26] Deng J, Wang ES, Jenkins RW, et al. CDK4/6 Inhibition Augments Anti‑Tumor Immunity by Enhancing T Cell Activation. Cancer Discovery 2017 Jan 19; doi:10.1158/2159‑8290.CD‑17‑0915
- [27] Goel S, DeCristo MJ, Watt AC, et al. CDK4/6 inhibition triggers anti‑tumour immunity. Nature 2017; 548: 471‒475.
- [28] Mayer EL, Wander SA, Regan MM, et al. Palbociclib after CDK and endocrine therapy (PACE): A randomized phase II study of fulvestrant, palbociclib, and avelumab for endocrine pre‑treated ER+/HER2‑ metastatic breast cancer. Journal of Clinical Oncology 2018; 36(Suppl 15): TPS1104‒TPS1104.
- [29] Metzger‑Filho O, Mandrekar S, Loibl S, et al. Abstract OT3‑05‑07: PATINA: A randomized open label phase III trial to evaluate the efficacy and safety of palbociclib + anti HER2 therapy + endocrine therapy vs anti HER2 therapy + endocrine therapy after induction treatment for hormone receptor positive, HER2 positive metastatic breast cancer. Cancer Res 2018; 78(Suppl 4): OT3‑05‑07‑OT03‑05‑07.
- [30] Mayer EL, Demichele AM, Pfeiler G, et al. PALLAS: PALbociclib CoLlaborative Adjuvant Study: A randomized phase 3 trial of palbociclib with standard adjuvant endocrine therapy versus standard adjuvant endocrine therapy alone for HR+/HER2‑ early breast cancer. Ann Oncol 2017; 28(Suppl 5): mdx362.064‒mdx362.064.