Porovnání účinku sekukinumabu a biosimilárního adalimumabu na radiografickou progresi u ankylozující spondylitidy: uspořádání studie SURPASS
Souhrn:
Forejtová Š. Porovnání účinku sekukinumabu a biosimilárního adalimumabu na radiografickou progresi u ankylozující spondylitidy: uspořádání studie SURPASS. Remedia 2021; 31: 86–90.
Zastavení nebo zpomalení rentgenové progrese u pacientů s ankylozující spondylitidou (AS) patří k jednomu z důležitých cílů léčby. Bylo prokázáno, že sekukinumab zpomaluje u pacientů s AS rentgenovou progresi během čtyř let podávání. Také u adalimumabu bylo zjištěno, že při dlouhodobém podávání dochází ke zpomalení vývoje radiografických změn. Biosimilární adalimumab GP2017 (SDZ‑ADL) byl Evropskou lékovou agenturou schválen v červnu 2018 pro léčbu stejných indikací, pro které je schválen originální adalimumab, včetně AS. Dosud nebylo provedeno přímé srovnání působení přípravků s inhibitory IL‑17 a anti‑TNFα na rozvoj radiografických změn. SURPASS je první prospektivní studií, která byla přímo koncipována tak, aby srovnávala jejich působení na spinální radiografickou progresi.
Summary:
Forejtova S. Comparing secukinumab and adalimumab biosimilar efficacy on radiographic progression of ankylosing spondylitis: SURPASS study organization. Remedia 2021; 31: 86–90.
Cessation or slowing of radiographic progression in patients with ankylosing spondylitis (AS) is one of the important goals of the treatment. Secukinumab was proven to slow down radiographic progression in patients with AS during a 4‑year period of administration. Adalimumab was proven to slow down the progression of radiographic changes after long‑term administration as well. Adalimumab biosimilar GP2017 (SDZ‑ADL) was approved by the European Medicine Agency in June 2018 for the treatment of the same indications for which the original adalimumab was approved, including AS. So far, no direct efficacy comparison of products with IL‑17 inhibitors and anti‑TNFα on radiographic changes has been performed. SURPASS is the first prospective study designed to compare their effects on spinal radiographic progression.
Key words: ankylosing spondylitis, radiographic progression, secukinumab,SDZ‑ADL, mSASSS
Úvod
Ankylozující spondylitida (AS) je chronické zánětlivé onemocnění, které vede k progresivnímu ireverzibilnímu postižení páteře. V důsledku probíhajícího zánětu dochází ke kostní novotvorbě, především v podobě rozvoje syndesmofytů, a k následné ankylóze axiálního skeletu. Mezi hlavní cíle léčby patří odstranění subjektivních potíží nemocného a potlačení extraartikulárních manifestací onemocnění (uveitidy, nespecifické kolitidy atd.). Důležitým úkolem je i udržení pohyblivosti páteře, případně přispění ke zlepšení její flexibility. Moderní léčba by samozřejmě měla zastavit, nebo alespoň výrazně zpomalit rentgenovou progresi onemocnění [1].
Radiografickou progresi hodnotíme pomocí různých skórovacích metod, které klasifikují změny viditelné na konvenčním rentgenovém snímku. Byla vyvinuta a validizována celá řada těchto skórovacích systémů, přičemž skupina ASAS (The Assessment of the SpondyloArthritis International Society) a skupina OMERACT (Outcome Measures in Rheumatology Clinical Trial) doporučují především užívání mSASSS (modified Stoke Ankylosing Spondylitis Spine Score) jako nejvhodnější skórovací metodu k hodnocení radiografické progrese u AS [2,3]. Magnetickou rezonanci (MRI) užíváme především k potvrzení zánětlivých změn v oblasti páteře a sakroiliakálních (SI) kloubů, a to ještě předtím, než se objeví strukturální změny na konvenčním rentgenu. MRI obraz páteře může také predikovat budoucí vývoj nových radiografických změn na páteři, kdy zánětlivé změny v rozích obratlů a tuková degenerace předpovídají vývoj syndesmofytů [4].
Při léčbě axiální spondyloartritidy užíváme v první linii terapie axiální symptomatologie nesteroidní antirevmatika (NSA), při jejich selhání volíme biologickou léčbu. Dosud jsou pro léčbu AS užívány přípravky proti tumor nekrotizujícímu faktoru alfa (anti TNFα), z inhibitorů interleukinu 17 (IL 17) je zatím jediným schváleným lékem sekukinumab.
Možnost působení na zpomalení rentgenové progrese u AS byla studována jak u NSA, tak u různých biologik. Starší studie s celekoxibem prokázala zpomalení rentgenové progrese při jeho podávání po dobu dvou let [5]. Novější studie s diklofenakem však neprokázala redukci strukturálního postižení na rentgenu po jeho kontinuálním dvouletém podávání [6].
Dlouhodobé observační studie předpokládají, že anti TNFα terapie má vliv na rozvoj strukturální progrese u pacientů s AS, i když průkaz nebyl tak rychlý, jako tomu bylo u revmatoidní artritidy. Zatímco byla brzy prokázána asociace mezi aktivitou onemocnění a budoucím vývojem radiografické progrese onemocnění [7,8], dlouho se nepodařilo prokázat vliv anti TNFα terapie na zpomalení rentgenových změn. Tři otevřené klinické extenzní studie, které následovaly po randomizovaných kontrolovaných studiích s inhibitory TNFα, neprokázaly zpomalení rentgenové progrese po dvou letech podávání biologické léčby v porovnání s pacienty, kteří byli léčeni NSA [9‒11]. V jedné observační studii byla léčba spojena s 50% snížením pravděpodobnosti progrese, přičemž u pacientů, u nichž byla zahájena anti TNFα terapie se zpožděním více než 10 let, byla rentgenová progrese zpomalena méně v porovnání s těmi, kde byla léčba zahájena dříve. Současně bylo zjištěno, že minimální doba sledování, po které bylo prokázáno zpomalení radiografické progrese po podání léčby anti TNFa, je 3,9 roku [12]. Také ve švýcarské studii, která sledovala radiografickou progresi po dobu 10 let, přičemž progrese byla hodnocena ve dvouletých intervalech, byla zjištěna 50% redukce u pacientů léčených inhibitory TNFα [13]. V dalších studiích byl prokázán vliv na zpomalení radiografické progrese u pacientů, kteří byli léčeni anti TNFα terapií alespoň po dobu dvou let [14,15].
Biosimilární adalimumab GP2017 (SDZ ADL) byl vyvinut společností Sandoz a jeho používání bylo schváleno Evropskou lékovou agenturou (EMA) v červu 2018 pro stejné indikace, pro které je používán originální adalimumab, a to včetně léčby AS.
Imunitní odpověď cestou cytokinů IL 23/IL 17A hraje důležitou roli v patogenezi AS. Sekukinumab, plně humánní protilátka proti IL 17A, byl regulačními orgány schválen pro léčbu AS, neradiografické axiální spondyloartritidy, psoriázy a psoriatické artritidy. Zmírnění příznaků AS při léčbě sekukinumabem bylo prokázáno ve třech klinických studiích fáze III (MEASURE 1‒3) [16‒18]. Ve studii MEASURE 1 bylo zjištěno, že u pacientů, kteří byli léčeni sekukinumabem po dobu 104 týdnů v kterékoliv dávce, byla průměrná změna mSASSS 0,3, u více než 80 % léčených nebyla prokázána progrese (změna mSASSS < 2) [19]. Také po čtyřech letech podávání sekukinumabu nemělo radiografickou progresi (změna mSASSS od počáteční hodnoty < 2) 79 % pacientů dostávajících sekukinumab v kterékoliv dávce. Celkem 95,3 % pacientů, kteří neměli před zahájením léčby žádný syndesmofyt, nevyvinulo během dvou let sledování žádný syndesmofyt [20]. V pilotní studii s MRI u pacientů léčených sekukinumabem bylo prokázáno, že 70 % tukových lézí, které byly zachyceny v rozích obratlů při zahájení terapie, zůstalo neměnných, 30 % tukových lézí vymizelo a nové se objevily pouze u 4,9 % vertebrálních rohů [21]. Z toho lze usuzovat, že inhibice IL 17 může mít potenciálně vliv na zmírnění strukturální progrese již po dvou letech podávání.
Dosud však neexistovala prospektivní, kontrolovaná „head to head“ studie, která by porovnávala efekt biologik na vývoj hodnoty mSASSS u pacientů s aktivní AS. Vznikla potřeba provést srovnávací studie, které by porovnávaly vliv přípravků s různým mechanismem účinku na zpomalení nebo zastavení rentgenové progrese. SURPASS je první studií, která porovnává anti IL 17A léčbu s anti TNFα přípravkem, a to s ohledem na jejich vliv na strukturální progresi u AS. Studie porovnává účinnost a bezpečnost sekukinumabu (v dávce 150 mg nebo 300 mg měsíčně) oproti biosimilárnímu přípravku SDZ ADL (v dávce 40 mg každých 14 dnů), přičemž je porovnáván vývoj mSASSS během dvouletého podávání.
Uspořádání studie
SURPASS (NCT03259074) je probíhající randomizovaná, částečně zaslepená klinická studie fáze IIIb, která je realizována ve světě celkem ve 171 centrech. U pacientů byl proveden při screeningové návštěvě rentgen SI kloubů, přičemž snímky byly hodnoceny centrálním hodnotitelem. Podmínkou zařazení do studie bylo splnění modifikovaných newyorských kritérií. Do studie bylo zařazeno 858 pacientů, kteří dosud nebyli léčeni biologickou léčbou a byli randomizováni v poměru 1 : 1 : 1 do tří větví. Ve dvou větvích dostávali pacienti sekukinumab, a to v dávce 150 mg nebo 300 mg měsíčně. První aplikace sekukinumabu podkožně probíhala při randomizaci do studie (týden 0), následně pacienti dostávali stejnou dávku v týdnu 1, 2, 3, 4, a dále pak ve čtyřtýdenních intervalech až do týdne 100. Pacienti léčení ve větvi SDZ ADL dostávají od randomizace 40 mg adalimumabu každých 14 dnů, a to až do týdne 102. Všichni pacienti, kteří byli zařazeni do studie, vstupují po ukončení léčby do následné periody sledování, a to bez ohledu na to, zde ukončili studii v plánovaném termínu, nebo předčasně. U všech pacientů bude provedena tzv. follow up návštěva v týdnu 112 a 120, počítáno od data randomizace.
Sekukinumab podkožně je podáván v předplněných stříkačkách, a to v dávce 300 mg (aplikace dvou subkutánních injekcí po 150 mg) nebo 150 mg (jedna s.c. injekce sekukinumabu 150 mg + jedna injekce placeba), přičemž dávka sekukinumabu je podávána ve dvojitě zaslepeném režimu. SDZ ADL je podáván bez zaslepení, v rámci otevřeného režimu. Pacient může používat konkomitantní léčbu ve stabilních dávkách, jak ji dostával před randomizací, tj. sulfasalazin v dávce ≤ 3 g/den a metotrexát v dávce ≤ 25 mg/týden nejméně čtyři týdny před randomizací a prednison v dávce ≤ 10 mg denně či ekvivalentní dávka po dobu nejméně 14 dnů před randomizací.
Vstupní a vylučovací kritéria
studie
Do studie mohli být zařazeni
pacienti ve věku 18 let a starší se středně až vysoce
aktivní AS, kteří splnili modifikovaná newyorská kritéria pro
AS, přičemž hodnocený snímek SI kloubů nesměl být starší
než tři měsíce před podepsáním informovaného souhlasu. Mezi
dalšími vstupními kritérii byla hodnota BASDAI (Bath Ankylosing
Spondylitis Disease Activity Index) ≥ 4 (rozpětí 0‒10)
a zároveň hodnota bolesti páteře v rámci BASDAI
(položka 2) musela být ≥ 4 (rozpětí 0‒10). Kromě
toho hodnota celkové bolesti zad musela dosáhnout ≥ 40 mm
na 100mm vizuální analogové škále, přičemž pacienti jsou
při vstupu léčeni maximální tolerovanou dávkou NSA. Kromě toho
nemocní musejí mít vstupní hodnotu C reaktivního proteinu
(CRP) ≥ 5 mg/l nebo na rentgenu páteře musí
být přítomen alespoň jeden syndesmofyt, kdy snímky jsou
hodnoceny centrálním hodnotitelem.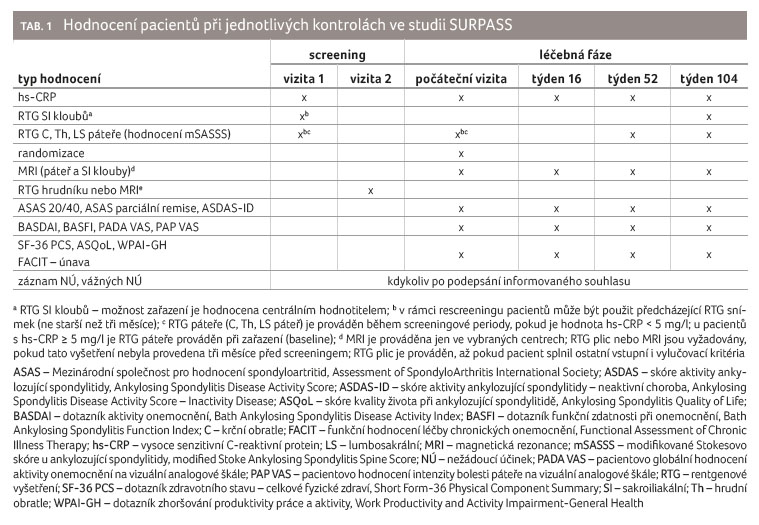
Mezi hlavní vylučovací kritéria patřila totální ankylóza páteře, kterákoliv předchozí biologická léčba inhibující IL 17 nebo TNFα, dále přítomnost aktivní systémové infekce během 14 dnů před randomizací, přítomnost malignity i v anamnéze, předchozí terapie ovlivňující cílenou buněčnou depleci nebo terapie silnými opioidy.
Hodnocení
Detailní hodnocení, které probíhá v jednotlivých vizitách, je popsáno v tabulce 1. Veškeré posuzování aktivity a účinnosti léčby bylo standardně prováděno při zahájení léčby (počáteční vizita), následně pak v týdnu 16, 52, a 104.
Rentgenové hodnocení
Rentgen páteře byl proveden při zahájení léčby (screening nebo počáteční vizita), dále v týdnu 52 a 104. Rentgen SI kloubů je prováděn při zařazení a v týdnu 104. Rentgenové zobrazení zahrnuje laterální snímky všech 24 obratlů a předozadní snímky pánve, kde jsou zobrazeny oba SI klouby. Hodnocení je prováděno centrálním hodnotitelem. Změny na SI kloubech při screeningu musely odpovídat modifikovaným newyorským kritériím pro AS. Syndesmofyty na páteři definované podle mSASSS odpovídají hodnotě 2 nebo 3 na každém rohu obratle (hodnota 2 zaznamenává prostý syndesmofyt a hodnota 3 odpovídá přemosťujícímu syndesmofytu). Nezávislý hodnotitel provádí hodnocení snímků bez znalosti chronologie RTG snímků a druhu léčby pacienta. Nový syndesmofyt je definován jako změna skóre daného rohu z hodnoty 0 nebo 1 na hodnotu 2 nebo 3. Změny stupně sakroiliitidy na rentgenu jsou hodnoceny dle modifikovaných newyorských kritérií. Do statistické analýzy radiografické progrese je zahrnuto i tzv. RASSS (Radiographic Ankylosing Spondylitis Spinal Score), které slouží jako druhé skóre pro hodnocení rentgenových snímků.
Magnetická rezonance
Vyšetření pomocí MRI je prováděno pouze ve vybraných centrech, celkem přibližně u 45‒50 % všech randomizovaných pacientů. MRI je realizována při vstupní vizitě (týden 0), a dále v týdnu 16, 52 a 104. Nezávislým hodnotitelem je prováděno odečítání tzv. berlínského skóre, které hodnotí otok SI kloubů, a dále probíhá hodnocení pomocí berlínské modifikace ASspiMRI a (Ankylosing Spondylitis Spine Magnetic Resonance Imaging Activity) skóre.
Cíle studie
Primárním cílem studie je zjištění podílu pacientů, u nichž nedošlo k radiografické progresi, jak je hodnocena pomocí mSASSS (≤ 0,5) v týdnu 104. Míra radiografické progrese bude porovnávána u pacientů, kteří dostávají sekukinumab v dávce 300 mg nebo 150 mg měsíčně nebo SDZ ADL v dávce 40 mg každých 14 dnů.
Mezi sekundární cíle studie patří porovnání změny mSASSS během celé doby studie a dále srovnávání pacientů, kteří měli jeden nebo více syndesmofytů před zahájením léčby a nevyvinuli během studie žádný nový syndesmofyt. Dalším sekundárním cílem je porovnání vývoje berlínského skóre, které hodnotí otok SI kloubů, a dále srovnání hodnot berlínské modifikace ASspiMRI a od počáteční hodnoty do týdne 104. Mezi další cíle studie patří porovnání podílu pacientů, kteří dosáhli odpovědi ASAS 20/40 (20%/40% zlepšení dle Assessment of SpondyloArthritis International Society), dále ASAS parciální remise a ASDAS ID (Ankylosing Spondylitis Disease Activity Score Inactivity Disease) v týdnu 104. Tyto sekundární cíle byly hodnoceny opět u tří větví pacientů, kteří byli léčeni dvěma různými dávkami sekukinumabu nebo adalimumabem.
U pacientů je dále sledována až do týdne 104 bezpečnost léčby, tedy jsou zaznamenávány a porovnávány nežádoucí účinky a vážné nežádoucí účinky. Současně jsou během studie měřeny vitální funkce, prováděno fyzikální vyšetření, laboratorní hodnocení a hodnocení tolerability i imunogenicity podávané léčby (vývoj protilátek proti sekukinumabu).
Diskuse
Účinek podávané biologické léčby na radiografickou progresi je jedním z důležitých cílů při léčbě AS. Dosavadní studie, které hodnotily působení léčby na radiografickou progresi u pacientů s AS, byly prováděny obvykle retrospektivně a byl v nich srovnáván vývoj rentgenové progrese u pacientů léčených daným přípravkem s historickými kohortami, u nichž bylo hodnocení mSASSS odečítáno v minulosti u jedinců bez léčby. Některé studie byly prováděny naopak prospektivně, ale bez kontrolní kohorty.
Radiografická progrese u pacientů s AS je velmi pomalý proces, kdy radiografické změny se vyvíjejí během několika let. Aby hodnocení radiografické progrese bylo dostatečně senzitivní a přitom spolehlivé, bylo v minulosti zjištěno, že minimální interval mezi dvěma měřeními musí být alespoň dva roky [3,22], i když v jedné studii byl použit i interval jeden rok [23]. Studie SURPASS je plánována na dva roky tak, aby hodnotila potenciální vliv obou podávaných biologik na radiografickou progresi [24].
Studie SURPASS využívá kromě mSASSS také hodnocení pomocí RASSS, které umožňuje posuzovat i některé lokality na páteři, jež nejsou zahrnuty v mSASSS. Stejně tak jsou ve studii hodnoceny SI klouby za použití modifikovaných newyorských klasifikačních kritérií. RASSS je alternativní skórovací systém, který zahrnuje segmenty páteře obdobně jako mSASSS, kromě toho hodnotí i obratle Th10‒Th12, přičemž skórování je založeno především na hodnocení nových kostních formací [25].
Dosud bylo prokázáno, že mezi rizikové faktory pro rychlejší vývoj radiografické progrese patří mužské pohlaví, kouření, dále vyšší aktivita AS (měřeno pomocí ASDAS nebo CRP) [7,26,27]. Jako další rizikový faktor byl zjištěn výskyt edému kostní dřeně v rozích obratlů v obrazu MRI [28,29]. Nejvýznamnějším rizikovým faktorem pro rozvoj radiografické progrese na páteři je ovšem přítomnost radiografických změn při zahájení léčby, a to měřeno pomocí mSASSS nebo podle počtu syndesmofytů [30], kdy přítomnost radiografického poškození při zahájení léčby zvyšuje riziko radiografické progrese až čtyřikrát [7,31]. Do studie SURPASS byli zařazeni pacienti, kteří měli na počátku léčby přítomen jeden nebo více syndesmofytů nebo měli vyšší hodnotu CRP, tedy se jednalo o nemocné rizikové z hlediska vývoje radiografické progrese.
Závěr
SURPASS je první velká randomizovaná klinická studie, která porovnává vliv dvou biologických léků na rozvoj radiografické progrese u pacientů s AS během periody dvouletého sledování. Očekává se, zda porovnání léků působících mechanismem anti IL 17A oproti lékům s anti TNFα účinkem přinese nové poznatky založené na důkazech o jejich vlivu na radiografickou progresi. To by mohlo eventuálně v budoucnu ovlivnit i doporučení při rozhodování o zahájení biologické léčby u pacientů s aktivní AS.
Seznam použité literatury
- [1] van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS‑EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76: 978‒991.
- [2] Wanders AJ, Landewé RB, Spoorenberg A, et al. What is the most appropriate radiologic scoring method for ankylosing spondylitis? A comparison of the available methods based on the Outcome Measures in Rheumatology Clinical Trials filter. Arthritis Rheum 2004; 50: 2622‒2632.
- [3] van der Heijde D, Landewé R. Selection of a method for scoring radiographs for ankylosing spondylitis clinical trials, by the Assessment in Ankylosing Spondylitis Working Group and OMERACT. J Rheumatol 2005; 32: 2048‒2049.
- [4] Baraliakos X, Braun J. Imaging Scoring Methods in Axial Spondyloarthritis. Rheum Dis Clin North Am 2016; 42: 663‒678.
- [5] Wanders A, van der Heijde D, Landewé R, et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum 2005; 52: 1756‒1765.
- [6] Sieper J, Listing J, Poddubnyy D, et al. Effect of continuous versus on‑demand treatment of ankylosing spondylitis with diclofenac over 2 years on radiographic progression of the spine: results from a randomised multicentre trial (ENRADAS). Ann Rheum Dis 2016; 75: 1438‒1443.
- [7] Ramiro S, van der Heijde D, van Tubergen A, et al. Higher disease activity leads to more structural damage in the spine in ankylosing spondylitis: 12‑year longitudinal data from the OASIS cohort. Ann Rheum Dis 2014; 73: 1455‒1461.
- [8] Poddubnyy D, Protopopov M, Haibel H, et al. High disease activity according to the Ankylosing Spondylitis Disease Activity Score is associated with accelerated radiographic spinal progression in patients with early axial spondyloarthritis: results from the GErman SPondyloarthritis Inception Cohort. Ann Rheum Dis 2016; 75: 2114‒2118.
- [9] van der Heijde D, Landewé R, Baraliakos X, et al; Ankylosing Spondylitis Study for the Evaluation of Recombinant Infliximab Therapy Study Group. Radiographic findings following two years of infliximab therapy in patients with ankylosing spondylitis. Arthritis Rheum 2008; 58: 3063‒3070.
- [10] van der Heijde D, Salonen D, Weissman BN, et al; Canadian (M03‑606) study group and ATLAS study group. Assessment of radiographic progression in the spines of patients with ankylosing spondylitis treated with adalimumab for up to 2 years. Arthritis Res Ther 2009; 11: R127.
- [11] van der Heijde D, Landewé R, Einstein S, et al. Radiographic progression of ankylosing spondylitis after up to two years of treatment with etanercept. Arthritis Rheum 2008; 58: 1324‒1331.
- [12] Haroon N, Inman RD, Learch TJ, et al. The impact of tumor necrosis factor α inhibitors on radiographic progression in ankylosing spondylitis. Arthritis Rheum 2013; 65: 2645‒2654.
- [13] Molnar C, Scherer A, Baraliakos X, et al., on a behalf of Rheumatologists of the Swiss Clinical Quality Management Program. TNF blockers inhibit spinal radiographic progression in ankylosing spondylitis by reducing disease activity: results from the Swiss Clinical Quality Management cohort. Ann Rheum Dis 2018; 77: 63‒69.
- [14] Maas F, Arends S, Wink FR, et al. Ankylosing spondylitis patients at risk of poor radiographic outcome show diminishing spinal radiographic progression during long‑term treatment with TNF‑α inhibitors. PLoS One 2017; 12: e0177231.
- [15] Maas F, Arends S, Brouwer E, et al. Reduction in Spinal Radiographic Progression in Ankylosing Spondylitis Patients Receiving Prolonged Treatment With Tumor Necrosis Factor Inhibitors. Arthritis Care Res (Hoboken) 2017; 69: 1011‒1019.
- [16] Baeten D, Sieper J, Braun J, et al. Secukinumab, an Interleukin‑17A Inhibitor, in Ankylosing Spondylitis. N Engl J Med 2015; 373: 2534‒2548.
- [17] Pavelka K, Kivitz A, Dokoupilova E, et al. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double‑blind phase 3 study, MEASURE 3. Arthritis Res Ther 2017; 19: 285.
- [18] Braun J, Baraliakos X, Deodhar A, et al. MEASURE 1 study group. Effect of secukinumab on clinical and radiographic outcomes in ankylosing spondylitis: 2‑year results from the randomised phase III MEASURE 1 study. Ann Rheum Dis 2017; 76: 1070‒1077.
- [19] Braun J, Haibel H, de Hooge M, et al. Spinal radiographic progression over 2 years in ankylosing spondylitis patients treated with secukinumab: a historical cohort comparison. Arthritis Res Ther 2019; 21: 142.
- [20] Braun J, Baraliakos X, Deodhar A, et al. Secukinumab shows sustained efficacy and low structural progression in ankylosing spondylitis: 4‑year results from the MEASURE 1 study. Rheumatology (Oxford) 2019; 58: 859‒868.
- [21] Baraliakos X, Borah B, Braun J, et al. Long‑term effects of secukinumab on MRI findings in relation to clinical efficacy in subjects with active ankylosing spondylitis: an observational study. Ann Rheum Dis 2016; 75: 408‒412.
- [22] Spoorenberg A, de Vlam K, van der Linden S, et al. Radiological scoring methods in ankylosing spondylitis. Reliability and change over 1 and 2 years. J Rheumatol 2004; 31: 125‒132.
- [23] Creemers MC, Franssen MJ, van′t Hof MA, et al. Assessment of outcome in ankylosing spondylitis: an extended radiographic scoring system. Ann Rheum Dis 2005; 64: 127‒129.
- [24] Baraliakos X, Østergaard M, Gensler et al.; SURPASS Study Group. Comparison of the Effects of Secukinumab and Adalimumab Biosimilar on Radiographic Progression in Patients with Ankylosing Spondylitis: Design of a Randomized, Phase IIIb Study (SURPASS). Clin Drug Investig 2020; 40: 269‒278.
- [25] Baraliakos X, Listing J, Rudwaleit M, et al. Development of a radiographic scoring tool for ankylosing spondylitis only based on bone formation: addition of the thoracic spine improves sensitivity to change. Arthritis Rheum 2009; 61: 764‒771.
- [26] Poddubnyy D, Haibel H, Listing J, et al. Baseline radiographic damage, elevated acute‑phase reactant levels, and cigarette smoking status predict spinal radiographic progression in early axial spondylarthritis. Arthritis Rheum 2012; 64: 1388‒1398.
- [27] Kroon F, Landewé R, Dougados M, van der Heijde D. Continuous NSAID use reverts the effects of inflammation on radiographic progression in patients with ankylosing spondylitis. Ann Rheum Dis 2012; 7: 1623‒1629.
- [28] Maksymowych WP, Chiowchanwisawakit P, Clare T, et al. Inflammatory lesions of the spine on magnetic resonance imaging predict the development of new syndesmophytes in ankylosing spondylitis: evidence of a relationship between inflammation and new bone formation. Arthritis Rheum 2009; 60: 93‒102.
- [29] Baraliakos X, Listing J, Rudwaleit M, et al. The relationship between inflammation and new bone formation in patients with ankylosing spondylitis. Arthritis Res Ther 2008; 10: R104.
- [30] van der Heijde D, Braun J, Deodhar A, et al. Modified stoke ankylosing spondylitis spinal score as an outcome measure to assess the impact of treatment on structural progression in ankylosing spondylitis. Rheumatology (Oxford) 2019; 58: 388‒400.
- [31] Maas F, Spoorenberg A, Brouwer E, et al. Spinal radiographic progression in patients with ankylosing spondylitis treated with TNF‑α blocking therapy: a prospective longitudinal observational cohort study. PLoS One 2015; 10: e0122693.