Případ typického pacienta s těžkou psoriázou
Souhrn:
Psoriáza je chronické zánětlivé onemocnění kůže, které se často sdružuje s dalšími zánětlivými nemocemi. Celková léčba se podává u těžších forem, kdy lokální léčba nedostačuje. Biologickou léčbu zahajujeme v případě závažné psoriázy, je li systémová léčba neúčinná, netolerovaná či kontraindikovaná. V kasuistice je popsán případ pacienta, který během krátké doby vyčerpal možnosti standardní systémové léčby a u něhož se objevila řada typických komorbidit.
Key words:
psoriasis – systemic treatment – comorbidities.
Summary:
Psoriasis is a chronic inflammatory skin disorder, often associated with other inflammatory conditions. Systemic treatment is required in moderate to severe plaque psoriasis, where topical treatment proves inefficient. Biologic agents are introduced in patients, who are intolerant of or unresponsive to conventional systemic treatment modalities. The authors describe a case of a young patient, who in a short time period ran out of available non biologic treatment options and developed several typical comorbidities.
Úvod
Psoriáza (lupénka) je chronické zánětlivé imunitně zprostředkované systémové onemocnění, které postihuje kolem 2–3 % populace evropských zemí. Až 80 % nemocných má pouze mírné až středně těžké postižení. Celková léčba se zahajuje u středně těžké a těžké lupénky, kdy lokální léčba nedostačuje [1,2]. V České republice jsou pro celkovou léčbu lupénky k dispozici tři přípravky – methotrexat, acitretin a ciclosporin.
Biologická léčba je dle českých doporučených postupů indikována u pacientů se závažnou formou psoriázy, u kterých je konvenční systémová terapie nebo fototerapie neúčinná, netolerovaná či kontraindikovaná [3]. Pro objektivizaci a stanovení závažnosti psoriázy se užívá měření PASI (Psoriasis Area Severity Index). Jeho hodnota se vypočte na základě stanovení rozsahu postižení jednotlivých částí těla vyjádřeného v procentech, stupně erytému, olupování a infiltrace jednotlivých ložisek; PASI nabývá hodnot 0–72, hodnota PASI větší než 10 představuje středně závažnou a závažnou formu psoriázy.
Kasuistika
Pacientem je 25letý muž ze smíšeného česko‑vietnamského manželství, který trpí psoriázou od 16 let. V minulosti se již léčil fototerapií, avšak pouze s dočasným efektem. V roce 2010 mu byla podávána systémová léčba methotrexatem, tu ale po měsíci užívání sám přerušil, protože se kožní nález zlepšil. Bolesti kloubů neudával, kouřil 10 cigaret denně od svých 15 let, byl nezaměstnaný a dosud se nezaregistroval u praktického lékaře.
Při našem prvním vyšetření v březnu 2014 byl nemocný obézní (BMI 34, výška 163 cm, hmotnost 90 kg), trpěl generalizovanou psoriázou až charakteru erytrodermie. V rámci vyšetření před plánovaným zahájením celkové léčby byly vyloučeny chronické infekce; biochemický profil, krevní obraz i rtg plic byly fyziologické. Zahájili jsme léčbu methotrexatem, ale záhy jsme v laboratorním nálezu zaznamenali zvýšení aktivity alaninaminotransferázy (ALT) se vzestupnou tendencí: 1,34 μkat/l; 1,86 μkat/l; 2,41 μkat/l; 2,41 μkat/l (norma: 0–1 μkat/l), ostatní jaterní hodnoty byly v normě. Provedli jsme sonografické vyšetření břicha, které odhalilo jen difuzní steatózu jater. Hodnota ALT byla při dalších kontrolách stacionární, a tak jsme po domluvě s hepatologem methotrexat v léčbě ponechali.
Při dalších kontrolách se kožní nález lepšil, avšak aktivita ALT se zvýšila až na hodnotu 2,52 μkat/l, proto byla dávka methotrexatu v červnu 2014 snížena na 7,5 mg týdně. Tato nízká dávka ale vedla k výraznému zhoršení projevů psoriázy a nemocný byl opět hospitalizován.
Během hospitalizace byl pacient léčen fototerapií úzkospektrým zářením UVB, což vedlo k podstatnému zlepšení kožního nálezu a pacient byl propuštěn domů bez celkové léčby. S odstupem tří týdnů se psoriáza opět zhoršila. V laboratorním nálezu jsme zjistili elevaci hodnot v lipidogramu – cholesterol 6,47 mmol/l (norma 2,9–5 mmol/l), triglyceridy 2,33 mmol/l (norma 0,45–1,7 mmol/l), LDL cholesterol 4,62 mmol/l (norma 1,2–3 mmol/l), HDL cholesterol 0,88 mmol/l (norma 1–2,1 mmol/l), aterogenní index 7,0 (norma 0–3); byla rovněž zjištěna hyperurikemie s hodnotou kyseliny močové 860 μmol/l (norma 210–450 μmol/l).
Po domluvě s revmatologem byla zahájena léčba allopurinolem v dávce 100 mg denně, ciclosporinem v dávce 300 mg denně a doporučena nízkotučná strava. Dávku ciclosporinu jsme po měsíci pro nedostatečný klinický účinek zvýšili na 400 mg/den. Při kontrolách během následujícího měsíce jsme opakovaně naměřili vyšší krevní tlak (až 145/108 mm Hg). Nemocný byl vyšetřen internistou včetně 24hodinové monitorace EKG dle Holtera a se závěrem prehypertenze byl zatím ponechán bez antihypertenzní léčby.
Za další dva měsíce se pacient dostavil opožděně pro zhoršení kožního nálezu na kontrolu a ukázalo se, že přestal užívat allopurinol i ciclosporin, protože předepsaná balení spotřeboval. Při hospitalizaci byl depresivně laděný, apatický, psychologickou pomoc či vyšetření psychiatrem však odmítal. Opět jsme začali podávat ciclosporin v dávce 300 mg denně. Laboratorně se aktivita ALT již znormalizovala, nově jsme zjistili hypomagnezemii. Na interní ambulanci byla doporučena léčba dyslipidemie statiny a léčba hypertenze blokátory vápníkových kanálů. Po zlepšení kožního nálezu byla dávka ciclosporinu snížena na 250 mg/den.
V únoru 2015 se pacient konečně zaregistroval u praktického lékaře. Na ja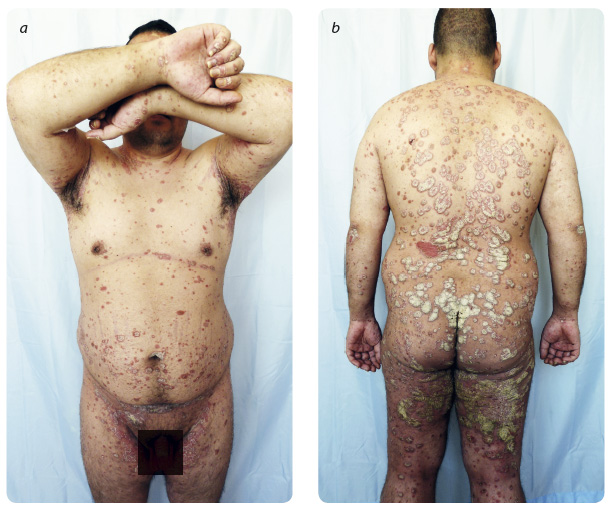 ře při zhojeném kožním nálezu byla snížena dávka ciclosporinu na 225 mg denně. V létě, po roce léčby ciclosporinem, došlo opět k progresi nemoci, u pacienta bylo zjištěno až 30% postižení kožního povrchu a PASI 33 (obr. 1a, b). Tím byla splněna indikační kritéria pro podání biologické léčby a v srpnu byla zahájena léčba adalimumabem ve standardním režimu dávkování, tj. 80 mg v úvodní dávce následováno dávkou 40 mg po týdnu a poté každý druhý týden. V průběhu měsíce došlo k rapidnímu zlepšení kožního nálezu i ke zlepšení psychického ladění. Pacient zatím pravidelně dochází na domluvené kontroly, užívá přidruženou interní medikaci a nově začal také chodit do zaměstnání.
ře při zhojeném kožním nálezu byla snížena dávka ciclosporinu na 225 mg denně. V létě, po roce léčby ciclosporinem, došlo opět k progresi nemoci, u pacienta bylo zjištěno až 30% postižení kožního povrchu a PASI 33 (obr. 1a, b). Tím byla splněna indikační kritéria pro podání biologické léčby a v srpnu byla zahájena léčba adalimumabem ve standardním režimu dávkování, tj. 80 mg v úvodní dávce následováno dávkou 40 mg po týdnu a poté každý druhý týden. V průběhu měsíce došlo k rapidnímu zlepšení kožního nálezu i ke zlepšení psychického ladění. Pacient zatím pravidelně dochází na domluvené kontroly, užívá přidruženou interní medikaci a nově začal také chodit do zaměstnání.
Diskuse
U pacientů se středně těžkou a těžkou lupénkou bývají často přítomny komorbidity, jako je psoriatická artritida, metabolický syndrom, hyperurikemie, střevní a oční záněty. Hrozí jim proto vyšší riziko kardio‑ a cerebrovaskulárních komplikací, které mohou být příčinou zkrácení délky jejich života v průměru až o 3–4 roky. Lupénka má také značný dopad na kvalitu života pacientů, kteří trpí častěji depresemi, poruchami spánku a úzkostí a mají vyšší spotřebu cigaret i alkoholu [3–7].
Kritériem pro podání biologické léčby v ČR byla přítomnost středně těžké až těžké ložiskové psoriázy, která postihuje více než 10 % tělesného povrchu nebo jejíž hodnota PASI je vyšší než 10; zároveň muselo být splněno alespoň jedno z následujících kritérií:
a) nelze použít jinou celkovou léčbu (acitretin, methotrexat, ciclosporin) nebo je podání takové léčby riskantní z důvodů vzniklých nežádoucích účinků či toxicity, intolerance či kontraindikace;
b) pacient nereaguje na standardní léčbu těžké psoriázy, tj. po třech měsících není terapie dostatečně účinná;
c) onemocnění nebylo v posledních třech letech nikdy zhojeno nebo relapsy nastávají do jednoho měsíce po skončení předcházející intenzivní léčby.
Náš pacient splnil po nezbytných vyšetřeních indikační kritéria k zahájení biologické léčby, která s vysokou pravděpodobností navodí a udrží dlouhodobou remisi a zlepší kvalitu života bez nežádoucích účinků.
Cílem popisu tohoto případu bylo připomenout obtížnou systémovou léčbu závažné psoriázy, kdy nemocní mohou mít už od mládí různé komorbidity, které se pak stávají kontraindikací klasické léčby. Navíc některé léčebné metody vedou k prohloubení rozvíjejících se přidružených nemocí. U našeho pacienta bylo podávání acitretinu kontraindikováno vzhledem k dyslipidemii a fototerapie či léčba ciclosporinem měly jen přechodný účinek. Léčba methotrexatem způsobila zhoršení jaterní steatózy a jaterních funkcí; podávání ciclosporinu vedlo ke zvýšení krevního tlaku, k hypomagnezemii, k progresi dyslipidemie a hyperurikemie. Často se navíc setkáváme se špatnou spoluprací pacienta, který nedochází na pravidelné kontroly, neužívá předepsanou medikaci a nedodržuje doporučení ohledně životosprávy.
Chápání lupénky jako systémového onemocnění s četnými přidruženými komorbiditami významným způsobem ovlivňuje léčebnou strategii, která kromě adekvátní terapie zahrnuje také cílený screening komorbidit a edukaci pacienta ve smyslu snížení hmotnosti a odvykání kouření. Naše kasuistika dokumentuje důležitost spolupráce dermatologa především s praktickými lékaři, internisty, revmatology a s psychology při řešení podobných medicínských případů.
Seznam použité literatury
- [1] Nestle FO, Kaplan DH, Barker J. Psoriais. N Engl J Med 2009; 361: 496–509.
- [2] Reich K. The concept of psoriasis as a systemic inflammation: implications for disease management. J Eur Acad Dermatol Venereol 2012; 26 (Suppl. 2): 3–11.
- [3] Cetkovská P, Kojanová M. Česká doporučení k biologické léčbě závažné chronické ložiskové psoriázy. Čes slov Derm 2012; 1: 1–22.
- [4] Daudén E, Castañeda S, Suárez C, et al. Integrated approach to comorbidity in patients with psoriasis. Working Group on Psoriasis associated Comorbidities. Actas Dermosifiliogr 2012; 103 (Suppl. 1): 1–64.
- [5] Gerdes S, Mrowietz U. Comorbidities and psoriasis. Impact on clinical practice. Hautarzt 2012; 63: 202–213.
- [6] Mrowietz U, Kragballe K, Reich K, et al. Definition of treatment goals for moderate to severe psoriasis: a European consensus. Arch Dermatol Res 2011; 303: 1–10.
- [7] Mrowietz U, Steinz K, Gerdes S. Psoriasis: to treat or to manage? Exp Dermatol 2014; 23: 705–709.