Quo vadis, hematologie?
Pod záštitou České hematologické společnosti ČLS JEP se v Olomouci ve dnech 26.–28. května 2022 uskutečnily XXXIV. olomoucké hematologické dny. Součástí programu byla již tradičně satelitní sympozia zaměřená na aktuální problematiku léčby z pohledu farmaceutických společností. Satelitnímu sympoziu, které uspořádala společnost Novartis a jehož obsah vám ve stručnosti přinášíme, předsedali prof. MUDr. Tomáš Papajík, CSc., a doc. MUDr. Daniela Žáčková, Ph.D.
Pod záštitou České hematologické společnosti ČLS JEP se v Olomouci ve dnech 26.–28. května 2022 uskutečnily XXXIV. olomoucké hematologické dny. Součástí programu byla již tradičně satelitní sympozia zaměřená na aktuální problematiku léčby z pohledu farmaceutických společností. Satelitnímu sympoziu, které uspořádala společnost Novartis a jehož obsah vám ve stručnosti přinášíme, předsedali prof. MUDr. Tomáš Papajík, CSc., a doc. MUDr. Daniela Žáčková, Ph.D.
Chronická myeloidní leukemie a její léčba – je ještě co zlepšovat?
Prvního sdělení se ujala doc. MUDr. Daniela Žáčková, Ph.D., z Interní hematologické a onkologické kliniky FN Brno a LF Masarykovy univerzity. V úvodu připomněla uvedení prvního tyrozinkinázového inhibitoru (TKI) imatinibu do klinické praxe. Imatinib představoval revoluci v léčbě chronické myeloidní leukemie (CML) a v dané době nejrychleji schválené protinádorové léčivo [1,2]. Podávání imatinibu zlepšilo celkové přežití pacientů s CML na úroveň celkové populace [1]. Záhy po jeho uvedení do klinické praxe však byla zaznamenána také rezistence na tuto léčbu (mutace T315I, amplifikace genu BCR::ABL1) [3]. Ve snaze obejít mechanismy rezistence byly vyvíjeny další TKI. V současnosti je jich v klinické praxi dostupných celkem pět (www.sukl.cz): imatinib (1. generace); nilotinib, dasatinib, bosutinib (2. generace) a ponatinib reprezentující generaci třetí, který zatím jako jediný působí na mutaci T315I [4].
Díky novým lékům stále více pacientů dosahuje hluboké molekulární odpovědi (deep molecular response, DMR), která zlepšuje celkové přežití, chrání před progresí nemoci a umožňuje vysadit léčbu ve snaze dosáhnout tzv. remise bez nutnosti léčby (treatment free remission, TFR) [5,6]. Tento parametr se stal novým léčebným cílem u pacientů s CML. Postup, jehož bezpečnost a proveditelnost potvrdila řada klinických studií [7,8].
„Může tedy hematolog zabývající se terapií CML relaxovat?“ vyslovila do pléna doc. Žáčková svoji otázku. „Bohužel víme, že rezistence ani s ní související perzistence leukemických kmenových buněk nejsou vyřešeným problémem.“ V kontextu s nimi charakterizovala přednášející léčbu v pokročilých liniích jako svízelnou a terapii v pokročilých fázích onemocnění označila za naprosto neuspokojivou. Mohou se vyskytnout závažné, až život ohrožující nežádoucí účinky a ty, které je možné považovat za mírné, mohou přetrvávat a významně snižovat kvalitu života [9]. Za další problém považuje přednášející také dostupnost léčby.
Dostupnost léčby byla hlavním tématem oslav dvacátého výročí uvedení imatinibu do klinické praxe (Světový den CML 22. září 2021). Dosud značná část populace nemá k léčbě ani k řádnému monitorování jejího efektu přístup. Ten je většinou zajišťován prostřednictvím neziskových organizací. V našich podmínkách i díky centralizované péči je situace relativně příznivá. Dle recentní analýzy registru poskytované zdravotní péče SEERS nevypadají křivky přežití (očekávaného vs. zjištěného) ideálně oproti evropským standardům ani ve Spojených státech amerických [10]. Na vině horšího přežití je pravděpodobně snížená dostupnost léčby v důsledku podpojištění [10].
Další část prezentace zaměřila doc. Žáčková na problematiku tolerance léčby TKI a kvality života. „Nežádoucí účinky tyrozinkinázových inhibitorů jsou pravděpodobně důsledkem nespecifické inhibice řady dalších kináz, tzv. off target nežádoucí účinky [11]. Projevy jsou různorodé a kolísá i míra závažnosti.“ Data ze švédského registru, kde bylo s mediánem šesti let sledováno 1 328 pacientů, recentně doložila [9], že pacienti s CML léčení TKI mají oproti běžné populaci vyšší morbiditu. V případě 142 katerogií nemocí byl tento rozdíl signifikantní. Ze závažných diagnóz se jednalo například o akutní infarkt myokardu, srdeční selhání, pneumonii a sepsi [9]. Výrazný nárůst morbidity u pacientů léčených TKI oproti běžné populaci potvrdila i zaoceánská analýza [12].
I nežádoucí účinky mírné závažnosti, například únava, mohou dlouhodobě přetrvávat a negativně ovlivňovat kvalitu života [13]. „Je možné toto řešit TFR?“ zeptala se přítomných doc. Žáčková. „Tato metoda není určena pro všechny pacienty a setrvalé TFR dosáhne pouze menšina pacientů, úspěšnost se udává asi u 10–20 % osob.“ [7,14] Z hlediska bezpečnosti je tento postup úspěšný, při obnovení léčby TKI se hluboká molekulární odpověď obnoví obvykle velmi rychle [15]. Nicméně, jak doložila studie ENESTop, může v reiniciační fázi dojít k nárůstu výskytu nežádoucích účinků oproti období před vysazením léčby [15]. Ani TFR tento problém zcela neřeší. Nárůst incidence nežádoucích účinků po vysazení léčby TKI (tzv. syndrom z vysazení) je dnes již znám, pozoruhodný je nárůst zejména muskuloskeletálních nežádoucích účinků (u zhruba 50 % pacientů) [15].
Rezistence na léčbu TKI je
multifaktoriálním jevem. Za nejčastější, klinicky
nejvýznamnější a léčbou nejvíce ovlivnitelné se považují
mutace BCR::ABL1 kinázy. Dominantní mutací je T315I, která je
spojena s horším přežitím [16]. S horší prognózou
je spojeno rovněž nedosažení určité míry odpovědi na léčbu
v určitém čase – absence kompletní cytogenetické
odpovědi (complete cytogenetic response, CCyR) nebo velké
molekulární odpovědi (major molecular response, MMR) v první
linii léčby [5,17]. Dle ne/dosažení léčebné odpovědi
v určitém časovém období doporučují guidelines European
LeukemiaNet (ELN) určitou sekvenci léčby [18]. Léčba vyšších
linií však přináší řadu komplikací. S rostoucím počtem
linií narůstá podíl selhávajících pacientů a zhoršuje
se jejich přežití [17,19]. Při léčbě v pokročilých
liniích se rovněž zvyšuje riziko selekce mutací a vzniku
tzv. složených mutací (compound mutation, CM), kdy nejčastější
partnerskou mutací je právě T315I [20]. „S narůstajícím
počtem linií léčby se také zužuje výběr léčiv, která máme
v terapii k dispozici,“zdůraznila doc. Žáčková
[18] (obr. 1).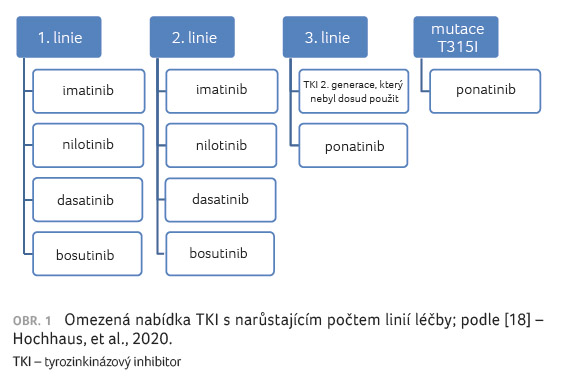
Pro léčbu třetí a vyšší linie nemáme jednoznačná doporučení. Nejednotnost terapie napříč zeměmi potvrzuje i analýza dat ze tří registrů [21] prezentovaná na loňském kongresu American Society of Hematology. Selhání léčby nebo její intolerance jsou u pacientů ve druhé a vyšší léčebné linii nejčastější příčinou ukončení terapie [21]. „Osud pacientů je i navzdory zavedení TKI velmi neuspokojivý,“ shrnula přednášející. Data ze studií prezentují omezenou účinnost TKI 2. generace v léčbě třetí a vyšší linie [22].
Jaké jsou tedy možné léčebné strategie? Jedním z přístupů, které zkoumali Cortes a kol. [23] ve studii OPTIC, je optimalizace dávkování TKI – snaha o modifikaci dávkování ponatinibu s cílem zlepšení bezpečnostního profilu. Další variantou by mohly být nové, účinnější a lépe tolerované přípravky. Ať už by se jednalo o nové účinné látky zaměřené na ATP kompetitivní inhibici, nebo o alosterické inhibitory cílící na jiné oblasti BCR::ABL1 kinázové domény důležité pro regulaci kinázové aktivity s vyšší specifitou. Specifita pro ABL je předpokladem vyšší účinnosti a nižšího rizika off target aktivity a nežádoucích účinků.
Reakce štěpu proti hostiteli refrakterní na léčbu kortikosteroidy
Palčivému tématu v oblasti transplantologie – akutní a chronické reakci štěpu proti hostiteli (graft versus host disease, GvHD) neodpovídající na kortikosteroidy (steroid resistant graft versus host disease, SR GvHD) – se ve druhém sdělení věnoval prim. MUDr. Jan Vydra, Ph.D., z Ústavu hematologie a krevní transfuze v Praze.
Akutní GvHD představuje akutní zánětlivé onemocnění vyvolané reakcí imunokompetentních buněk dárce proti tkáním příjemce. Nejčastěji se může jednat o dermatitidu, enteritidu nebo hepatitidu [24]. Primář Vydra upozornil, že vedle klasických projevů akutní GvHD existují i projevy „neklasické“, které nespadají do základní klasifikace a pro něž nemáme diagnostická kritéria. Sem patří projevy renální, plicní, hematologické a projevy v oblasti centrálního nervového systému [25].
Chronická GvHD představuje imunitně podmíněnou poruchu, kterou charakterizuje chronický zánět a fibróza, nicméně chronická GvHD může mít i velmi akutní začátek [24]. V klinickém spektru chronické GvHD je možné zaznamenat projevy kožní, oční, orální, z oblasti gastrointestinálního traktu (GIT), sick sicca syndrom či bronchiolitis obliterans syndrome (BOS). I zde je možné pozorovat neklasické klinické projevy (například hematologické či polyserositidu) [25].
Palčivými problémy v managementu GvHD jsou podle přednášejícího SR GvHD (zejména akutní SR GvHD v oblasti GIT a u chronické SR GvHD hlavně extenzivní sklerodermie a BOS), pacienti s dlouhodobou imunitní dysfunkcí a opakovanými infekcemi, a nakonec zmiňované atypické projevy GvHD.
Patogeneze akutní GvHD probíhá v několika fázích. V první fázi lokálně poškozená tkáň produkuje prozánětlivé cytokiny a signály nebezpečí, které amplifikují a vyústí v cytokinovou bouři. Dochází k aktivaci hostitelských buněk prezentujících antigen a nově infundovaných dárcovských T buněk. Další fáze zahrnuje proliferaci a diferenciaci dárcovských T buněk v reakci na hostitelské antigen prezentující buňky, což vede k rychlým biochemickým kaskádám, produkci mediátorů zesilujících zánět a k destrukci cílové tkáně [26]. Významnou roli hraje pravděpodobně i střevní mikrobiota, na tomto poli probíhá intenzivní výzkum. Experimentální modely ukazují, že dysmikrobie může v rozvoji GvHD sehrát svoji úlohu [27].
Patofyziologie chronické GvHD je složitá, pravděpodobně zahrnuje dysfunkci mechanismů určujících toleranci, podobně jako je tomu u klasických autoimunitních onemocnění. V důsledku poškození thymických epiteliálních buněk po alogenní reakci je narušena negativní selekce v brzlíku. Zkřížená reakce mezi aloreaktivními T a B buňkami zvyšuje uvolňování B buněčného aktivačního faktoru a produkci aloprotilátek. Ty spolu s produkovanými cytokiny a chemokiny aktivují makrofágy, indukují proliferaci a aktivaci tvorby fibroblastů a kolagenu, což má za následek tkáňovou fibrózu [26].
„Co znamená rezistence
na kortikosteroidy?“ Nad touto otázkou se zamyslel primář
Vydra. „Rezistenci na kortikosteroidy definujeme klinicky –
nasazená léčba nepřináší očekávané výsledky. Na vině
nemusí být vždy rezistence, pacient může trpět i jiným
onemocněním s obdobným klinickým obrazem nebo se může
jednat i o nežádoucí účinek jiné léčby.“
Specifické pochody SR GvHD zahrnují mechanismy na buněčné
i molekulární úrovni [26]. Kortikosteroidy regulují většinu
Th1 odpovědí, ale mohou paradoxně zvýšit Th2 a patogenní
Th17 zprostředkované imunitní odpovědi a podporovat GvHD.
U refrakterního onemocnění může dlouhodobé užívání
kortikosteroidů paradoxně zvýšit expresi molekulárních
„spínačů“ zánětu. V GIT mohou kortikosteroidy bránit
reparačním procesům hostitele po poranění zprostředkovaném
T buňkami. Omezená tkáňová regenerace z dlouhodobého
potlačení zánětu s probíhajícím poškozením slizniční
bariéry je spojena se změnami střevního mikrobiomu a metabolomu.
Dysbióza má za následek ztrátu ochranných metabolitů.
Probíhající zánět může nakonec stimulovat antigen prezentující
buňky ke zvýšení produkce prozánětlivých cytokinů, které
dále poškozují tkáň hostitele [28].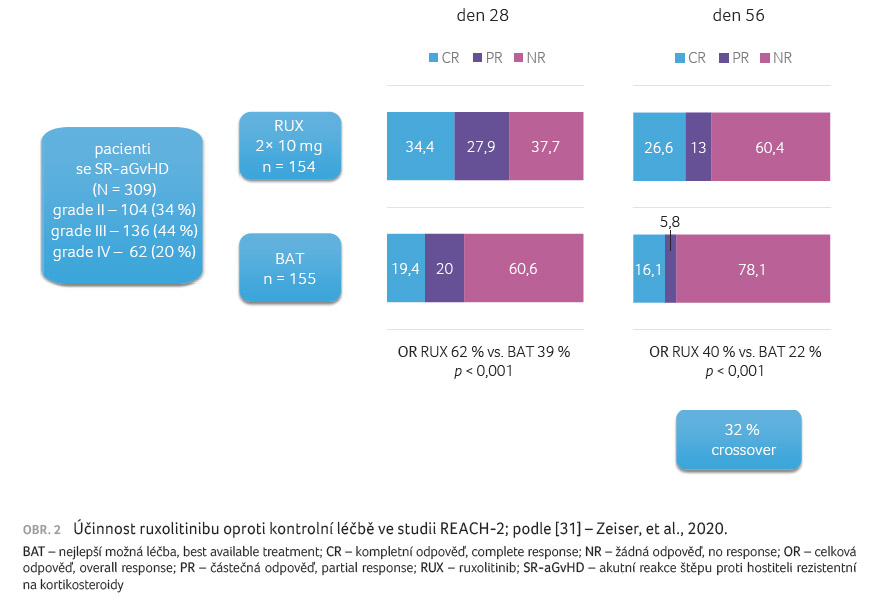
„Potřeba definovat rezistenci na kortikoidy i jinak než klinicky rozvíjí snahy o identifikaci objektivních biomarkerů a metod k potvrzení rezistence, nastínil přednášející. Příkladem kombinace validovaných sérových biomarkerů jsou ST2 a REG3α [29]. „Možnost predikovat SR GvHD nám poskytuje měření tloušťky střevní stěny sonograficky či výpočetní tomografií.“
 Primář Vydra shrnul klinickou
definici SR GvHD. O akutní SR GvHD mluvíme při
progresi onemocnění pátý den léčby nebo při absenci odpovědi
na léčbu po sedmi dnech. Chronickou SR GvHD, která se
vyskytuje asi u 50 % pacientů, definuje progrese při
léčbě prednisonem podávaným v dávce 1 mg/kg/den
minimálně po dobu dvou týdnů, stabilní onemocnění po
4–6 týdnech léčby prednisonem v dávce ≥ 0,5 mg/kg/den
a nemožnost redukovat dávku prednisonu na méně než
0,5 mg/kg/den [30].
Primář Vydra shrnul klinickou
definici SR GvHD. O akutní SR GvHD mluvíme při
progresi onemocnění pátý den léčby nebo při absenci odpovědi
na léčbu po sedmi dnech. Chronickou SR GvHD, která se
vyskytuje asi u 50 % pacientů, definuje progrese při
léčbě prednisonem podávaným v dávce 1 mg/kg/den
minimálně po dobu dvou týdnů, stabilní onemocnění po
4–6 týdnech léčby prednisonem v dávce ≥ 0,5 mg/kg/den
a nemožnost redukovat dávku prednisonu na méně než
0,5 mg/kg/den [30].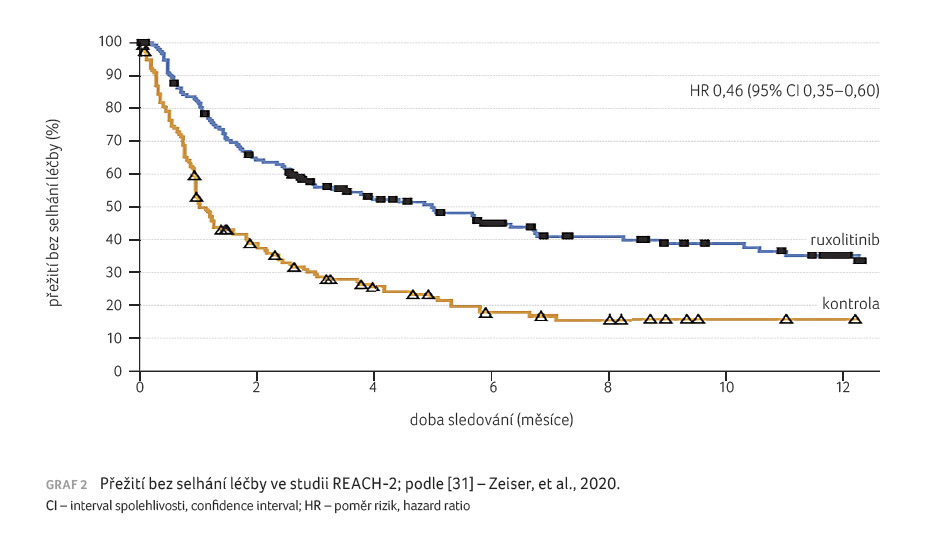
V další části prezentace se
přednášející zaměřil na recentní výsledky klinické
studie REACH 2 [31]. Tato multicentrická, randomizovaná,
otevřená studie fáze III porovnávala účinnost a bezpečnost
perorálního ruxolitinibu (10 mg dvakrát denně) s léčbou,
kterou si zkoušející vybral z běžně používaných
možností (kontrola). Zařazeni byli pacienti ve věku 12 let
nebo starší s akutní SR GvHD po alogenní
transplantaci kmenových buněk (N = 309). Primárním
cílovým ukazatelem byla celková odpověď (kompletní nebo
částečná odpověď) v den 28. Klíčovým sekundárním
cílovým ukazatelem byla trvalá celková odpověď v den 56.
Výsledky přehledně uvádí obrázek 2. Efektivita
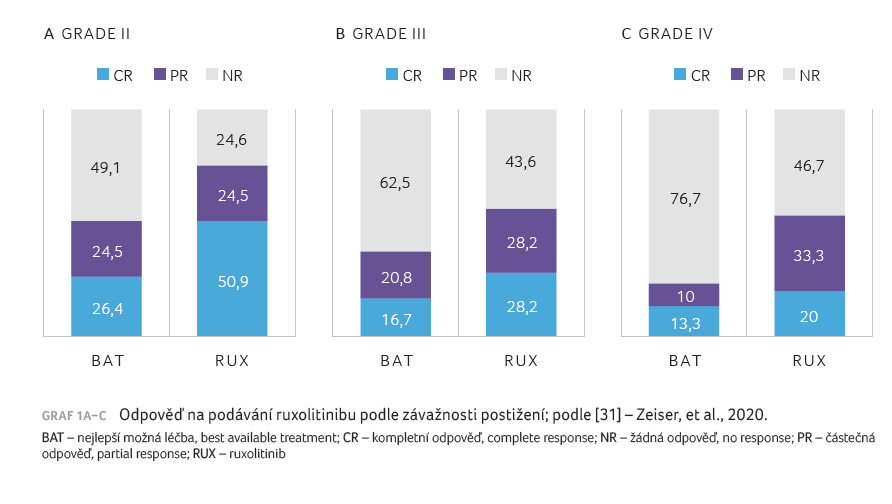
ruxolitinibu nebyla omezena závažností postižení (graf 1A–C).
Jak prezentuje graf 2, významný rozdíl bylo možné
zaznamenat i v parametru přežití bez selhání léčby
(failure free survival, FFS). Nejčastějšími nežádoucími
účinky do 28. dne byly trombocytopenie (33 % ve skupině
s ruxolitinibem vs. 18 % v kontrolní skupině), anémie
(30 % vs. 28 %) a cytomegalovirová infekce (26 % vs.
21 %) [31].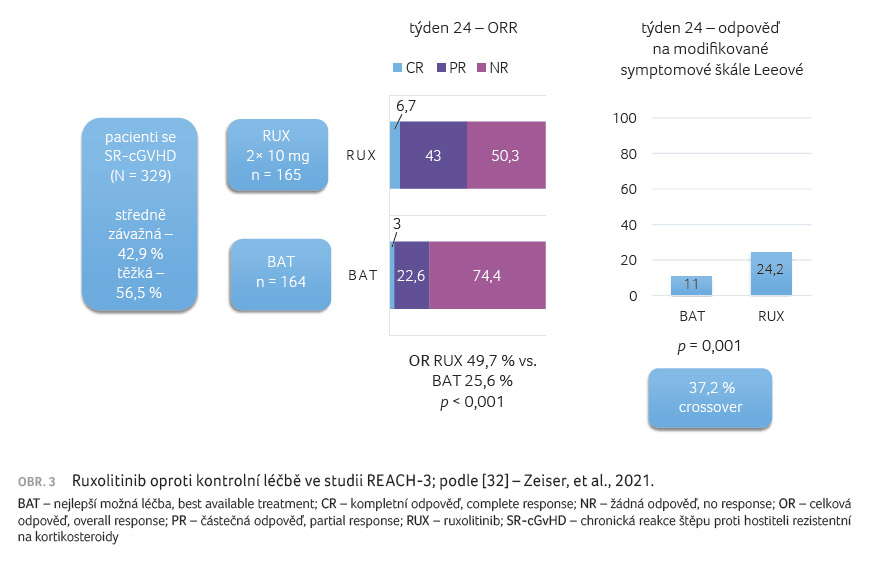
Studie REACH 3 naproti tomu
sledovala pacienty s chronickou SR GvHD (N = 329)
a přinesla obdobně příznivé výsledky [32]. Jak ukazuje
obrázek 3, celková odpověď byla vyšší ve skupině
léčené ruxolitinibem (49,7 % vs. 25,6 %; p < 0,001),
většina pacientů v tomto případě prokázala částečnou
odpověď na léčbu. Ruxolitinib vedl k delšímu mediánu
přežití bez selhání léčby než kontrolní léčba (> 18,6
měsíce vs. 5,7 měsíce; p < 0,001), graf 3.
Nejčastějšími nežádoucími účinky stupně 3 nebo vyššího
do 24. týdne byly trombocytopenie (15,2 % ve skupině
s ruxolitinibem vs. 10,1 % v kontrolní skupině)
a anémie (12,7 % vs. 7,6 %) [32]. Na základě
výsledků studií REACH-2 a REACH-3 byl ruxolitinib nedávno
schválen Evropskou lékovou agenturou pro léčbu pacientů ve věku
12 let a starších s akutní nebo chronickou GvHD,
kteří nemají adekvátní odpověď na léčbu kortikosteroidy
nebo jinou systémovou léčbu [33].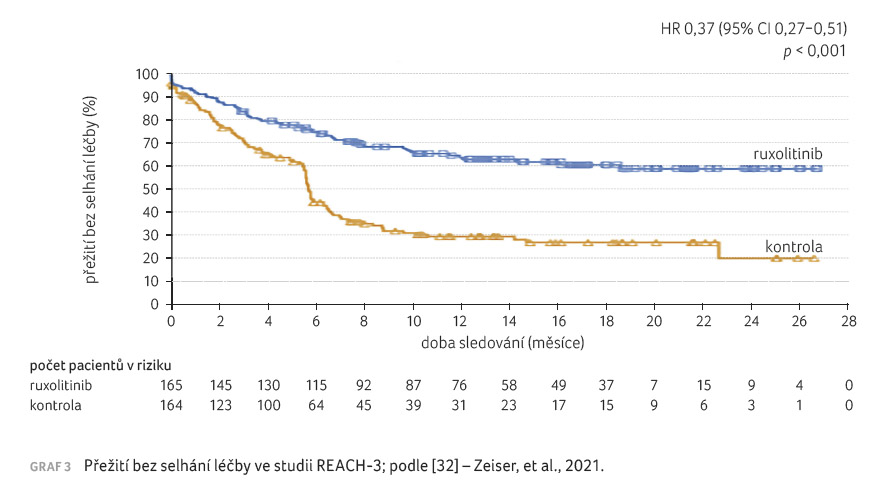
Primář Vydra v závěru prezentace krátce představil další vyvíjené postupy s cílem ovlivnit GvHD, mezi něž patří například ex vivo expandované Treg lymfocyty nebo mezenchymální kmenové buňky [34,35]. Aktuálně představuje ruxolitinib ve druhé linii léčby zejména akutní, ale i chronické GvHD významný přínos.
Výzvy a příležitosti současné medicíny u pacientů s indolentními lymfomy
Se třetím zajímavým sdělením předstoupil před auditorium prof. MUDr. Vít Procházka, Ph.D., z Hematoonkologické kliniky FN Olomouc a přítomným přiblížil význam CAR T lymfocytů v léčbě folikulárního lymfomu.
Folikulární lymfom je druhým nejčastějším typem non hodgkinského lymfomu v České republice (15–20 %) [36]. Převážná část pacientů dobře odpovídá na léčbu, onemocnění má chronický průběh s dobrým přežitím, nicméně v délce a míře odpovědi stále zůstává prostor pro zlepšení. Onemocnění, které postihuje zejména lymfatické uzliny, bývá obvykle diagnostikováno až v pokročilé fázi. U většiny pacientů má onemocnění chronický průběh s mediánem přežití kolem 18 let. Ačkoliv většina pacientů na počátku z léčby profituje, opakované relapsy jsou pro toto onemocnění typické [37]. Přibližně u 20 % pacientů dochází k časné progresi/relapsu po iniciální léčbě, a právě u těchto pacientů je prognóza výrazně horší. Vlivem narůstajícího počtu linií terapie dochází k poklesu mediánu přežití bez progrese (progression free survival, PFS) [38]. Ve třetí a pozdějších liniích léčby jsou pro dospělé pacienty s relabujícím/refrakterním folikulárním lymfomem k dispozici jen omezené možnosti dlouhodobě účinné terapie. Toto tvrzení rovněž koreluje s daty retrospektivní kohortové studie pacientů s folikulárním lymfomem, z níž vyplývá, že pacienti s časnou progresí/relapsem onemocnění (do 24 měsíců od zahájení léčby) mají výrazně horší prognózu přežití [39]. Jaké jsou aktuální možnosti v léčbě těchto pacientů?
Profesor Procházka představil
pozitivně vyhlížející výsledky klinické studie ELARA, které
dokládají účinnost tisagenlecleucelu (individualizovaná buněčná
imunoterapie geneticky modifikovanými autologními T lymfocyty,
zacílenými proti CD19) u pacientů s relabujícím/refrakterním
folikulárním lymfomem. ELARA, multicentrická studie fáze II,
probíhá celkem ve 30 centrech ve 12 zemích (v USA,
Evropě, Asii, Austrálii). Do studie byli zahrnuti pacienti
starší 18 let s histologicky potvrzeným folikulárním
lymfomem stupně 1, 2 nebo 3A refrakterním na druhou
nebo pozdější linii systémové terapie (vč. anti CD20
protilátky) nebo s relapsem do šesti měsíců
po dokončení druhé a pozdější linie terapie, případně
pacienti, u nichž došlo k relapsu během udržovací
léčby anti CD20 (po nejméně dvou liniích terapie) nebo
do šesti měsíců po dokončení udržovací léčby,
nebo pacienti s relapsem onemocnění po autologní
transplantaci krvetvorných buněk. Pro vstup do studie byla
požadována hodnota ECOG 0–1 (při screeningu). Podíl pacientů
s relapsem do 24 měsíců od zahájení léčby činil
63 % (tab. 1). Primárním cílovým ukazatelem studie bylo
dosažení kompletní odpovědi na léčbu tisagenlecleucelem.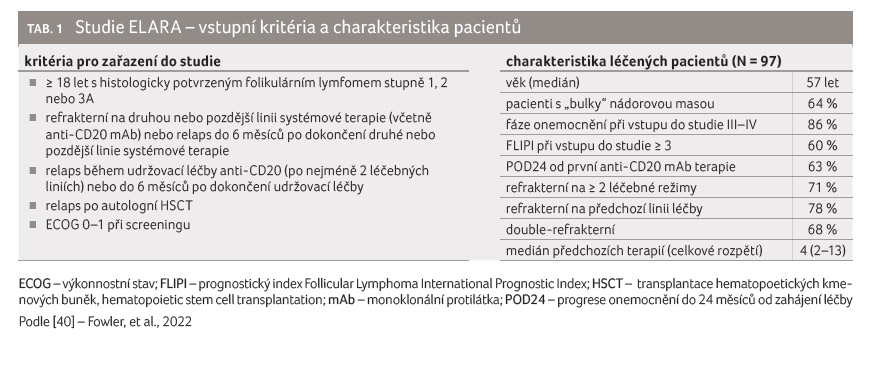
Nedávno publikované výsledky léčby po uplynutí 16 měsíců od podání jsou velmi příznivé. Celková míra odpovědi činila 86 %, přičemž kompletní odpověď byla zaznamenána u 69 % pacientů a parciální u 17 %. Kompletní odpovědi byli schopni dosáhnout pacienti napříč podskupinami včetně vysoce rizikových a obtížně léčitelných refrakterních pacientů [40].
Přednášející vyzdvihl, že i když je doba sledování zatím krátká, po roce sledování představovala pravděpodobnost PFS u pacientů s kompletní odpovědí 85,5 %. V čase primární analýzy s mediánem sledování 16,6 měsíce nebylo dosaženo mediánu PFS ani mediánu doby do nasazení další léčby (time to next treatment, TTNT). Pravděpodobnost PFS jeden rok od léčby dosáhla u celé kohorty 67 %. Nejčastějšími nehematologickými nežádoucími příhodami hlášenými ve studii byly syndrom z uvolnění cytokinů (50 %), infekce (50 %) a bolest hlavy (25 %). Nejčastější hematologické příhody zahrnovaly snížení počtu lymfocytů (92 %), počtu leukocytů (91 %), neutrofilů (89 %) a trombocytů (89 %). Tyto výsledky dokládají, že tisagenlecleucel může být účinnou terapií s přijatelným bezpečnostním profilem pro pacienty s relabujícím/refrakterním folikulárním lymfomem.
Závěrem svého sdělení profesor Procházka uvedl: „Přestože řadíme folikulární lymfom mezi indolentní lymfomy, může i toto onemocnění mít agresivní průběh. Zejména pacienti s časnou progresí mají horší prognózu. Tisagenlecleucel představuje pro pacienty s r/r folikulárním lymfomem po selhání dvou linií systémové léčby novou účinnou terapii, která si v klinické praxi jistě najde svoji úlohu. V rámci celé České republiky funguje síť certifikovaných CAR T center, se kterými je možné vhodné pacienty konzultovat.“
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Bower H, Björkholm M, Dickman PW, et al. Life Expectancy of Patients With Chronic Myeloid Leukemia Approaches the Life Expectancy of the General Population. J Clin Oncol 2016; 34: 2851–2857.
- [2] Cancer Network 2001, FDA Gives Fast Approval to Gleevec in Treatment of CML. Dostupné na: https://www.cancernetwork.com/view/fda‑gives‑fast‑approval‑gleevec‑treatment‑cml
- [3] Gorre ME, Mohammed M, Ellwood K, et al. Clinical resistance to STI‑571 cancer therapy caused by BCR‑ABL gene mutation or amplification. Science 2001; 293: 876–880.
- [4] Souhrn údajů o přípravku Iclusig. Dostupné na: https://www.sukl.cz
- [5] Hehlmann R, Müller MC, Lauseker M, et al. Deep molecular response is reached by the majority of patients treated with imatinib, predicts survival, and is achieved more quickly by optimized high‑dose imatinib: results from the randomized CML‑study IV. J Clin Oncol 2014; 32: 415–423.
- [6] Morotti A, Fava C, Saglio G. Milestones and monitoring. Curr Hematol Malig Rep 2015; 10: 167–172.
- [7] Saussele S, Richter J, Guilhot J, et al. Discontinuation of tyrosine kinase inhibitor therapy in chronic myeloid leukaemia (EURO‑SKI): a prespecified interim analysis of a prospective, multicentre, non‑randomised, trial. Lancet Oncol 2018; 19: 747–757.
- [8] Ross DM, Masszi T, Gómez Casares MT, et al. Durable treatment‑free remission in patients with chronic myeloid leukemia in chronic phase following frontline nilotinib: 96‑week update of the ENESTfreedom study. J Cancer Res Clin Oncol 2018; 144: 945–954.
- [9] Dahlén T, Edgren G, Ljungman P, et al. Adverse outcomes in chronic myeloid leukemia patients treated with tyrosine kinase inhibitors: Follow‑up of patients diagnosed 2002‑2017 in a complete coverage and nationwide agnostic register study. Am J Hematol 2022; 97: 421–430.
- [10] Jamy O, Godby R, Sarmad R, Costa LJ. Survival of chronic myeloid leukemia patients in comparison to the general population in the tyrosine kinase inhibitors era: A US population‑based study. Am J Hematol 2021; 96: E265–E268.
- [11] Lee H, Basso IN, Kim DDH. Target spectrum of the BCR‑ABL tyrosine kinase inhibitors in chronic myeloid leukemia. Int J Hematol 2021; 113: 632–641.
- [12] Chow EJ, Doody DR, Wilkes JJ, et al. Adverse events among chronic myelogenous leukemia patients treated with tyrosine kinase inhibitors: a real‑world analysis of health plan enrollees. Leuk Lymphoma 2021; 62: 1203–1210.
- [13] Zulbaran‑Rojas A, Lin HK, Shi Q, et al. A prospective analysis of symptom burden for patients with chronic myeloid leukemia in chronic phase treated with frontline second‐ and third‐generation tyrosine kinase inhibitors. Cancer Med 2018; 7: 5457–5469.
- [14] Holyoake TL, Vetrie D. The chronic myeloid leukemia stem cell: stemming the tide of persistence. Blood 2017; 129: 1595–1606.
- [15] Radich JP, Hochhaus A, Masszi T, et al. Treatment‑free remission following frontline nilotinib in patients with chronic phase chronic myeloid leukemia: 5‑year update of the ENESTfreedom trial. Leukemia 2021; 35: 1344–1355.
- [16] Nicolini FE, Ibrahim AR, Soverini S, et al. The BCR‑ABLT315I mutation compromises survival in chronic phase chronic myelogenous leukemia patients resistant to tyrosine kinase inhibitors, in a matched pair analysis. Haematologica 2013; 98: 1510–1516.
- [17] Bosi GR, Fogliatto GM, Vanelli Costa TE, et al. What happens to intolerant, relapsed or refractory chronic myeloid leukemia patients without access to clinical trials? Hematol Transfus Cell Ther 2019; 41: 222–238.
- [18] Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020; 34: 966–984.
- [19] Akard LP, Albitar M, Hill CE, Pinilla‑Ibarz J. The "hit hard and hit early" approach to the treatment of chronic myeloid leukemia: Implications of the updated national comprehensive cancer network clinical practice guidelines for routine practice. Clin Advances Hematol Oncol 2013; 11: 421–432.
- [20] Soverini S, Martelli M, Bavaro L, et al. BCR‑ABL1 compound mutants: prevalence, spectrum and correlation with tyrosine kinase inhibitor resistance in a consecutive series of Philadelphia chromosome‑positive leukemia patients analyzed by NGS. Leukemia 2021; 35: 2102–2107.
- [21] Dahlén T, Kockerols C, Ferreira G, et al. Treatment Patterns in Patients with Chronic Myeloid Leukemia in Chronic Phase in the Third Line of TKI Therapy and Beyond Based on Real‑World Evidence. (ASH 2021) Blood 2021; 138(Suppl 1): 1485.
- [22] Lipton JH, Bryden P, Sidhu MK, et al. Comparative efficacy of tyrosine kinase inhibitor treatments in the third‑line setting, for chronic‑phase chronic myelogenous leukemia after failure of second‑generation tyrosine kinase inhibitors. Leuk Res 2015; 39: 58–64.
- [23] Cortes JE, Apperley J, Lomaia E, et al. Ponatinib dose‑ranging study in chronic‑phase chronic myeloid leukemia: a randomized, open‑label phase 2 clinical trial. Blood 2021; 138: 2042–2050.
- [24] Glucksberg H, Storb R, Fefer A, et al. Clinical manifestations of graft‑versus‑host disease in human recipients of marrow from HL‑A‑matched sibling donors. Transplantation 1974; 18: 295–304.
- [25] Mariotti J, Penack O, Castagna L. Acute Graft‑versus‑Host‑Disease Other Than Typical Targets: Between Myths and Facts. Transplant Cell Ther 2021; 27: 115–124.
- [26] Ramadan A, Paczesny S. Various Forms of Tissue Damage and Danger Signals Following Hematopoietic Stem‑Cell Transplantation. Front Immunol 2015; 6: 14.
- [27] Socié G, Kean LS, Zeiser R, Blazar BR. Insights from integrating clinical and preclinical studies advance understanding of graft‑versus‑host disease. J Clin Invest 2021; 131: e149296.
- [28] Toubai T, Magenau J. Immunopathology and biology‑based treatment of steroid‑refractory graft‑versus‑host disease. Blood 2020; 136: 429–440.
- [29] Major‑Monfried H, Renteria AS, Pawarode A, et al. MAGIC biomarkers predict long‑term outcomes for steroid‑resistant acute GVHD. Blood 2018; 131: 2846–2855.
- [30] Newell LF, Holtan SG. Acute GVHD: think before you treat. Hematology Am Soc Hematol Educ Program 2021; 2021: 642–647.
- [31] Zeiser R, von Bubnoff N, Butler J, et al. Ruxolitinib for Glucocorticoid‑Refractory Acute Graft‑versus‑Host Disease. N Engl J Med 2020; 382: 1800–1810.
- [32] Zeiser R, Polverelli N, Ram R, et al. Ruxolitinib for Glucocorticoid‑Refractory Chronic Graft‑versus‑Host Disease. N Engl J Med 2021; 385: 228–238.
- [33] Souhrn údajů o přípravku Jakavi (datum poslední revize textu 29. 4. 2022). Dostupné na: https://www.sukl.cz
- [34] Landwehr‑Kenzel S, Zobel A, Schmitt‑Knosalla I, et al. Cyclosporine A but Not Corticosteroids Support Efficacy of Ex Vivo Expanded, Adoptively Transferred Human Tregs in GvHD. Front Immunol 2021; 12: 716629.
- [35] Murata M, Terakura S, Wake A, et al. Off‑the‑shelf bone marrow‑derived mesenchymal stem cell treatment for acute graft‑versus‑host disease: real‑world evidence. Bone Marrow Transplant 2021; 56: 2355–2366.
- [36] Epidemiologie hematologických malignit v České republice, ÚZIS 2017. Dostupné na: https://reporting.uzis.cz/cr/res/file/reporty/060118‑CR‑epid‑hematoonko.pdf
- [37] Janíková A, Mayer J, Michalka J, et al. Aktuální pohled na diagnostiku a léčbu folikulárního lymfomu. Onkologie 2009; 3: 147–151.
- [38] Batlevi CL, Sha F, Alperovich A, et al. Follicular lymphoma in the modern era: survival, treatment outcomes, and identification of high‑risk subgroups. Blood Cancer J 2020; 10: 74.
- [39] Casulo C, Byrtek M, Dawson KL, et al. Early Relapse of Follicular Lymphoma After Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone Defines Patients at High Risk for Death: An Analysis From the National LymphoCare Study. J Clin Oncol 2015; 33: 2516–2522.
- [40] Fowler NH, Dickinson M, Dreyling M, et al. Tisagenlecleucel in adult relapsed or refractory follicular lymphoma: the phase 2 ELARA trial. Nat Med 2022; 28: 325–332.