Semaglutid
Souhrn:
Semaglutid je agonista receptorů pro glukagonu podobný peptid 1 (glucagon‑like peptide 1, GLP‑1) s 94% homologií s lidským GLP‑1, jehož dlouhý biologický poločas a vazba na albumin umožňují podávání 1× týdně subkutánní injekcí. Studie fáze III prokázaly výborný účinek na zlepšení kompenzace diabetu 2. typu zároveň s významným poklesem tělesné hmotnosti. V ovlivnění kompenzace diabetu i snížení tělesné hmotnosti byl semaglutid zejména v dávce 1,0 mg podávané 1× týdně významně účinnější než další agonisté receptoru pro GLP‑1 i než jiná antidiabetika včetně sitagliptinu a inzulinu glargin. V prospektivní kardiovaskulární studii u diabetiků 2. typu s anamnézou kardiovaskulární příhody či s vysokým kardiovaskulárním rizikem vedlo podávání semaglutidu ke snížení výskytu kardiovaskulárních příhod. Nejčastější nežádoucí účinky semaglutidu jsou gastrointestinální. Jejich charakter a četnost výskytu jsou podobné jako u dalších agonistů receptoru pro GLP‑1. V nejbližším časovém horizontu by měl být semaglutid uveden na trh i v České republice. Kromě injekční formy je v pokročilé fázi klinického vývoje i perorální forma semaglutidu s podáváním jednou denně.
Summary:
Semaglutide is a glucagon‑like peptide‑1 (GLP‑1) agonist with 94% homology with human GLP‑1. Long half‑life and binding to albumin enables administration of semaglutide in a once‑weekly subcutaneous injection. Phase 3 studies have demonstrated excellent efficacy of semaglutide in improving glucose control in patients with type 2 diabetes along with marked body weight reductions. The efficacy of semaglutide in improving glucose control and reducing body weight in particular in a dose of 1 mg once weekly was superior to other GLP‑1 receptor agonists and other antidiabetic drugs including sitagliptin and insulin glargine. In a prospective cardiovascular outcome trial in patients with type 2 diabetes and a history of cardiovascular event or at high cardiovascular risk, semaglutide decreased the risk of cardiovascular events. The most common side effects of semaglutide are gastrointestinal. Their characteristics and frequency are similar to other GLP‑1 receptor agonists. Semaglutide shall be introduced to the market in the Czech Republic next year. In addition to administration in a subcutaneous injection, an oral form of semaglutide administered once daily is in the advanced stage of clinical development.
Key words: semaglutide, type 2 diabetes mellitus, GLP‑1, obesity
Farmakoterapeutická skupina
Léčiva k terapii diabetu, Analoga GLP 1 (peptidu podobného glukagonu 1), ATC kód: A10BJ06.
Mechanismus účinku
Semaglutid je analog inkretinového hormonu GLP 1 (glucagon like peptide 1) s 94% sekvenční homologií s lidským GLP 1. Semaglutid působí jako agonista receptoru pro GLP 1, na který se selektivně váže a vede k jeho aktivaci. Metabolické účinky GLP 1 v organismu zahrnují stimulaci sekrece inzulinu, snížení sekrece glukagonu spolu se zlepšením kompenzace diabetu [1]. Významný je efekt na snížení příjmu potravy, pokles tělesné hmotnosti, mírné snížení krevního tlaku a na zlepšení lipidogramu (obr. 1).
Semaglutid podobně jako endogenní
GLP 1 snižuje glykemii v závislosti na koncentraci
glukózy tak, že při vysoké glykemii stimuluje sekreci inzulinu
a snižuje sekreci glukagonu. Mechanismus snižování glykemie
zahrnuje rovněž mírné zpoždění vyprazdňování žaludku
v časné postprandiální fázi. Při hypoglykemii snižuje
semaglutid sekreci inzulinu a neovlivňuje sekreci glukagonu.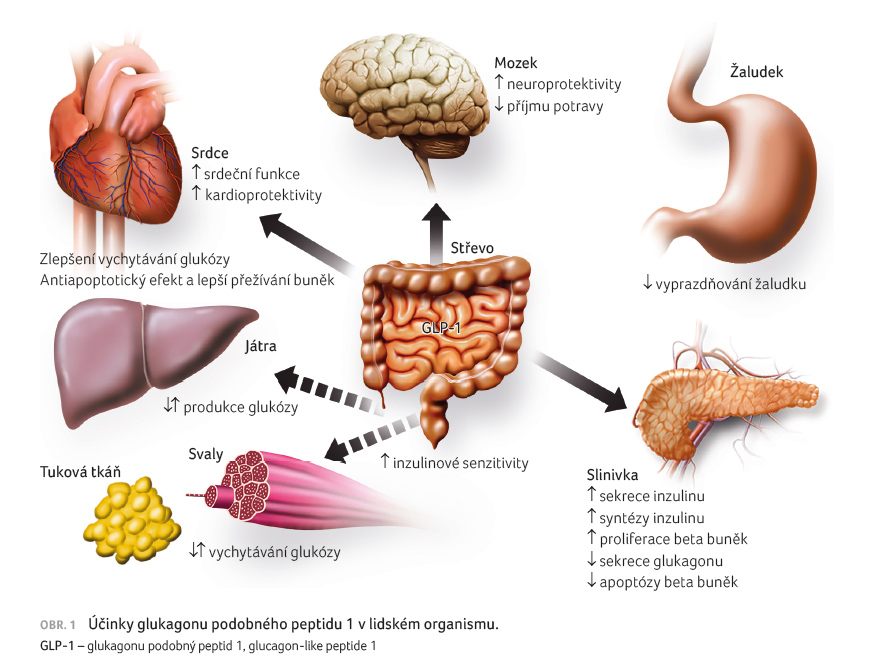
Semaglutid redukuje tělesnou hmotnost a množství tělesného tuku díky snížení příjmu potravy. Kromě toho semaglutid v některých studiích snížil preferenci potravin s vysokým obsahem tuku. Receptory GLP 1 jsou také přítomny v srdci, cévách, imunitním systému a v ledvinách [2]. Semaglutid měl v klinických studiích pozitivní vliv na lipidogram v plazmě, snižoval systolický krevní tlak a vedl k potlačení zánětu. V experimentálních studiích vedl semaglutid k redukci vzniku aterosklerózy díky zpomalení progrese aterosklerotických plátů a v důsledku snížení zánětlivé reakce v plátech.
Farmakodynamické účinky
Všechna farmakodynamická hodnocení byla provedena po 12 týdnech léčby v ustáleném stavu při dávce 1 mg semaglutidu podávané jednou týdně [3].
Ovlivnění glykemie a sekrece inzulinu
Semaglutid snižuje plazmatické koncentrace glukózy nalačno i postprandiálně. U pacientů s diabetem 2. typu vedla léčba semaglutidem v dávce 1 mg týdně ke snížení glykemie nalačno v porovnání s placebem o 1,6 mmol/l (pokles o 22 %). Postprandiální glykemie 2 hodiny po jídle poklesla o 4,1 mmol/l, což představovalo 37% snížení. Semaglutid také snížil průměrnou glykemii i glykemickou variabilitu.
Semaglutid zlepšuje funkci beta buněk. V porovnání s placebem semaglutid zlepšil první i druhou fázi inzulinové sekrece a zvýšil maximální sekreční kapacitu beta buněk u pacientů s diabetem 2. typu. Kromě toho léčba semaglutidem zvýšila plazmatické koncentrace inzulinu nalačno v porovnání s placebem. Semaglutid také snižuje plazmatické koncentrace glukagonu nalačno i postprandiálně, avšak nemění jeho hodnoty při arteficiálně navozené hypoglykemii.
Příjem energie
Semaglutid způsobil mírné zpoždění časného postprandiálního vyprazdňování žaludku, což snížilo rychlost, jakou se glukóza postprandiálně dostává do krevního oběhu. Semaglutid v porovnání s placebem snížil příjem energie ze tří po sobě jdoucích ad libitum jídel o 18–35 %. Tento účinek byl vyvolán potlačením chuti k jídlu způsobeným semaglutidem ve stavu nalačno i postprandiálně, zlepšenou kontrolou konzumace jídla, menší touhou po jídle a relativně nižší preferencí potravin s vysokým obsahem tuku.
Koncentrace lipidů nalačno a postprandiálně
Semaglutid v porovnání s placebem snižoval plazmatické koncentrace triglyceridů a VLDL cholesterolu nalačno o 12 % a 21 %. Postprandiální vzestup hodnot triglyceridů a VLDL cholesterolu po jídle s vysokým obsahem tuku byl snížen o více než 40 %.
Vliv na QT interval
Semaglutid neprodlužoval QT interval ani při podávání v supraterapeutických dávkách (až 1,5 mg v ustáleném stavu).
Farmakokinetické vlastnosti
V porovnání s přirozeným GLP 1 má semaglutid biologický poločas prodloužený přibližně na jeden týden, takže je vhodný pro subkutánní podávání jednou týdně [4]. Základním mechanismem prodloužení délky účinku je snížená degradace dipeptidyl peptidázou 4 (DPP 4) a vazba na albumin se snížením renální clearance a s ochranou před metabolickou degradací [5].
Absorpce
Maximální plazmatické koncentrace bylo dosaženo za 1–3 dny po podání dávky. Expozice v ustáleném stavu bylo dosaženo po 4–5 týdnech při podávání jednou týdně. U pacientů s diabetem 2. typu byly průměrné koncentrace v ustáleném stavu po subkutánním podání 0,5 mg semaglutidu přibližně 16 nmol/l a po subkutánním podání 1 mg semaglutidu přibližně 30 nmol/l. Expozice semaglutidu se při dávkách 0,5 mg a 1 mg zvyšovala úměrně dávce. Při subkutánním podání semaglutidu do břicha, stehna nebo do horní části paže bylo dosaženo obdobné expozice. Absolutní biologická dostupnost semaglutidu po subkutánním podání byla 89 %.
Distribuce
Průměrný distribuční objem semaglutidu po subkutánním podání pacientům s diabetem 2. typu byl přibližně 12,5 l. Semaglutid se ve značné míře vázal na albumin v plazmě (> 99 %).
Metabolismus/biotransformace
Před exkrecí je semaglutid ve značné míře metabolizován cestou proteolytického štěpení hlavního peptidového řetězce a sekvenční beta oxidací postranního řetězce mastné kyseliny. Předpokládá se, že na metabolizaci semaglutidu se podílí enzym neutrální endopeptidáza.
Eliminace
Ve studii s jednorázovou subkutánní dávkou radioaktivně značeného semaglutidu bylo zjištěno, že primárními cestami exkrece metabolitů semaglutidu byly moč a stolice; přibližně dvě třetiny metabolitů semaglutidu byly vyloučeny v moči a přibližně jedna třetina ve stolici. Přibližně 3 % dávky byla vyloučena v moči ve formě intaktního semaglutidu. U pacientů s diabetem 2. typu byla clearance semaglutidu přibližně 0,05 l/hod. S poločasem eliminace přibližně jeden týden bude semaglutid přítomen v krevním oběhu asi pět týdnů po poslední dávce.
Klinické zkušenosti
Semaglutid byl studován v rámci rozsáhlého klinického programu SUSTAIN. V rámci studií fáze IIIa SUSTAIN 1–5 bylo zařazeno celkem 5 098 pacientů s diabetem 2. typu, kteří byli randomizováni k podávání semaglutidu 1× týdně versus k podávání placeba či aktivních komparátorů [6]. Vstupní a vylučovací kritéria byla v rámci studií SUSTAIN 1–5 a také SUSTAIN 7 podobná. Cílem těchto studií bylo posoudit antidiabetickou účinnost a bezpečnost semaglutidu. Šlo o diabetiky 2. typu ve věku ≥ 18 let s hodnotami glykovaného hemoglobinu (HbA1c) v rozmezí 7–10 % (54–87 mmol/mol) pro studie SUSTAIN 1, 4 a 5 a v rozmezí 7–10,5 % (54–92 mmol/mol) pro studie SUSTAIN 2, 3 a 7. Hlavními vylučovacími kritérii byly anamnéza chronické nebo idiopatické akutní pankreatitidy, rodinná či osobní anamnéza medulárního karcinomu štítné žlázy nebo syndromu mnohočetné endokrinní neoplazie typu 2, sérové koncentrace kalcitoninu ≥ 50 ng/ml nebo akutní koronární či kardiovaskulární příhoda, k níž došlo v rozmezí 90 dnů od zařazení. V rámci studie SUSTAIN 7 byla vylučovací kritéria podobná s výjimkou vyloučení pacientů s anamnézou infarktu myokardu, cévní mozkové příhody nebo hospitalizace pro nestabilní anginu pectoris či s anamnézou tranzitorní ischemické ataky nebo srdečního selhání IV. stupně v rozmezí 180 dnů před zařazením do studie. Dalším vylučovacím kritériem v rámci studie SUSTAIN 7 byla přítomnost proliferativní diabetické retinopatie.
Ve studii SUSTAIN 1 vedlo
30týdenní podávání semaglutidu v dávkách 0,5 mg
a 1,0 mg 1× týdně k poklesu koncentrace HbA1c
o 1,5 %, resp. 1,6 % ve srovnání s žádnou
změnou u placebové skupiny. Poklesy tělesné hmotnosti byly
3,7 kg a 4,5 kg ve srovnání s jejím snížením
o 1 kg při podávání placeba [7].
Ve studii SUSTAIN 2 snížilo podávání semaglutidu v dávkách
0,5 mg a 1,0 mg 1× týdně hodnoty HbA1c
o 1,3 % a 1,6 % ve srovnání s poklesem
o 0,5 % při léčbě sitagliptinem. Zároveň vedla léčba
semaglutidem k výraznějšímu poklesu hmotnosti (o 4,3 kg,
resp. 6,1 kg, vs. pokles o 1,9 kg při léčbě
sitagliptinem) [8]. Podobně ve studii
SUSTAIN 3 byl semaglutid v dávce 1,0 mg významně účinnější
při snížení jak hodnot HbA1c, tak i tělesné
hmotnosti ve srovnání s exenatidem aplikovaným 1× týdně
[9]. Ve studii SUSTAIN 4 byla
prokázána signifikantně vyšší účinnost semaglutidu při
zlepšení kompenzace ve srovnání s inzulinem glargin
(pokles HbA1c o 1,2 % a 1,6 % ve srovnání
se snížením o 0,8 % při léčbě glarginem). Semaglutid
navíc vedl ke snížení hmotnosti o 3,5 kg, respektive
5,2 kg, zatímco inzulin glargin tělesnou hmotnost o 1,2 kg
zvýšil [10]. V rámci studie SUSTAIN
5 vedlo přidání semaglutidu v dávkách 0,5 mg a 1,0 mg
pacientům léčeným dlouhodobě působícím inzulinem k poklesu
hodnot HbA1c o 1,4 %, resp. 1,8 %, přičemž
v placebové skupině došlo ke snížení o 0,1 %.
Zároveň při léčbě semaglutidem poklesla hmotnost o 3,7 kg
a 6,4 kg ve srovnání s poklesem o 1,4 kg
v placebové skupině [11]. Změny
hodnot HbA1c a tělesné hmotnosti u pacientů
ve studiích SUSTAIN 1–5 jsou znázorněny v grafech 1 a 2.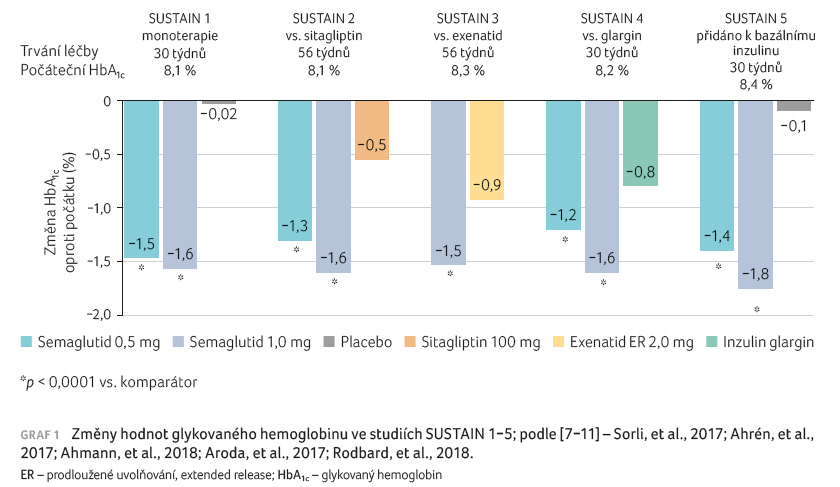
Studie SUSTAIN 7 představovala přímé
srovnání léčby semaglutidem v dávkách 0,5 mg a 1,0 mg
1× týdně s podáváním dulaglutidu v dávce
0,75 mg a 1,5 mg 1× týdně. Studie prokázala
významnější snížení hodnot HbA1c při léčbě
semaglutidem v obou dávkách (pokles o 1,5 %, resp.
1,8 %) ve srovnání s dulaglutidem (poklesy o 1,1 %,
resp. 1,4 %) [12]. Rovněž snížení
hmotnosti bylo výraznější při léčbě semaglutidem
(poklesy o 4,6 kg, resp. 6,5 kg, vs. snížení o 2,3 kg
a 3,0 kg při léčbě dulaglutidem) při srovnatelném
výskytu nežádoucích účinků.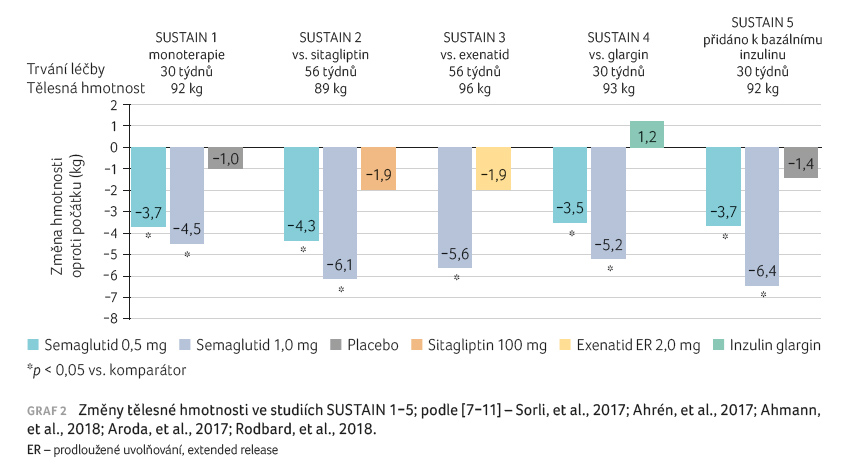
Studie SUSTAIN 6 byla od předchozích
studií odlišná jak uspořádáním, tak i vstupními
a vylučovacími kritérii. Šlo o předregistrační
prospektivní studii, jejímž cílem bylo prokázat kardiovaskulární
bezpečnost semaglutidu ve srovnání s placebem; obojí
v kombinaci se standardní antidiabetickou léčbou u pacientů
s vysokým kardiovaskulárním rizikem nebo s anamnézou
již prodělané kardiovaskulární příhody [13].
Do studie bylo zařazeno 3 297 pacientů, kteří byli
randomizováni k podávání semaglutidu v dávce 1,0 mg
1× týdně vs. placeba, obojí v kombinaci se
standardní antidiabetickou léčbou. Výskyt primárního cílového
ukazatele (kombinace smrti z kardiovaskulárních příčin,
nefatálního infarktu myokardu a nefatálních cévních
mozkových příhod) byl při podávání semaglutidu významně
snížen – o 26 % (graf 3), přičemž
největší vliv byl prokázán na pokles výskytu nefatálních
cévních mozkových příhod (snížení o 39 %).
Kardiovaskulární mortalita se mezi skupinami významně nelišila,
při léčbě semaglutidem však došlo k signifikantnímu
zpomalení progrese diabetického onemocnění ledvin. Naopak byl při
léčbě semaglutidem zvýšen výskyt komplikací diabetické
retinopatie (pouze u podskupiny nemocných s již přítomnou
proliferativní retinopatií), což investigátoři hodnotili jako
důsledek mimořádně rychlého snížení hodnot HbA1c
při zahájení léčby semaglutidem. Podobné zhoršení bylo již
v minulosti pozorováno při rychlém zlepšení kompenzace
například u nemocných s diabetem v těhotenství
nebo po převedení neuspokojivě kompenzovaných diabetiků
2. typu z léčby perorálními antidiabetiky na léčbu
inzulinem [14]. Je důležité zdůraznit,
že zvýšení výskytu komplikací diabetické retinopatie nebylo
pozorováno v žádné z dalších studií programu SUSTAIN
a i v rámci studie SUSTAIN 6 k němu došlo
pouze u pacientů s již přítomnou proliferativní
diabetickou retinopatií.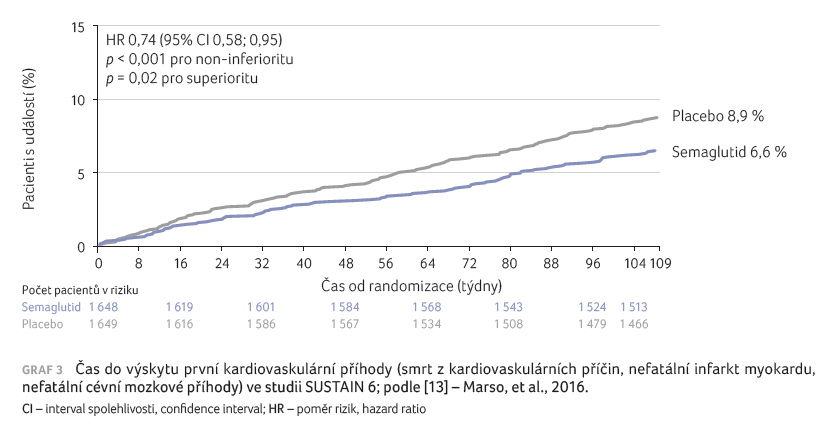
Indikace
Semaglutid je indikován k léčbě dospělých pacientů s nedostatečně kompenzovaným diabetes mellitus 2. typu jako doplněk k dietním opatřením a ke cvičení
- jako monoterapie, pokud je metformin považován za nevhodný v důsledku nesnášenlivosti nebo kontraindikací,
- jako doplněk k ostatním antidiabetikům.
Dávkování
Počáteční dávka je 0,25 mg semaglutidu jednou týdně. Po 4 týdnech se má dávka zvýšit na 0,5 mg jednou týdně. Minimálně po 4 týdnech s dávkou 0,5 mg jednou týdně se pro další zlepšení kontroly glykemie může dávka zvýšit na 1 mg jednou týdně.
Dávka 0,25 mg semaglutidu by neměla být udržovací. Týdenní dávky vyšší než 1 mg se nedoporučují.
V případě, že je semaglutid přidán ke stávající terapii metforminem a/nebo thiazolidindiony, může se aktuální dávka metforminu a/nebo thiazolidindionů ponechat beze změn. V případě, že je semaglutid přidán k léčbě deriváty sulfonylurey nebo inzulinem, je třeba zvážit snížení dávky derivátů sulfonylurey nebo inzulinu, aby se snížilo riziko hypoglykemie.
Monitorování léčby
Pro nastavení ani titraci dávky semaglutidu není selfmonitoring glykemie nutný. Při zahájení léčby semaglutidem v kombinaci s deriváty sulfonylurey nebo inzulinem je však selfmonitoring glykemie nezbytný k nastavení dávky derivátů sulfonylurey nebo inzulinu, aby se snížilo riziko hypoglykemie. Selfmonitoring by měl být těmto pacientům umožněn spolu s edukací o příznacích, prevenci a léčbě hypoglykemie.
Postup v případě vynechání dávky
V případě vynechání dávky je třeba ji podat co nejdříve, a to nejpozději do pěti dnů po jejím opomenutí. Pokud uplynulo více než pět dnů, opomenutá dávka léku se má vynechat a další dávka se má podat v den, na který byla původně naplánována. Poté mohou pacienti pokračovat v pravidelném schématu dávkování.
Odlišnosti v dávkování u specifických populací
Z důvodu věku není nutná žádná úprava dávkování. Zkušenosti s léčbou pacientů ve věku ≥ 75 let jsou omezené. Stejně tak bezpečnost a účinnost semaglutidu u dětí a dospívajících ve věku do 18 let nebyla dosud stanovena.
U pacientů s lehkou, středně těžkou či těžkou poruchou funkce ledvin není nutná žádná úprava dávkování. Zkušenosti s podáváním semaglutidu pacientům s těžkou poruchou funkce ledvin jsou omezené. Použití semaglutidu se nedoporučuje u pacientů v konečném stadiu poruchy funkce ledvin.
U pacientů s poruchou funkce jater není nutná žádná úprava dávky. Zkušenosti s podáváním semaglutidu pacientům s těžkou poruchou funkce jater jsou omezené. Při léčbě těchto pacientů semaglutidem je třeba dbát opatrnosti.
Kontraindikace
Absolutní kontraindikací léčby semaglutidem je hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku přípravku. Semaglutid se nesmí používat u pacientů s diabetes mellitus 1. typu nebo k léčbě diabetické ketoacidózy. Nejsou žádné zkušenosti s podáváním pacientům s městnavým srdečním selháním hodnoceným podle kritérií vypracovaných New York Heart Association (NYHA) jako NYHA třídy IV. Semaglutid proto není u těchto pacientů doporučován.
U pacientů s diabetickou retinopatií léčených inzulinem a semaglutidem bylo pozorováno zvýšené riziko rozvoje komplikací diabetické retinopatie (viz výše studie SUSTAIN 6). Při používání semaglutidu u pacientů s diabetickou retinopatií, kteří jsou léčeni inzulinem, je třeba dbát opatrnosti a tyto pacienty pečlivě monitorovat.
Nežádoucí účinky
V osmi studiích fáze IIIa bylo semaglutidem léčeno celkem 4 792 pacientů. Nejčastěji hlášenými nežádoucími účinky v klinických studiích byly gastrointestinální poruchy, včetně nauzey (velmi časté), průjmu (velmi časté) a zvracení (časté). Tyto účinky byly obecně lehké nebo středně závažné a měly krátkou dobu trvání. Mezi časté nežádoucí účinky (s výskytem ≥ 1/100 až < 1/10 pacientů) patřily hypoglykemie při kombinaci semaglutidu s jinými perorálními antidiabetiky (deriváty sulfonylurey), snížená chuť k jídlu, závrať, snížená hmotnost. Výskyt nežádoucích účinků byl podobný jako u jiných dlouhodobě působících agonistů receptoru pro GLP 1.
Lékové interakce
Semaglutid zpožďuje vyprazdňování žaludku a má potenciál ovlivnit rychlost absorpce současně podávaných perorálních léčivých přípravků. Musí se proto používat s opatrností u pacientů, kteří dostávají perorální léčivé přípravky vyžadující rychlou gastrointestinální absorpci. Léčba semaglutidem neovlivnila celkovou expozici paracetamolu, etinylestradiolu a levonorgestrelu, atorvastatinu, digoxinu, metforminu či warfarinu. Nepředpokládají se tedy klinicky významné interakce s těmito léky. Po zahájení léčby semaglutidem se však u pacientů užívajících warfarin nebo další deriváty kumarinu doporučuje časté monitorování hodnot INR (i s ohledem na možné změny příjmu a složení potravy).
Těhotenství a kojení
Studie na zvířatech prokázaly reprodukční toxicitu. Údaje o podávání semaglutidu těhotným ženám jsou omezené. Semaglutid se proto nesmí v těhotenství používat. Pokud si pacientka přeje otěhotnět nebo otěhotní, léčba semaglutidem se musí přerušit, a to nejméně dva měsíce před plánovaným těhotenstvím. U laktujících potkanů byl semaglutid vylučován do mléka. Jelikož nelze vyloučit riziko pro kojené dítě, nesmí se semaglutid v období kojení používat.
Zařazení do současné palety
léčiv
Semaglutid patří mezi agonisty receptoru pro GLP 1 s aplikací 1× týdně. Podobně jako další zástupci této skupiny s delším biologickým poločasem (liraglutid, dulaglutid, exenatid QW s aplikací 1× týdně) vede k významnému zlepšení kompenzace diabetu spolu s poklesem tělesné hmotnosti, snížením krevního tlaku a zlepšením lipidogramu [15,16]. V přímém srovnání s liraglutidem i dulaglutidem byl semaglutid signifikantně účinnější ve zlepšení kompenzace diabetu i snížení tělesné hmotnosti [3,12]. V předregistrační prospektivní kardiovaskulární studii vedlo podávání semaglutidu ve srovnání s placebem (obojí v kombinaci se standardní antidiabetickou léčbou) k významnému snížení výskytu kombinovaného kardiovaskulárního cílového ukazatele (smrt z kardiovaskulárních příčin, nefatální infarkt myokardu a nefatální cévní mozková příhoda) [13].
Jde tedy o dosud nejúčinnějšího zástupce skupiny agonistů receptoru pro GLP 1 s velkým potenciálem pro dlouhodobě úspěšnou léčbu diabetu 2. typu jak z pohledu zlepšení kompenzace, tak i z pohledu pozitivního ovlivnění kardiovaskulárních rizikových faktorů a snížení výskytu kardiovaskulárních příhod. Preference agonistů receptoru pro GLP 1 jako první volby injekční terapie diabetu 2. typu je nově doporučena i v rámci společného konsenzu Americké diabetologické asociace a Evropské asociace pro studium diabetu publikovaného v letošním roce [17].
S ohledem na dobrou účinnost i dlouhodobě snížený výskyt chronických komplikací lze očekávat, že léčba semaglutidem bude i nákladově efektivní. Ve velmi pokročilém stadiu vývoje se nachází i perorální forma semaglutidu s podáváním 1× denně, jejíž účinnost i bezpečnost se zdá být podobná formě subkutánní [18]. Kromě použití v léčbě diabetu probíhá klinický program zaměřený na použití semaglutidu v léčbě obezity.
Práce byla podpořena výzkumným záměrem MZ ČR RVO VFN64165.
Seznam použité literatury
- [1] Holst JJ, Deacon CF, Vilsboll T, et al. Glucagon‑like peptide‑1, glucose homeostasis and diabetes. Trends Mol Med 2008; 14: 161−168.
- [2] Ussher JR, Drucker DJ. Cardiovascular actions of incretin‑based therapies. Circ Res 2014; 114: 1788−1803.
- [3] Nauck MA, Petrie JR, Sesti G, et al. A Phase 2, Randomized, Dose‑Finding Study of the Novel Once‑Weekly Human GLP‑1 Analog, Semaglutide, Compared With Placebo and Open‑Label Liraglutide in Patients With Type 2 Diabetes. Diabetes Care 2016; 39: 231−241.
- [4] Hall S, Isaacs D, Clements JN. Pharmacokinetics and Clinical Implications of Semaglutide: A New Glucagon‑Like Peptide (GLP)‑1 Receptor Agonist. Clin Pharmacokinet 2018; doi: 10.1007/s40262‑018‑0668‑z.
- [5] Lau J, Bloch P, Schaffer L, et al. Discovery of the Once‑Weekly Glucagon‑Like Peptide‑1 (GLP‑1) Analogue Semaglutide. J Med Chem 2015; 58: 7370−7380.
- [6] Goldenberg RM, Steen O. Semaglutide: Review and Place in Therapy for Adults With Type 2 Diabetes. Can J Diabetes 2018; doi: 10.1016/j.jcjd.2018.05.008.
- [7] Sorli C, Harashima SI, Tsoukas GM, et al. Efficacy and safety of once‑weekly semaglutide monotherapy versus placebo in patients with type 2 diabetes (SUSTAIN 1): a double‑blind, randomised, placebo‑controlled, parallel‑group, multinational, multicentre phase 3a trial. Lancet Diabetes Endocrinol 2017; 5: 251−260.
- [8] Ahrén B, Masmiquel L, Kumar H, et al. Efficacy and safety of once‑weekly semaglutide versus once‑daily sitagliptin as an add‑on to metformin, thiazolidinediones, or both, in patients with type 2 diabetes (SUSTAIN 2): a 56‑week, double‑blind, phase 3a, randomised trial. Lancet Diabetes Endocrinol 2017; 5: 341−354.
- [9] Ahmann AJ, Capehorn M, Charpentier G, et al. Efficacy and Safety of Once‑Weekly Semaglutide Versus Exenatide ER in Subjects With Type 2 Diabetes (SUSTAIN 3): A 56‑Week, Open‑Label, Randomized Clinical Trial. Diabetes Care 2018; 41: 258−266.
- [10] Aroda VR, Bain SC, Cariou B, et al. Efficacy and safety of once‑weekly semaglutide versus once‑daily insulin glargine as add‑on to metformin (with or without sulfonylureas) in insulin‑naive patients with type 2 diabetes (SUSTAIN 4): a randomised, open‑label, parallel‑group, multicentre, multinational, phase 3a trial. Lancet Diabetes Endocrinol 2017; 5: 355−366.
- [11] Rodbard HW, Lingvay I, Reed J, et al. Semaglutide Added to Basal Insulin in Type 2 Diabetes (SUSTAIN 5): A Randomized, Controlled Trial. J Clin Endocrinol Metab 2018; 103: 2291−2301.
- [12] Pratley RE, Aroda VR, Lingvay I, et al. Semaglutide versus dulaglutide once weekly in patients with type 2 diabetes (SUSTAIN 7): a randomised, open‑label, phase 3b trial. Lancet Diabetes Endocrinol 2018; 6: 275−286.
- [13] Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med 2016; 375: 1834−1844.
- [14] Henricsson M, Janzon L, Groop L. Progression of retinopathy after change of treatment from oral antihyperglycemic agents to insulin in patients with NIDDM. Diabetes Care 1995; 18: 1571−1576.
- [15] Madsbad S, Kielgast U, Asmar M, et al. An overview of once‑weekly GLP‑1 receptor agonists – available efficacy and safety data and perspectives for the future. Diabetes Obes Metab 2011; 13: 394−407.
- [16] Htike ZZ, Zaccardi F, Papamargaritis D, et al. Efficacy and safety of glucagon‑like peptide‑1 receptor agonists in type 2 diabetes: A systematic review and mixed‑treatment comparison analysis. Diabetes Obes Metab 2017; 19: 524−536.
- [17] Davies MJ, DʼAlessio DA, Fradkin J, et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2018; 41: 2669−2701.
- [18] Davies M, Pieber TR, Hartoft‑Nielsen ML, et al. Effect of Oral Semaglutide Compared With Placebo and Subcutaneous Semaglutide on Glycemic Control in Patients With Type 2 Diabetes: A Randomized Clinical Trial. JAMA 2017; 318: 1460−1470.