Studie IRONMAN rozšiřuje evidenci pro léčbu i.v. železem u nemocných se srdečním selháním, sníženou funkcí levé komory srdeční a deficitem železa
Souhrn
Krejčí J, Bakošová M. Studie IRONMAN rozšiřuje evidenci pro léčbu i.v. železem u nemocných se srdečním selháním, sníženou funkcí levé komory srdeční a deficitem železa. Remedia 2023; 33: 150–153.
Autoři shrnují poznatky v oblasti diagnostiky a léčby deficitu železa jako jedné z nejčastějších komorbidit u pacientů se srdečním selháním. V úvodu nabízejí přehled dosavadních studií a vývoje doporučení ve stanovování deficitu železa u pacientů se srdečním selháním a doporučení v podávání intravenózního železa jako vhodného způsobu suplementace železa u těchto pacientů, a to konkrétně karboxymaltózou železa. V hlavní části se věnují shrnutí výsledků velké randomizované studie IRONMAN, která u pacientů se srdečním selháním hodnotila dlouhodobý efekt intravenózní suplementace deficitu železa derizomaltózou železa. Ve studii došlo ke snížení výskytu primárního cílového ukazatele – počtu hospitalizací pro srdeční selhání a kardiovaskulární mortality, zejména pokud byly zohledněny dopady pandemie covidu‑19, a k pozitivnímu ovlivnění dalších parametrů. Studie tak podporuje dosavadní poznatky o přínosu intravenózní suplementace železa u pacientů se srdečním selháním.
Klíčová slova: deficit železa – srdeční selhání – derizomaltóza železa.
Summary
Krejci J, Bakosova M. The IRONMAN trial widens evidence supporting treatment with intravenous iron in patients with heart failure, limited left ventricular function and iron deficiency. Remedia 2023; 33: 150–153.
The authors summarize the current knowledge concerning evaluation and treatment of iron deficiency in heart failure patients (this deficiency being one of their most common comorbidities). They start from currently available trials and evolution of recommendations how to establish the diagnosis of iron deficiency and how to supply iron intravenously in these patients, using iron carboxymaltose. Most of the article deals with IRONMAN, a large randomized trial evaluating the long‑term effect of iron supplementation with iron derisomaltose. The primary endpoint consisting of hospitalizations for heart failure and cardiovascular mortality has changed favorably and so have other parameters, especially when COVID‑19 pandemic was taken into account. Thus, the above trial supports intravenous iron supplementation in heart failure patients.
Key words: iron deficiency – heart failure – iron derisomaltose.
Úvod
Nedostatek železa (iron deficiency, ID) je jednou z nejčastějších komorbidit u pacientů se srdečním selháním (heart failure, HF) a má negativní dopad na funkční stav, kvalitu života, výkonnost a riziko hospitalizace z důvodu HF, a to bez ohledu na přítomnost anémie. U ambulantních pacientů se stabilním chronickým HF se ID vyskytuje přibližně v 50 %, pacienti s akutním HF jím trpí až v 80 % [1,2].
Dle současných doporučených postupů pro diagnostiku a léčbu HF je deplece železa definována jako sérová koncentrace ferritinu nižší než 100 µg/l nebo hodnoty v rozmezí 100–299 µg/l, pokud je saturace transferinu (TSAT) nižší než 20 %. Guidelines také doporučují pátrat po přítomnosti ID u všech nemocných trpících HF a v případě jeho průkazu zvážit léčbu intravenózním železem, konkrétně karboxymaltózou železa (FCM), ve třídě doporučení IIa [3]. Dosavadní evidence říká, že léčba intravenózním železem vede ke zmírnění symptomů, zlepšení kvality života a funkční kapacity u pacientů se stabilním symptomatickým HF s ID. Navíc bylo prokázáno snížení rizika první hospitalizace pro zhoršení HF a zlepšení vrcholové spotřeby kyslíku při spiroergometrii u pacientů, kterým byla podána FCM [4–6].
Neúčinnost perorální suplementace železa u pacientů s HF doložila studie IRONOUT‑HF [7], naopak studie AFFIRM‑AHF prokázala u pacientů léčených FCM ve srovnání s placebem významné snížení počtu opakovaných hospitalizací pro HF po jeho akutní dekompenzaci [8]. Tato zjištění se odrazila v rozšíření indikace k podávání FCM v nejnovějších guidelines pro diagnostiku a léčbu HF z roku 2021 [3].
Dlouhodobější efekt léčby i.v. železem si dala za cíl zhodnotit studie IRONMAN, která ovšem nepoužívala železo ve formě FCM jako předchozí studie, ale podávána byla derizomaltóza železa.
Metodika
IRONMAN [9] byla prospektivní, randomizovaná, otevřená studie se zaslepeným hodnocením cílových ukazatelů, která probíhala v 70 nemocnicích ve Spojeném království. Studie se mohli účastnit nemocní s HF se sníženou ejekční frakcí levé komory < 45 % starší 18 let a sérovou koncentrací ferritinu nižší než 100 µg/l nebo TSAT nižší než 20 %. Nemocní museli mít anamnézu aktuální nebo nedávno prodělané (do 6 měsíců) hospitalizace pro HF nebo zvýšené plazmatické koncentrace natriuretických peptidů (N‑terminální frakce natriuretického peptidu B [NT‑proBNP] > 250 ng/l při sinusovém rytmu, popř. > 1 000 ng/l při fibrilaci síní; nebo natriuretického peptidu B [BNP] > 75 ng/l v případě sinusového rytmu, resp. > 300 ng/l při fibrilaci síní). Pacienti byli vyřazeni, pokud měli koncentrace ferritinu v séru vyšší než 400 µg/l nebo koncentrace hemoglobinu nižší než 90 g/l. Stejně tak byla vyřazovacím kritériem koncentrace hemoglobinu převyšující 140 g/l u mužů a 130 g/l u žen.
Pacienti, kteří splnili zařazovací kritéria a podepsali informovaný souhlas, byli randomizováni v poměru 1 : 1 do ramene se standardní léčbou HF a ramene s přidáním intravenózní léčby derizomaltózou železa. Dávka byla stanovena dle koncentrace hemoglobinu a tělesné hmotnosti. Primárním cílovým ukazatelem studie byla kombinace všech hospitalizací pro HF a kardiovaskulární mortalita. Hospitalizace pro HF musela trvat více než 24 hodin. Sekundární cílové ukazatele zahrnuly všechny hospitalizace pro HF, první hospitalizaci pro kardiovaskulární příčinu, kardiovaskulární úmrtí nebo první hospitalizaci pro HF, hodnocení kvality života pomocí Minnesotského dotazníku kvality života se srdečním selháním (MLHFQ) a standardizovaného dotazníku kvality života (EQ‑5D) ve 4. a 20. měsíci, celkovou mortalitu, všechny hospitalizace a řadu dalších parametrů, včetně šestiminutového testu chůzí (6MWT). Sledován byl samozřejmě také výskyt nežádoucích účinků.
Po zařazení do studie byla první kontrola naplánována za čtyři týdny a potom každé čtyři měsíce. Ve skupině nemocných randomizovaných do ramene aktivní léčby byla podávána opakovaná dávka derizomaltózy železa, pokud byla sérová koncentrace ferritinu nižší než 100 µg/l nebo pokud dosahovala hodnot do 400 µg/l při TSAT méně než 25 %. Z hlediska statistického hodnocení výsledků je zajímavé, že byla – podobně jako ve studii AFFIRM‑AHF – naplánována a provedena analýza citlivosti zohledňující covid‑19, která např. ve zmíněné studii AFFIRM‑AHF změnila (zvýšila) statistickou signifikanci výsledků. Důvodem pro tuto analýzu bylo snížení dostupnosti zdravotní péče v době covidové pandemie i změna chování pacientů, kteří se z obavy z infekce vyhýbali zdravotnickým zařízením.
Výsledky
Do studie bylo randomizováno celkem 1 137 nemocných, z nichž 569 bylo zařazeno do ramene se suplementací železa a 568 do ramene „běžné péče“. Obě skupiny se statisticky významně nelišily ve vstupních parametrech, střední věk byl 73 let, 74 % tvořili muži. Během hospitalizace pro HF bylo randomizováno 16 % nemocných, 18 % mělo anamnézu hospitalizace pro HF v posledním půlroce a 67 % nemocných představovali ambulantní pacienti zařazení na základě elevace natriuretických peptidů.
Z 569 nemocných randomizovaných k podání derizomaltózy železa jich 98 % dostalo alespoň jednu dávku, 40 % dvě dávky, 14 % tři dávky a 6 % čtyři dávky a více. Zajímavostí je, že ve skupině „běžné péče“ 17 % nemocných dostalo i.v. suplementaci železa (jinou než studijní), což pochopitelně mohlo ovlivnit rozdíl ve výsledcích obou skupin. Střední doba sledování byla 2,7 roku.
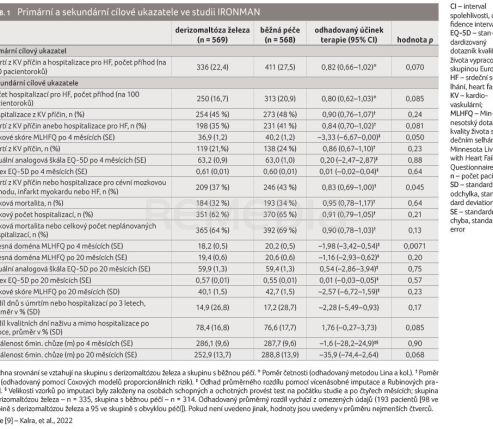 Ve skupině léčené derizomaltózou železa se vyskytl primární cílový ukazatel v 336 případech (22,4/100 pacientoroků), zatímco ve skupině „běžné péče“ to bylo 411 příhod (27,5/100 pacientoroků), což znamenalo koeficient relativního rizika 0,82 ([95% interval spolehlivosti [CI] 0,66–1,02]; p = 0,070). Při přepočtu dle kritérií analýzy citlivosti zohledňující covid‑19 se cílový ukazatel vyskytl v aktivně léčené skupině u 210 pacientů (tzn. 22,3/100 pacientoroků), ve skupině standardní léčby u 280 nemocných (29,3/100 pacientoroků), což znamenalo redukci relativního rizika o 24 % (p = 0,047). Další výsledky jsou přehledně shrnuty v tabulce 1 a graficky znázorněny v grafech 1A–D.
Ve skupině léčené derizomaltózou železa se vyskytl primární cílový ukazatel v 336 případech (22,4/100 pacientoroků), zatímco ve skupině „běžné péče“ to bylo 411 příhod (27,5/100 pacientoroků), což znamenalo koeficient relativního rizika 0,82 ([95% interval spolehlivosti [CI] 0,66–1,02]; p = 0,070). Při přepočtu dle kritérií analýzy citlivosti zohledňující covid‑19 se cílový ukazatel vyskytl v aktivně léčené skupině u 210 pacientů (tzn. 22,3/100 pacientoroků), ve skupině standardní léčby u 280 nemocných (29,3/100 pacientoroků), což znamenalo redukci relativního rizika o 24 % (p = 0,047). Další výsledky jsou přehledně shrnuty v tabulce 1 a graficky znázorněny v grafech 1A–D.
![GRAF 1A–D Odhadovaná střední frekvence a kumulativní incidence kardiovaskulárních výstupů studie IRONMAN; podle [9] – Kalra, et al., 2022. GRAF 1A–D Odhadovaná střední frekvence a kumulativní incidence kardiovaskulárních výstupů studie IRONMAN; podle [9] – Kalra, et al., 2022.](https://www.remedia.cz/photo-pg-1035---.jpg) Byla provedena také post hoc analýza po jednom roce follow‑up, což byla doba sledování použitá ve studii AFFIRM‑AHF, při které se přínos u skupiny léčené i.v. železem ještě zvýraznil (relativní riziko 0,66; p = 0,011).
Byla provedena také post hoc analýza po jednom roce follow‑up, což byla doba sledování použitá ve studii AFFIRM‑AHF, při které se přínos u skupiny léčené i.v. železem ještě zvýraznil (relativní riziko 0,66; p = 0,011).
Diskuse
IRONMAN byla první velkou randomizovanou studií hodnotící dlouhodobý efekt intravenózní suplementace deficitu železa derizomaltózou železa u pacientů s HF, sníženou ejekční frakcí levé komory srdeční a deficitem železa. Vedle pozitivního efektu na výskyt primárního cílového ukazatele složeného z kombinace hospitalizací pro srdeční selhání a kardiovaskulární mortality byla pozitivně ovlivněna i řada dalších hodnocených parametrů. V analýze celé studie nebylo dosaženo statistické významnosti, která se ale objevila při analýze citlivosti zohledňující covid‑19, kde byly výsledky zhodnoceny v den zahájení prvního lockdownu, který zásadně ovlivnil charakter péče o necovidové pacienty, včetně nemocných zařazených do klinických studií. Vedle omezení počtu hospitalizací pro HF kvůli zahlcení nemocnic pacienty s covidem‑19 a kvůli obavám nemocných navštívit během pandemie nemocnice došlo také k tomu, že v té době neprobíhaly studijní kontroly prezenčně, a nebylo tak možné opakované podávání železa u nemocných s perzistujícím deficitem železa, což pravděpodobně snížilo jak statistickou významnost, tak klinický přínos této léčby. Navíc 17 % nemocných ve větvi „běžné péče“ dostalo i.v. suplementaci železa jiným přípravkem, což opět zřejmě snížilo rozdíl mezi aktivně léčenou skupinou a skupinou s „běžnou péčí“. Dalším důležitým poselstvím této studie je potvrzení bezpečnosti i.v. terapie železem i při dlouhodobém sledování.
Výsledky studie IRONMAN jsou navíc konzistentní s výsledky studie AFFIRM‑AHF, což ukazuje na obdobný efekt obou forem i.v. železa. Dosavadní data zatím neprokázala ovlivnění celkové mortality, nicméně aktuálně probíhají další studie, které jednak rozšiřují zkoumání efektu substituce železa u nemocných s ejekční frakcí levé komory přesahující 45 %, jednak mají ambici zhodnotit mortalitní cílové ukazatele.
Závěr
Lze konstatovat, že u nemocných se srdečním selháním se sníženou ejekční frakcí levé komory a saturací transferinu nižší než 20 % nebo se sérovou koncentrací ferritinu nižší než 100 µg/l přinesla léčba derizomaltózou železa pokles výskytu primárního cílového ukazatele − hospitalizací pro srdeční selhání a kardiovaskulární mortality – zejména pokud byly zohledněny dopady pandemie covidu‑19 na charakter péče dle analýzy citlivosti zohledňující covid‑19. Výsledky studie IRONMAN tak přinesly další evidenci o přínosu i bezpečnosti intravenózní suplementace železa u pacientů se srdečním selháním a deficitem železa.
Literatura
[1] Martens P, Nijst P, Verbrugge FH, et al. Impact of iron deficiency on exercise capacity and outcome in heart failure with reduced, mid‑range and preserved ejection fraction. Acta Cardiol 2018; 73: 115–123.
[2] Jacob J, Miró Ò, Ferre C, et al. Iron deficiency and safety of ferric carboxymaltose in patients with acute heart failure. AHF‑ID study. Int J Clin Pract 2020; 74: e13584.
[3] McDonagh TA, Metra M, Adamo M, et al.; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42: 3599–3726.
[4] Anker SD, Comin Colet J, Filippatos G, et al.; FAIR‑HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009; 361: 2436–2448.
[5] Ponikowski P, van Veldhuisen DJ, Comin‑Colet J, et al. Beneficial effects of long‑term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency†. Eur Heart J 2015; 36: 657–668.
[6] van Veldhuisen DJ, Ponikowski P, van der Meer P, et al. Effect of Ferric Carboxymaltose on Exercise Capacity in Patients With Chronic Heart Failure and Iron Deficiency. Circulation 2017; 136: 1374–1383.
[7] Lewis GD, Malhotra R, Hernandez AF, et al. Effect of Oral Iron Repletion on Exercise Capacity in Patients With Heart Failure With Reduced Ejection Fraction and Iron Deficiency: The IRONOUT HF Randomized Clinical Trial. JAMA 2017; 317: 1958–1966.
[8] Ponikowski P, Kirwan BA, Anker SD, et al.; AFFIRM‑AHF investigators. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double‑blind, randomised, controlled trial. Lancet 2020; 396: 1895–1904.
[9] Kalra PR, Cleland JGF, Petrie MC, et al. Intravenous ferric derisomaltose in patients with heart failure and iron deficiency in the UK (IRONMAN): an investigator‑initiated, prospective, randomised, open‑label, blinded‑endpoint trial. Lancet 2022; 400: 2199–2209.