Studie MARIANNE – trastuzumab emtansin v první linii léčby lokálně pokročilého a metastazujícího karcinomu prsu s nadměrnou expresí HER2
Souhrn:
Preferovanou léčbou první linie u nemocných s HER2 pozitivním diseminovaným karcinomem prsu je v současné době pertuzumab plus trastuzumab v kombinaci s taxanem. Studie MARIANNE zkoumala jako prvá ze studií fáze III trastuzumab emtansin (T DM1) v první linii léčby HER2 pozitivního metasta-zujícího karcinomu prsu. Trastuzumab emtansin je konjugát protilátky trastuzumabu s vysoce účinnou cytotoxickou látkou, derivátem maytansinu. Ve studii fáze II prokázal T DM1 v monoterapii podávané v první linii léčby HER2 pozitivního lokálně pokročilého nebo metastazujícího karcinomu prsu srovnatelnou účinnost a příznivý profil toxicity ve srovnání s kombinací trastuzumab plus docetaxel. Kombinace T DM1 s pertuzumabem prokázala in vitro synergistické působení na inhibici proliferace nádorových buněk. Společně s předběžnými výsledky studie fáze II se toto zjištění stalo východiskem pro další klinický vý-zkum.
Key words: trastuzumab DM1 – pertuzumab – trastuzumab – HER2 – MARIANNE.
Summary:
Pertuzumab plus trastuzumab in combination with a taxane is a preferred option for first line treatment of patients with HER2 positive metastatic breast cancer at present. MARIANNE is the first phase III study to evaluate T DM1 (trastuzumab DM1) in first line treatment of HER2 positive metastatic breast cancer. T DM1 is a unique antibody drug conjugate composed of trastuzumab and the highly potent cytotoxic agent DM1 (derivate of maytansine). In a randomized phase II trial, single agent T DM1 had comparable efficacy to trastuzumab + docetaxel in the first line treatment of HER2 positive locally advanced or metastatic breast cancer. The combination of T DM1 and pertuzumab resulted in synergistic inhibition of tumor cell line proliferation in vitro. This and preliminary data from a phase II clinical trial provided the rationale for further study.
Úvod
Karcinom prsu je nejčastějším onkologickým onemocněním žen ve vyspělých zemích. Asi 15–20 % karcinomů prsu zvýšeně exprimuje receptor 2 pro lidský epidermální růstový faktor (human epidermal growth factor receptor 2, HER2). Jde o velice nepříznivou formu onemocnění charakterizovanou vysokým rizikem relapsu a horším celkovým přežitím [1]. V posledních letech bylo dosaženo zlepšení prognózy těchto pacientek cílenou anti‑HER2 terapií v rámci léčby časného i pokročilého onemocnění.
Dlouhou dobu byl standardní léčbou první linie HER2‑pozitivního lokálně pokročilého a metastazujícího onemocnění trastuzumab (rekombinantní humanizovaná monoklonální protilátka proti extracelulární doméně HER2) v kombinaci se synchronně působící chemoterapií taxany (paclitaxelem nebo docetaxelem) nebo s vinorelbinem [2,3]. Tento postup byl následně překonán posílením kombinace taxan + trastuzumab o pertuzumab [4]. Pertuzumab je rekombinantní humanizovaná protilátka bránící na ligandu závislé dimerizaci HER2, která se váže na jiný epitop extracelulární domény HER2 než trastuzumab. Účinek trastuzumabu a pertuzumabu je vzájemně komplementární a při společném podání mají tyto přípravky větší efekt, než když je každý z nich podán zvlášť.
Optimální léčba druhé linie pro pacientky s HER2‑pozitivním metastazujícím karcinomem prsu byla dlouho předmětem diskusí. Osvědčila se v ní kombinace trastuzumabu s jinou chemoterapií, kombinace lapatinibu (tyrosinkinázového inhibitoru intracelulární domény HER2) s chemoterapií capecitabinem [5]. V současnosti je upřednostňovanou léčbou druhé linie trastuzumab emtansin (T‑DM1), který prokázal u pacientek předléčených trastuzumabem superioritu ve srovnání s léčbou lapatinibem a capecitabinem v randomizované klinické studii EMILIA [6]. Trastuzumab emtansin prokázal svoji účinnost také ve třetí linii léčby HER2‑pozitivního metastazujícího karcinomu prsu (studie TH3RESA) [7].
Metodika studie
MARIANNE (NCT01120184; BO22589) byla randomizovaná multicentrická studie fáze III, která zkoumala účinnost T‑DM1 v monoterapii nebo v kombinaci s pertuzumabem v první linii léčby pacientek s pokročilým HER2‑pozitivním karcinomem prsu proti klasické léčbě trastuzumabem a taxanem [8]. Zařazeny mohly být pacientky s lokální progresí nebo s rekurencí onemocnění, u nichž nebyla vhodná resekce s kurativním záměrem, nebo nemocné s metastazujícím karcinomem prsu. Pacientky mohly být léčeny neoadjuvantní nebo adjuvantní chemoterapií, která obsahovala vinorelbin nebo taxan, ale tato léčba musela být ukončena minimálně 6 měsíců před randomizací. Předchozí podání trastuzumabu ![Obr. 1 Schéma studie MARIANNE; podle [8] – Ellis, et al., 2015. HER2 – receptor 2 pro lidský epidermální růstový faktor; i.v. – intravenózně; T-DM1 – trastuzumab emtansin](https://www.remedia.cz/photo-a-30385---.jpg) neoadjuvantně/adjuvantně bylo rovněž možné. Celkem 1 095 nemocných bylo po stratifikaci randomizováno do jednoho ze tří léčebných ramen, buď k podávání trastuzumabu a taxanu (docetaxel nebo paclitaxel), T‑DM1 a placeba nebo k podávání T‑DM1 a pertuzumabu. Dávky a intervaly aplikace léčiv jsou uvedeny na obr. 1.
neoadjuvantně/adjuvantně bylo rovněž možné. Celkem 1 095 nemocných bylo po stratifikaci randomizováno do jednoho ze tří léčebných ramen, buď k podávání trastuzumabu a taxanu (docetaxel nebo paclitaxel), T‑DM1 a placeba nebo k podávání T‑DM1 a pertuzumabu. Dávky a intervaly aplikace léčiv jsou uvedeny na obr. 1.
Stratifikace a cíle studie
Pacientky byly stratifikovány podle geografického regionu, podle předchozí neoadjuvantní/adjuvantní léčby, předchozího podání trastuzumabu/lapatinibu a podle přítomnosti viscerálního postižení. Primárním cílovým ukazatelem studie byla doba přežití bez progrese onemocnění (progression free survival, PFS) dle nezávislého hodnocení (non‑inferiorita, případně superiorita, za podmínky, že bude prokázána non‑inferiorita). Klíčovými sekundárními cílovými ukazateli studie bylo celkové přežití (overall survival, OS), PFS dle zkoušejících, četnost objektivních odpovědí (objective response rate, ORR) a bezpečnost léčby. První pacientka byla do studie zařazena v červenci 2010 a poslední pacientka v květnu 2012, data byla analyzována dne 16. 9. 2014, kdy byl medián sledování nemocných 35 měsíců. Primární výsledky studie byly prezentovány Paulem Ellisem na 51. konferenci American Society of Clinical Oncology (ASCO) v červnu 2015.
Vstupní charakteristiky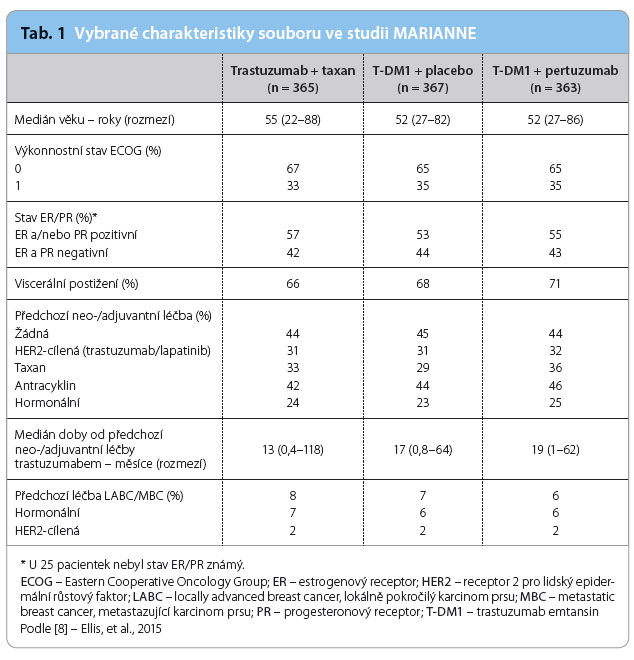
Všechna tři léčebná ramena byla dobře vyvážena. Viscerální postižení měly přibližně dvě třetiny nemocných a přibližně třetina pacientek byla předléčena neoadjuvantně nebo adjuvantně trastuzumabem. Přehled vybraných charakteristik souboru ukazuje tab. 1.
Výsledky
Při mediánu sledování 35 měsíců prokázaly oba režimy obsahující T‑DM1 non‑inferioritu, avšak neprokázaly superioritu proti standardní léčbě trastuzumabem a taxanem. Přidání pertuzumabu k T‑DM1 nepředstavovalo pro pacientky další přínos. Medián PFS byl 15,2 měsíce v rameni s léčbou kombinací T‑DM1 + pertuzumab (poměr rizik – hazard ratio – HR = 0,87; interval spolehlivosti – confidence interval – 95% CI: 0,69–1,08; p = 0,14), 14,1 měsíce v rameni s monoterapií T‑DM1 (HR = 0,91; 95% CI: 0,73–1,13; p = 0,31) ve srovnání s 13,7 měsíce v rameni s kombi![Graf 1 Nezávislé hodnocení doby přežití bez progrese ve studii MARIANNE; podle [8] – Ellis, et al., 2015. CI – interval spolehlivosti; HR – poměr rizik; PFS – doba přežití bez progrese onemocnění; T-DM1 – trastuzumab emtansin](https://www.remedia.cz/photo-a-30387---.jpg) novanou léčbou trastuzumabem a taxanem, graf 1. Zatím nejsou k dispozici data hodnotící celkové přežití. Četnost objektivních odpovědí představovala 64,2 % (pro rameno T‑DM1 + pertuzumab), 59,7 % (T‑DM1) a 67,9 % nemocných (trastuzumab + taxan). V ramenech, kde byl pacientkám podáván T‑DM1, byl pozorován delší medián doby trvání odpovědi (duration of response, DOR): 21,2 měsíce (15,8–29,3) při podávání kombinace T‑DM1 + pertuzumab, 20,7 měsíce (4,8–25,0) při podávání monoterapie T‑DM1 oproti 12,5 měsíce (10,5–16,6) při podávání kombinace trastuzumab + taxan.
novanou léčbou trastuzumabem a taxanem, graf 1. Zatím nejsou k dispozici data hodnotící celkové přežití. Četnost objektivních odpovědí představovala 64,2 % (pro rameno T‑DM1 + pertuzumab), 59,7 % (T‑DM1) a 67,9 % nemocných (trastuzumab + taxan). V ramenech, kde byl pacientkám podáván T‑DM1, byl pozorován delší medián doby trvání odpovědi (duration of response, DOR): 21,2 měsíce (15,8–29,3) při podávání kombinace T‑DM1 + pertuzumab, 20,7 měsíce (4,8–25,0) při podávání monoterapie T‑DM1 oproti 12,5 měsíce (10,5–16,6) při podávání kombinace trastuzumab + taxan.
Profil toxicity
Trastuzumab emtansin ve studiích opakovaně prokazuje příznivý profil toxicity a zachování kvality života. V ramenech s T‑DM1 byl zaznamenán nižší výskyt závažné neutropenie stupně 3 a 4, febrilní neutropenie, neuropatie, alopecie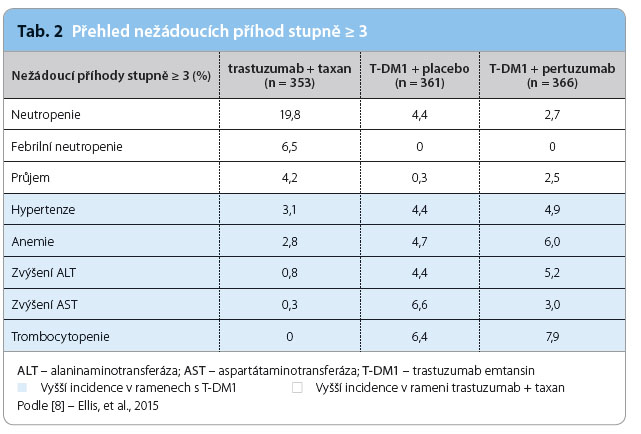 a průjmu. Při léčbě T‑DM1 se častěji vyskytla elevace hodnot transamináz a trombocytopenie. Kardiotoxicita jako nežádoucí účinek léčby (pokles ejekční frakce levé komory srdeční na hodnotu < 50 % nebo pokles o ≥ 15 % hodnoty před zahájením léčby) se vyskytla u 4,5 % pacientek v rameni s kombinací trastuzumab + taxan, u 0,8 % v rameni s monoterapií T‑DM1 a u 2,5 % nemocných v rameni s kombinací T‑DM1 + pertuzumab. Četnost výskytu toxicity závažného stupně 3 a 4 uvádí tab. 2.
a průjmu. Při léčbě T‑DM1 se častěji vyskytla elevace hodnot transamináz a trombocytopenie. Kardiotoxicita jako nežádoucí účinek léčby (pokles ejekční frakce levé komory srdeční na hodnotu < 50 % nebo pokles o ≥ 15 % hodnoty před zahájením léčby) se vyskytla u 4,5 % pacientek v rameni s kombinací trastuzumab + taxan, u 0,8 % v rameni s monoterapií T‑DM1 a u 2,5 % nemocných v rameni s kombinací T‑DM1 + pertuzumab. Četnost výskytu toxicity závažného stupně 3 a 4 uvádí tab. 2.
Diskuse
Standardem léčby první linie HER2‑pozitivního pokročilého onemocnění v době zahájení studie byla kombinace trastuzumabu s taxanem, opírající se o výsledky dvou velkých randomizovaných klinických studií fáze III [2,3]. Východisky pro uspořádání klinické studie MARIANNE se staly povzbudivé léčebné výsledky T‑DM1. Trastuzumab emtansin prokázal účinnost a bezpečnost v léčbě pacientek s HER2‑pozitivním metastazujícím karcinomem prsu předléčených trastuzumabem a taxanem (studie EMILIA) [6] a také povzbudivou účinnost u dříve neléčených pacientek s HER2‑pozitivním metastazujícím karcinomem prsu v randomizované studii fáze II [9]. V této studii publikované v Journal of Clinical Oncology Sarou Hurwitzovou v roce 2013 bylo v souboru 137 nemocných dosaženo mediánu PFS 9,2 měsíce při léčbě kombinací trastuzumab + docetaxel ve srovnání s 14,2 měsíce v rameni s monoterapií T‑DM1. Trastuzumab emtansin měl příznivý bezpečnostní profil, s méně častým výskytem závažných nežádoucích účinků vedoucích k přerušení léčby. Testování kombinace s pertuzumabem se opírá o cytotoxickou aktivitu prokázanou in vitro u nádorových buněčných linií a o zvýšenou protinádorovou aktivitu doloženou na xenograftovém modelu. Později byl ověřen přijatelný bezpečnostní profil s prokázanou aktivitou v klinické studii fáze Ib/II [10].
Aktuálně je již delší dobu standardem léčby první linie HER2‑pozitivního metastazujícímho karcinomu prsu kombinace docetaxel (případně paclitaxel) + trastuzumab + pertuzumab. Kombinace docetaxel + trastuzumab s pertuzumabem ve studii CLEOPATRA (n = 808) prodloužila PFS na 18,5 měsíce oproti 12,4 měsíce v rameni bez pertuzumabu [4]. Kombinace s pertuzumabem prokázala při finální analýze dat úctyhodné prodloužení OS na 56,5 měsíce ve srovnání se 40,8 měsíce v rameni bez pertuzumabu [11,12]. Neutropenie stupně 3 a 4 se vyskytla u 48,9 % nemocných, febrilní neutropenie u 13,8 %, průjem závažného stupně 3 a 4 u 7,9 % nemocných v rameni s pertuzumabem.
Určitou limitací výsledků studie je fakt, že pouze malá část souboru (n = 88) byla předléčena trastuzumabem v rámci adjuvance nebo neoadjuvance. Pertuzumab prokázal také u těchto nemocných svoji účinnost, avšak PFS byl kratší – 10,4 měsíce oproti 6,9 měsíce. V současnosti již soubor pacientek léčených ve studii CLEOPATRA nepředstavuje zcela typickou kohortu nemocných, s jakou se dnes setkáváme. Ve studii MARIANNE byla předléčenost pacientek trastuzumabem vyšší. Bylo by zajímavé zjistit, jakých výsledků by T‑DM1 dosáhl proti aktuálně standardní kombinaci taxan + trastuzumab + pertuzumab v první linii léčby u pacientek předléčených trastuzumabem v neoadjuvanci/adjuvanci při srovnání „face to face“.
Závěr
Výsledky studie MARIANNE nemění aktuálně platný standard léčby první linie HER2‑pozitivního diseminovaného karcinomu prsu. Tou zůstává pro většinu pacientek kombinace taxan + trastuzumab + pertuzumab. Trastuzumab emtansin zůstává preferovanou, dobře tolerovanou léčbou druhé linie, případně další linie léčby pacientek s HER2‑pozitivním onemocněním, pokud těmto nemocným dosud nebyl podáván.
Seznam použité literatury
- [1] Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER 2/neu oncogene. Science 1987; 235: 177–182.
- [2] Slamon DJ, Leyland Jones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001; 344: 783–792.
- [3] Marty M, Cognetti F, Maraninchi D, et al. Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2 positive metastatic breast cancer administered as first line treatment: The M77001 study group. J Clin Oncol 2005; 23: 4265–4274.
- [4] Baselga J, Cortés J, Kim SB, et al. Pertuzumab plus Trastuzumab plus Docetaxel for Metastatic Breast Cancer. N Engl J Med 2012; 366: 109–119.
- [5] Blackwell KL, Burstein HJ, Storniolo AM, et al. Overall survival benefit with lapatinib in combination with trastuzumab for patients with human epidermal growth factor receptor 2 positive metastatic breast cancer: final results from the EGF104900 study. J Clin Oncol 2012; 30: 2585–2592.
- [6] Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2 positive advanced breast cancer. N Engl J Med 2012; 367: 1783–1791.
- [7] Krop IE, Kim SB, Gonzáles Martín A, et al. Trastuzumab emtansine versus treatment of physician’s choice for pretreated HER2 positive advanced breast cancer (TH3RESA): a randomised, open label, phase 3 trial. Lancet Oncol 2014; 15: 689–699.
- [8] Ellis P, Barrios CH, Eiermann W, et al. Phase III, randomized study of trastuzumab emtansine ± pertuzumab vs trastuzumab + taxane for first line treatment of HER2 positive MBC: Primary results from the MARIANNE study. J Clin Ocol 2015; 33 (suppl.): Abstr. 507.
- [9] Hurwitz SA, Dirix L, Kocsis J, et al. Phase II Randomized Study of Trastuzumab Emtansine Versus Trastuzumab plus Docetaxel in Patients With Human Epidermal Growth Factor Receptor 2 Positive Metastatic Breast Cancer. J Clin Oncol 2013; 31: 1157–1163.
- [10] Miller KD, Dieras V, Harbeck N, et al. Phase IIa Trial of Trastuzumab Emtansine With Pertuzumab for Patients With Human Epidermal Growth Factor Receptor 2 Positive, Locally Advanced, or Metastatic Breast Cancer. J Clin Oncol 2014; 32: 1437–1443.
- [11] Swain SM, Kim SB, Cortés J, et al. Pertuzumab, trastuzumab, and docetaxel for HER2 positive metastatic breast cancer (CLEOPATRA study): overall survival results from a randomised, double blind, placebo controlled, phase 3 study. Lancet Oncol 2013; 14: 461–471.
- [12] Swain S, Kim SB, Cortes J, et al. Final overall survival analysis from the CLEOPATRA study of first line pertuzumab, trastuzumab, and docetaxel in patients with HER2 positive metastatic breast cancer. Paper presented at: ESMO 2014, European Society for Medical Oncology Annual Congress; September 26–30 2014; Madrid, Spa-in. Abstract 350O_PR.