Studie PATRICIA
Účinnost adjuvantní vakcíny HPV-16/18 AS04 proti cervikálním infekcím a prekanceróze způsobené onkogenními lidskými papilomaviry: finální analýza dvojitě slepé randomizované studie u mladých žen
Úvod
Účinnost adjuvantní vakcíny HPV-16/18 AS04 proti infekcím způsobeným lidskými papilomaviry HPV-16 a HPV-18 a proti souvisejícím prekancerózám již byla prokázána analýzou dat studie PATRICIA i dalšími klinickými studiemi. V této finální analýze jsou prezen-tována data z přibližně tříletého sledování. Studie hodnotila účinnost vakcíny v prevenci cervikálních intraepiteliálních neoplazií stupně 2 a výše (CIN2+) spojených s přítomností genotypů HPV-16 a HPV-18, dále účinnost proti CIN3+ lézím a perzistentním infekcím a také zkříženou protektivitu proti genotypům HPV, které nejsou ve vakcíně obsaženy. Studie je zajímavá zejména tím, že sledovaný soubor žen ve věku 15–25 let zahrnoval jak ženy s prokázanou předchozí nebo akutní infekcí některým typem HPV, tak ženy s HPV negativitou pro 14 onkogenních genotypů HPV (dle stanovení DNA a sérologicky). Ty prezentují dívky před zahájením sexuálního života, jde tedy o skupinu, na kterou je primárně cíleno očkování v rámci vakcinačních programů. Studie probíhala ve 135 centrech ve 14 zemích a celkem bylo zařazeno 18 644 žen (z toho 17 106 žen, tj. 92 %, dostalo všechny tři dávky zkoušené HPV vakcíny). Ženy byly randomizovány v poměru 1 : 1 k očkování třemi dávkami adjuvantní vakcíny HPV-16/18 AS04 (n = 9319) nebo třemi dávkami kontrolní vakcíny proti hepatitidě A (n = 9325) ve stejném schématu 0, 1 a 6 měsíců. Zkoušená vakcína je vyrobena na principu rekombinantní DNA technologie a obsahuje L1 protein onkogenních HPV typů 16 a 18 ve formě neinfekčních, viru podobných částic (VLP, virus-like particles) adjuvovaný na AS04 (3-O-deacyl-4'-monofosforyl-lipid A) a vše je adsorbováno na hydratovaný hydroxid hlinitý.
Cíl studie
Primárním cílem studie bylo zhodnotit účinnost adjuvantní HPV vakcíny proti CIN2+ spojeným s výskytem HPV-16 nebo HPV-18 u žen, které byly při vstupu do studie séronegativní a HPV DNA negativní v měsících 0 a 6. Tato analýza měla odhadnout profylaktickou účinnost vakcíny u žen, které nebyly před očkováním infikovány HPV typy obsaženými ve vakcíně. Sekundární cíle zahrnovaly sledování účinnosti vakcíny a) proti perzistentním HPV infekcím způsobeným HPV-16 a HPV-18 nebo jinými typy HPV, b) proti CIN souvisejícím s přítomností HPV-16, HPV-18 nebo s jinými onkogenními typy HPV, c) proti CIN bez ohledu na typ DNA HPV v lézi a sledování snížení počtu kolposkopií a dalších procedur u žen. Samozřejmě byla hodnocena také imunogenita a bezpečnost vakcíny. Každých 6 měsíců byly odebrány vzorky na analýzu HPV DNA a každých 12 měsíců ženy podstoupily gynekologické a cytologické vyšetření. Dále byla v předepsaných intervalech odebírána krev a metodou ELISA stanoveno množství protilátek proti HPV-16 a HPV-18.
Metodika
Sledované cíle byly hodnoceny v celé skupině žen tzv. total vaccinated cohort (TVC). Ta zahrnovala všechny ženy bez ohledu na HPV pozitivitu či negativitu při vstupu do studie, které byly očkovány alespoň jednou dávkou vakcíny a jejichž cytologický nález při úvodním vyšetření byl normální nebo nízkého stupně (skupina s HVP-16/18 AS04 n = 9319; kontrolní skupina n = 9325). Tato skupina odpovídá obecné populaci. Dále byla provedena tzv. according-to-protocol analýza efektivity (ATP-E) u žen, které dle protokolu obdržely všechny tři dávky vakcíny a měly normální cytologický nález nebo nález nízkého stupně při úvodním vyšetření (skupina s HVP-16/18 AS04 n = 8093; kontrolní skupina n = 8069). Třetí analyzovanou podskupinou, jak už bylo zmíněno, byly „HPV naivní“ ženy, tzv. total vaccinated naive cohort (TVC-naive). Kritériem pro vstup do kohorty „HPV naivních“ bylo očkování alespoň jednou dávkou vakcíny, normální výsledek cytologického stěru, DNA negativita vůči všem 14 genotypům HPV a séronegativita pro HPV-16 a HPV-18 (skupina očkovaná HVP-16/18 AS04 n = 5822; kontrolní skupina n = 5819). Tím měla tato skupina reprezentovat dívky před zahájením sexuálního života. Závěrečná analýza dat byla provedena po potvrzení 36 případů CIN2+ spojených s průkazem HPV-16/18 ve skupině ATP-E. Celková doba sledování subjektů ve studii v době analýzy dosahovala 34,9 měsíce (SD 6,4) ve skupině ATP-E (počítáno od očkování třetí dávkou vakcíny) a 39,4 měsíce (SD 9,5) ve skupině TVC-naive.
Výsledky
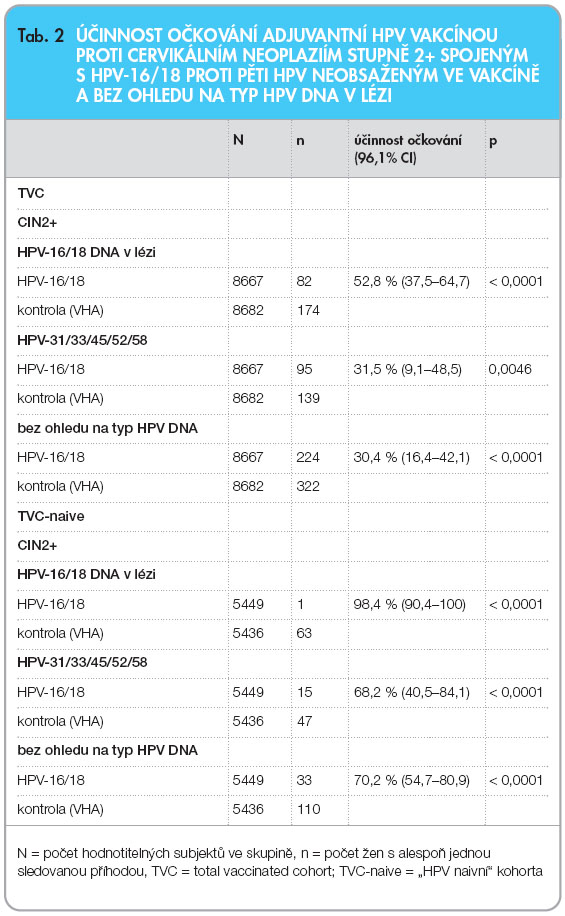
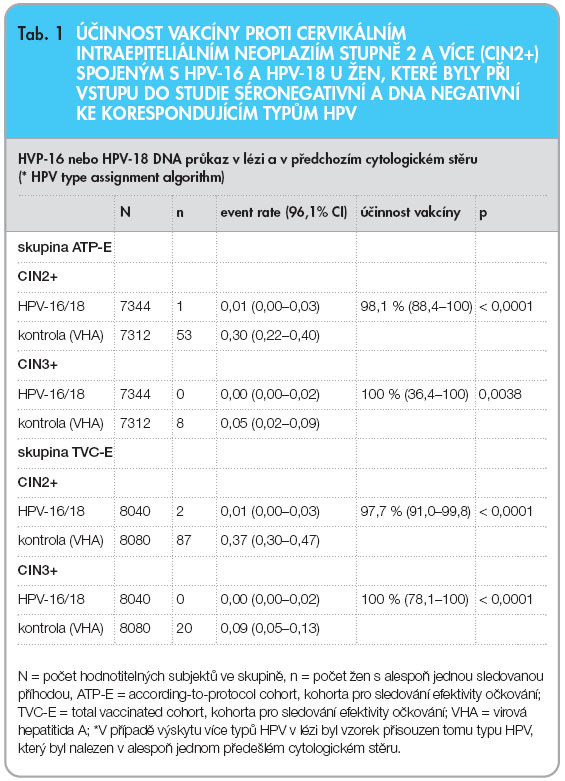 Ve studii byla prokázána vysoká účinnost vakcíny proti CIN2+ související s výskytem HPV-16 nebo HPV-18 jak ve skupině ATP-E, tak u žen ze skupiny TVC-E (tab. 1). Společně proti oběma typům, HPV-16 a HPV-18, dosahovala účinnost vakcíny 98,1 % (96,1% CI 88,4–100; p < 0,0001), proti HPV-16 byla účinnost 100,0 % (91,0–100; p < 0,0001) a proti HPV-18 dosahovala účinnost 92,3 % (45,7–99,9; p = 0,0009). Z celkového počtu 60 diagnostikovaných cervikálních neoplazií stupně 2 a výše s prokázanou přítomností DNA genotypů 16 a 18 ve skupině ATP-E jich 12 dosahovalo stupně CIN3+, z toho 2 případy v očkované skupině a 10 případů v kontrolní skupině. Účinnost vakcíny proti CIN2+ bez ohledu na HPV DNA v lézi v celé kohortě představovala 30,4 % (16,4–42,1) a ve skupině „HPV naivních“ 70,2 % (54,7–80,9), viz tab. 2. Podobně účinnost proti CIN3+ v těchto skupinách dosahovala 33,4 % (9,1–51,5) a 87,0 % (54,9–97,7).
Ve studii byla prokázána vysoká účinnost vakcíny proti CIN2+ související s výskytem HPV-16 nebo HPV-18 jak ve skupině ATP-E, tak u žen ze skupiny TVC-E (tab. 1). Společně proti oběma typům, HPV-16 a HPV-18, dosahovala účinnost vakcíny 98,1 % (96,1% CI 88,4–100; p < 0,0001), proti HPV-16 byla účinnost 100,0 % (91,0–100; p < 0,0001) a proti HPV-18 dosahovala účinnost 92,3 % (45,7–99,9; p = 0,0009). Z celkového počtu 60 diagnostikovaných cervikálních neoplazií stupně 2 a výše s prokázanou přítomností DNA genotypů 16 a 18 ve skupině ATP-E jich 12 dosahovalo stupně CIN3+, z toho 2 případy v očkované skupině a 10 případů v kontrolní skupině. Účinnost vakcíny proti CIN2+ bez ohledu na HPV DNA v lézi v celé kohortě představovala 30,4 % (16,4–42,1) a ve skupině „HPV naivních“ 70,2 % (54,7–80,9), viz tab. 2. Podobně účinnost proti CIN3+ v těchto skupinách dosahovala 33,4 % (9,1–51,5) a 87,0 % (54,9–97,7).
Studie prokázala vysokou účinnost vakcíny proti šestiměsíčním a dvanáctiměsíčním perzistentním HPV-16/18 infekcím, a to 93,8 % a 91,2 %. Určitý efekt vakcíny byl pozorován i u žen, které byly při vstupu do studie DNA pozitivní ke korespondujícím HPV typům a séronegativní. U žen, které byly DNA pozitivní a séropozitivní, protektivní účinek prokázán nebyl.
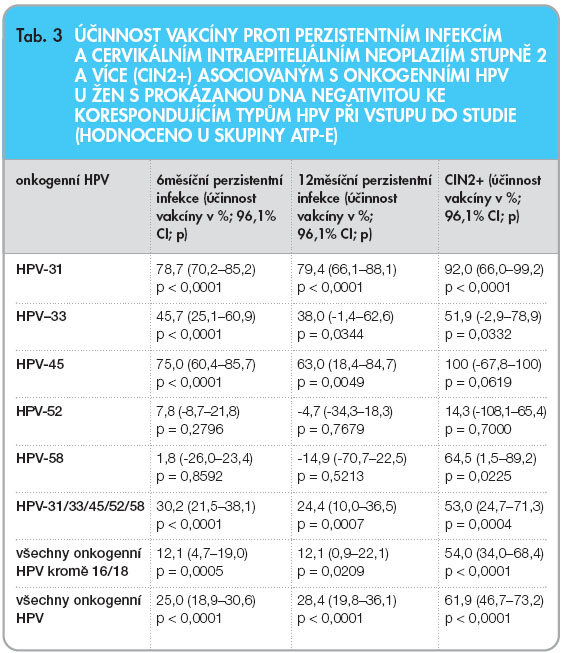 Dále byla sledována zkřížená protektivita vakcíny proti typům papilomavirů, které nejsou ve vakcíně obsaženy. Ve všech sledovaných skupinách byla prokázána protektivita proti perzistentním HPV infekcím a CIN2+ lézím asociovaným s HPV-31 (tab. 3). Podobně tomu bylo u dalších příbuzných genotypů HPV-45 a HPV-33. Účinnost vakcíny proti CIN2+ lézím asociovaným s výskytem 5 nejčastějších onkogenních HPV neobsažených ve vakcíně (tj. 31, 33, 45, 52 a 58) přesahovala 50 % a proti CIN2+ spojeným se všemi 14 onkogenními HPV genotypy dosahovala účinnost vakcíny více než 60 % (tab. 3).
Dále byla sledována zkřížená protektivita vakcíny proti typům papilomavirů, které nejsou ve vakcíně obsaženy. Ve všech sledovaných skupinách byla prokázána protektivita proti perzistentním HPV infekcím a CIN2+ lézím asociovaným s HPV-31 (tab. 3). Podobně tomu bylo u dalších příbuzných genotypů HPV-45 a HPV-33. Účinnost vakcíny proti CIN2+ lézím asociovaným s výskytem 5 nejčastějších onkogenních HPV neobsažených ve vakcíně (tj. 31, 33, 45, 52 a 58) přesahovala 50 % a proti CIN2+ spojeným se všemi 14 onkogenními HPV genotypy dosahovala účinnost vakcíny více než 60 % (tab. 3).
Výskyt nežádoucích reakcí byl srovnatelný s kontrolní skupinou. V podskupině pro hodnocení imunogenity byla hladina protilátek proti oběma vakcinačním typům detekována v 7. měsíci u 99,5 % žen a v 36. měsíci u 100 % žen. Hladiny protilátek dosahovaly maxima okolo 7. měsíce a mezi 12. a 24. měsícem klesly do fáze plató. Výsledky ukázaly, že vakcína je schopna navodit vysokou ochranu proti CIN2+ a perzistentním HPV infekcím. Studie přináší hodnotné výsledky i tím, že se nejednalo o preselektovanou populaci, ale byly zahrnuty i ženy s přítomnými onkogenními typy HPV, ženy séropozitivní, jakož i ženy s cytologickými abnormalitami nízkého stupně při vstupu do studie.
Účinnost vakcíny byla nejvyšší proti HPV genotypům 16 a 18. Byla však prokázána i poměrně vysoká zkřížená protektivita proti dalším onkogenním typům HPV. Bez ohledu na typ DNA HPV byla v celé skupině (TVC) účinnost proti CIN2+ 30 % a proti CIN3+ 33 %. Sledovaná účinnost v celé skupině zahrnující i ženy s prevalentní infekcí napovídá o efektivitě případné catch-up imunizace touto vakcínou. V mnoha odebraných vzorcích byla prokázána přítomnost několika typů papilomavirů. Více než polovina vzorků s prokázanou přítomností HPV typů 16/18 obsahovala i DNA dalších papilomavirů neobsažených ve vakcíně. To přinejmenším komplikuje analýzu a vyvození závěrů o protektivitě vakcíny proti jednotlivým typům HPV. Proto byla provedena i řada analýz post-hoc k upřesnění účinnosti vakcíny proti různým HPV. Odhadovaná účinnost vakcíny proti onkogenním HPV neobsaženým ve vakcíně se pak pohybovala mezi 37–54 %. Typy papilomavirů obsažené ve vakcíně jsou zodpovědné za více než 70 % případů karcinomu děložního hrdla. Pět nejčastějších onkogenních genotypů HPV (16, 18, 31, 33, 45) pak zodpovídá za 82 % případů cervikálních nádorů. Významný přínos očkování pro snížení incidence karcinomu děložního hrdla a prekanceróz je nepochybný. Nadále je samozřejmě nutné provádět organizovaný screening. Z dosavadních výsledků je také zřejmé, že vakcína nevyléčí již probíhající infekci.
Literatura
Komentář ke studii PATRICIA
Profylaktická vakcinace proti lidským papilomavirům se již etablovala v klinické praxi. Volba konkrétního preparátu vychází z celé řady faktorů, z nichž k nejdůležitějším patří přání klientky a doporučení vakcinují-cího lékaře. Lékař měl dosud možnost validně posoudit data týkající se imunogenity a bezpečnosti obou dostupných preparátů, data týkající se účinnosti byla v komplexní šíři prezentována pouze u kvadrivalentní vakcíny [1, 2]. U bivalentní vakcíny byly dostupné závěry klinických studií ukazující na vysokou účinnost vakcinace proti aktuální a perzistentní HPV infekci a účinnost proti dysplaziím děložního hrdla asociovaným s vakcinačními genotypy u selektované „HPV naivní“ populace [3]. Klinická data o účinnosti v široké populaci byla dosud uveřejněna jen v předběžné analýze středně dlouhé doby sledování (14,8 měsíce) studie PATRICIA [4].
Prezentovaná finální analýza uvedené studie, publikovaná v závěru roku 2009, byla primárně zaměřena na zhodnocení klinických dat v otázce účinnosti, zejména posouzení rozsahu ochrany proti onkologicky signifikantním lézím dolního genitálního traktu (vulvy, vaginy a děložního hrdla). Věková struktura sledované populace neumožnila kvůli minimální incidenci vulvárních a vaginálních lézí v testované kohortě dívek a mladých žen dosáhnout statistické signifikance při posouzení jejich protekce, a proto bylo hodnocení logicky zaměřeno na nejvýznamnější a nejčastější HPV asociované změny – dlaždicobuněčné (CIN – cervikální intraepiteliální neoplazie) a žlázové (AIS – adenokarcinom in situ) dysplazie děložního hrdla.
Analýza přináší hned několik úrovní klinicky důležitých dat. Nejvýznamnější informací je potvrzení absolutní protektivní účinnosti proti high-grade cervikálním lézím asociovaným s vakcinačními genotypy HPV. Neméně podstatnou informací je průkaz signifikantní ochrany vůči lézím způsobeným i některými fylogeneticky příbuznými genotypy HPV (31, 33, 45, 52) [5]. Data dokládající vysokou úroveň zkřížené protekce mohou představovat další z faktorů odlišujících obě dostupné vakcíny [6].
V široké populaci (TVC), která je nejbližší kohortě dívek a žen v gynekologických ambulancích, ukazují výsledky na výrazné snížení efektivity v důsledku značného zastoupení prevalentní a perzistentní HPV infekce a vzestupu incidence prekanceróz. Informace o snížení efektivity sice nelimituje význam případné catch-up imunizace, ale akcentuje potřebu primárního zacílení vakcinace na věkovou kohortu velmi mladých dívek. Zajímavá jsou také epidemiologická data vyplývající ze studie, neboť ukazují vysokou frekvenci vícečetné HPV infekce. Ta vedla při analýze účinnosti k nutnosti retrospektivního stanovení kauzality mezi perzistencí konkrétního genotypu HPV a následně biopticky verifikované prekancerózy. Na druhou stranu také dokládají přetrvávající potřebu screeningových kontrol i ve vakcinované populaci, která je vystavena riziku působení dalších onkogenních genotypů HPV.
Seznam použité literatury
- [1] Villa LL, Costa RL, Petta CA, et al. High sustained efficacy of a pro-phylactic quadrivalent human papillomavirus types 6/11/16/ 8 L1 virus-like particle vaccine through 5 years of follow-up. Br J Cancer 2006; 95: 1459–1466.
- [2] Einstein MH, Baron M, Levin MJ, et al. Comparison of the immunogenicity and safety of Cervarix and Gardasil human papillomavirus (HPV) cervical cancer vaccines in healthy women aged 18–45 years. Hum Vaccin 2009; 5: 705–719.
- [3] Harper DM, Franco EL, Wheeler CM, et al. Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from randomised control trial. Lancet 2006; 367: 1247–1255.
- [4] Paavonen J, Jenkins D, Bosch FX, et al. Efficacy of a prophylactic adjuvanted bivalent L1 virus-like-particle vaccine against infection with human papillomavirus types 16 and 18 in young women: an interim analysis of a phase III double-blind, randomised controlled trial. Lancet 2007; 369: 2161–2070.
- [5] Paavonen J, Naud P, Salmerón J, et al. Efficacy of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by oncogenic HPV types (PATRICIA): final analysis of a double-blind, randomised study in young women. Lancet 2009; 374: 301–314.
- [6] Brown DR, Kjaer SK, Sigurdsson K, et al. The impact of quadrivalent human papillomavirus (HPV; types 6, 11, 16, and 18) L1 virus-like particle vaccine on infection and disease due to oncogenic non-vaccine HPV types in generally HPV-naive women aged 16–26 years. J Infect Dis 2009; 199: 926–935.