Studie PREVAIL – enzalutamid v léčbě metastatického kastračně rezistentního karcinomu prostaty
Souhrn:
V posledních letech se významně zvyšuje prevalence i pokročilých zhoubných nádorů prostaty. Léčbou volby metastazujícího karcinomu prostaty je hormonální léčba. V průběhu léčby však dochází k jejímu selhání a nádor přechází do kastračně rezistentního stadia onemocnění. Od začátku tisíciletí se objevují nové léčivé přípravky vhodné pro léčbu kastračně rezistentního karcinomu prostaty (CRPC), stejně tak se vyvíjí i pohled na jejich zařazení do algoritmu léčby. Novou možností pro léčbu chemonaivních pacientů se na základě závěrů studie PREVAIL stal enzalutamid, hormonální přípravek nové generace.
Key words: castrate resistant prostate cancer, CRPC, enzalutamide, PREVAIL study.
Summary:
In recent years, we have seen a significantly increasing prevalence of prostate cancer including its advanced stages. The treatment of choice for metastatic prostate cancer is hormone therapy. However, this therapy fails eventually and the tumour progresses into the castrate resistant disease stage. Since the beginning of the millennium, there are new medicines suitable for the treatment of castrate resistant prostate cancer (CRPC). The view concerning their inclusion in the treatment algorithm develops as well. A new option for the treatment of chemotherapy naive patients according to the findings of the PREVAIL study could be enzalutamide, hormonal preparation of the new generation.
Úvod
Zhoubné nádory prostaty mají v populaci mužů v České republice vysokou prevalenci (karcinomem prostaty trpí 56 245 mužů). Zvyšující se prevalenci karcinomu prostaty zaznamenáváme i u pokročilých stadií onemocnění. Mezi nemocnými je 5 600 mužů s metastazujícím onemocněním. Data předkládaná Národním onkologickým registrem (NOR) bohužel neinformují o prevalenci kastračně rezistentního karcinomu, tedy stadiu, kdy při kastračních hladinách testosteronu dochází k progresi nádorových markerů a ke vzniku či rozvoji metastatického postižení. Počet takto nemocných se odhaduje zhruba na 800. Onemocnění je spojeno s poměrně rychlou progresí a nepříznivou prognózou. Větší část takto nemocných je v současné době léčena podáváním kombinace docetaxelu s prednisonem. Tento terapeutický režim byl od roku 2004 považován za léčebný standard.
V posledních letech se náhled na léčbu první linie mění. Prvním přípravkem schváleným pro léčbu před aplikací docetaxelu byl sipuleucel-T [1]. Imunoterapie pomocí aktivovaných dendritických buněk je schválena pro asymptomatické pacienty s mCRPC (metastatic castration resistant prostate cancer, metastatický kastračně rezistentní karcinom prostaty). Evropská léková agentura schválila podání sipuleucelu-T v této indikaci v roce 2013. Dalším přípravkem s možným podáním v první linii je abirateron acetát, který je vhodný pro léčbu nemocných s minimálními symptomy [2]. Nejnověji jsou k dispozici výstupy studie PREVAIL s použitím enzalutamidu u chemonaivních asymptomatických či mírně symptomatických pacientů.
Enzalutamid představuje hormonální přípravek nové generace, který blokuje androgenní signální cestu. Vedle inhibice vazby androgenu na androgenní receptor je tlumena i jaderná translokace a vazba androgenního receptoru na jadernou DNA. Proti klasickým antiandrogenům se enzalutamid váže k androgennímu receptoru až s osminásobnou afinitou. U pacientů předléčených docetaxelem byla účinnost doložena ve studii AFFIRM [3].
Zařazení do studie PREVAIL
Pacienti zařazení do studie PREVAIL (NTC01212991) byli ve III. fázi klinického zkoušení randomizováni v poměru 1 : 1 mezi aktivní rameno s enzalutamidem (n = 872) a srovnávací rameno s placebem (n = 845). Chemonaivní (bez předchozí chemoterapie), asymptomat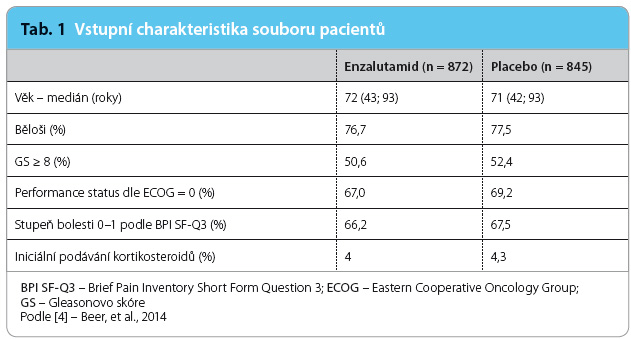 ičtí nebo minimálně symptomatičtí muži s progredujícím mCRPC užívali v aktivním rameni enzalutamid v dávce 160 mg pro die. Užívání kortikosteroidů bylo povoleno, ale nebylo vyžadováno. Primárním cílem studie bylo stanovení doby celkového přežití (overall survival, OS) a doby do radiografické progrese onemocnění (radiographic progression free survival, rPFS).
ičtí nebo minimálně symptomatičtí muži s progredujícím mCRPC užívali v aktivním rameni enzalutamid v dávce 160 mg pro die. Užívání kortikosteroidů bylo povoleno, ale nebylo vyžadováno. Primárním cílem studie bylo stanovení doby celkového přežití (overall survival, OS) a doby do radiografické progrese onemocnění (radiographic progression free survival, rPFS).
Sk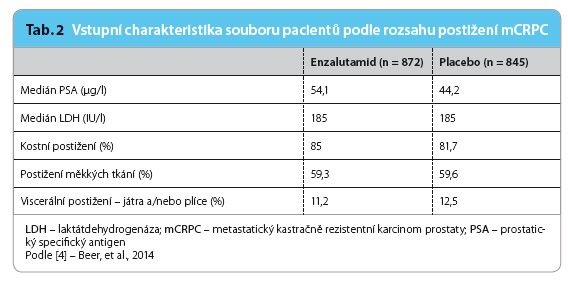 upiny s enzalutamidem a placebem byly prakticky srovnatelné v základních charakteristikách, jako je věk, rasa, celková fyzická zdatnost (hodnoceno podle škály Eastern Cooperative Oncology Group – ECOG performance status) a skóre bolesti (BPI, Brief Pain Inventory), ale i Gleasonovo skóre nádoru v době diagnózy (tab. 1). Charakteristiky pacientů při srovnání rozsahu onemocnění byly v obou skupinách rovněž vyvážené (tab. 2).
upiny s enzalutamidem a placebem byly prakticky srovnatelné v základních charakteristikách, jako je věk, rasa, celková fyzická zdatnost (hodnoceno podle škály Eastern Cooperative Oncology Group – ECOG performance status) a skóre bolesti (BPI, Brief Pain Inventory), ale i Gleasonovo skóre nádoru v době diagnózy (tab. 1). Charakteristiky pacientů při srovnání rozsahu onemocnění byly v obou skupinách rovněž vyvážené (tab. 2).
Výsledky studie PREVAIL
První závěry studie PREVAIL byly zveřejněny na Genitourinary Cancers Symposium American Society of Clinical Oncology (ASCO) 2014 [4]. Medián trvání léčby byl u pacientů léčených enzalutamidem oproti pacientům, kteří užívali placebo, ![Graf 1 Celkové přežití pacientů ve studii PREVAIL; podle [5] – Beer, et al., 2014. Enzalutamid snížil riziko úmrtí o 29 %. OS – celkové přežití; CI – interval spolehlivosti; HR – poměr rizik; NYR – nebylo dosaženo](https://www.remedia.cz/photo-a-30083---.jpg) více než trojnásobný (16,6 měsíce vs. 4,6 měsíce). U 67,9 % pacientů bylo podávání enzalutamidu delší než 12 měsíců. U pacientů ze skupiny s placebem trvalo podávání déle než 12 měsíců pouze v 18 % případů. Medián sledování byl srovnatelný v obou skupinách (22,2 vs. 22,4 měsíce). Enzalutamid snižuje riziko úmrtí o 29 % (poměr rizik – HR = 0,706; 95% interval spolehlivosti, CI: 0,60–0,84; p < 0,0001), graf 1. Vliv na OS je oproti placebu prokazatelný napříč všemi podskupinami pacientů, u nemocných s viscerálními metastázami (hepatálními a/nebo plicními) není vliv enzalutamidu na OS jednoznačný, snad vzhledem k jejich nízkému počtu.
více než trojnásobný (16,6 měsíce vs. 4,6 měsíce). U 67,9 % pacientů bylo podávání enzalutamidu delší než 12 měsíců. U pacientů ze skupiny s placebem trvalo podávání déle než 12 měsíců pouze v 18 % případů. Medián sledování byl srovnatelný v obou skupinách (22,2 vs. 22,4 měsíce). Enzalutamid snižuje riziko úmrtí o 29 % (poměr rizik – HR = 0,706; 95% interval spolehlivosti, CI: 0,60–0,84; p < 0,0001), graf 1. Vliv na OS je oproti placebu prokazatelný napříč všemi podskupinami pacientů, u nemocných s viscerálními metastázami (hepatálními a/nebo plicními) není vliv enzalutamidu na OS jednoznačný, snad vzhledem k jejich nízkému počtu.
Podání enzalutamidu signifikantně prodluž![Graf 2 Prodloužení doby do radiografi cké progrese onemocnění ve studii PREVAIL; podle [5] – Beer, et al., 2014. CI – interval spolehlivosti; HR – poměr rizik; NYR – nebylo dosaženo; rPFS – doba do progrese onemocnění podle radiografi ckého vyšetření](https://www.remedia.cz/photo-a-30084---.jpg) uje rPFS, graf 2 (HR = 0,186; 95 % CI: 0,15– 0,23; p < 0,0001). K prodloužení dochází u všech sledovaných podskupin pacientů, včetně pacientů s viscerálními metastázami. U 59 % pacientů s postižením měkkých tkání je prokázána objektivní odpověď podle kritérií RECIST 1.1 proti 5 % ve skupině s placebem (p < 0,0001). Odpověď hodnocená podle poklesu hodnoty prostatického specifického antigenu (PSA) byla zaznamenána u signifikantně většího počtu pacientů po podání enzalutamidu. Pokles o více než 90 % ve srovnání s výchozí koncentrací PSA byl zaznamenán u 46,8 % pacientů při léčbě enzalutamidem, zatímco při podávání placeba pouze u 1,2 % pacientů.
uje rPFS, graf 2 (HR = 0,186; 95 % CI: 0,15– 0,23; p < 0,0001). K prodloužení dochází u všech sledovaných podskupin pacientů, včetně pacientů s viscerálními metastázami. U 59 % pacientů s postižením měkkých tkání je prokázána objektivní odpověď podle kritérií RECIST 1.1 proti 5 % ve skupině s placebem (p < 0,0001). Odpověď hodnocená podle poklesu hodnoty prostatického specifického antigenu (PSA) byla zaznamenána u signifikantně většího počtu pacientů po podání enzalutamidu. Pokles o více než 90 % ve srovnání s výchozí koncentrací PSA byl zaznamenán u 46,8 % pacientů při léčbě enzalutamidem, zatímco při podávání placeba pouze u 1,2 % pacientů.
Podání enzalutamidu chemonaivním pacientům rovněž oddaluje čas do podání chemoterapie o 17 měsíců (graf 3). Nežádoucí účinky léčby enzalutamidem a jejich výskyt byly v ramenech s enzalutamidem i placebem prakticky srovnatelné. Kř![Graf 3 Prodloužení doby do podání chemoterapie ve studii PREVAIL; podle [5] – Beer, et al., 2014. Medián doby do zahájení chemoterapie v důsledku progrese onemocnění byl u pacientů léčených enzalutamidem 28,0 měsíce, u pacientů, jimž bylo podáváno placebo, 10,8 měsíce. Enzalutamid oddaluje čas do podání chemoterapie o 17 měsíců. CI – interval spolehlivosti; HR – poměr rizik](https://www.remedia.cz/photo-a-30085---.jpg) ečové stavy popsané ve studii AFFIRM nebyly ve studii PREVAIL zaznamenány. K nejčastějším nežádoucím účinkům patří nechutenství, bolesti v zádech, kardiovaskulární obtíže a hypertenze. Ve výskytu toxicity G3 nebyl při podávání enzalutamidu oproti placebu zaznamenán žádný rozdíl.
ečové stavy popsané ve studii AFFIRM nebyly ve studii PREVAIL zaznamenány. K nejčastějším nežádoucím účinkům patří nechutenství, bolesti v zádech, kardiovaskulární obtíže a hypertenze. Ve výskytu toxicity G3 nebyl při podávání enzalutamidu oproti placebu zaznamenán žádný rozdíl.
Závěr
Výsledky studie PREVAIL dokládají, že podávání enzalutamidu snižuje riziko úmrtí na mCRPC ve srovnání s placebem, signifikantně prodlužuje rPFS, oddaluje nutnost podání chemoterapie a zlepšuje kvalitu života nemocných.
Výstupy studie PREVAIL umožnily dál rozšířit terapeutické možnosti pro chemonaivní pacienty s mCRPC. Enzalutamid je regulační agenturou schválen k použití v této indikaci od prosince 2014 [6]. Další molekula by tedy mohla být použita u chemonaivních pacientů. Přímé srovnání imunoterapie a hormonální léčby mCRPC ani srovnání mezi samotnými hormonálními přípravky abirateronem a enzalutamidem nebylo provedeno.
Při stanovení léčby, jejího časování a eventuální sekvence bychom měli vycházet nejen z dostupnosti jednotlivých přípravků, ale především z faktorů umožňujících předvídat odpověď na podávání daného přípravku a na léčebný režim. Tento postup by měl vycházet z rozhodnutí multidisciplinárního týmu, který všechna dostupná data podle evidence based medicine bude korelovat s nálezy u muže s tak závažným onemocněním, jakým je mCRPC. Tak bychom mohli docílit maximálně individualizované léčby pro konkrétního pacienta.
Seznam použité literatury
- [1] Kantoff PW, Gitano CS, Shore ND, et al. Sipuleucel T Immunotherapy for Castration Resistant Prostate Cancer. N Engl J Med 2010; 363: 411–422.
- [2] Rathkopf DE, Smith MR, De Bono JS, et al. Updated interim analysis of COU AA 302, a randomized phase III study of abiraterone acetate in patients (pts) with metastatic castration resistant prostate cancer without prior chemotherapy. J Clin Oncol 2013; 31 (Suppl. 6): Abstr. 5.
- [3] Scher HI, Fizzzazi K, Saad F, et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012; 367: 1187–1197.
- [4] Beer TM, Armstrong AJ, Sternberg CN, et al. Enzalutamide in Men with Chemotherapy naïve Metastatic Prostate Cancer (mCRPC): Results of Phase 3 PREVAIL Study ASCO GU 2014, abstract ID: LBA1.
- [5] Beer TM, Armstrong AJ, Rathkopf DE, et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014; 371: 424–433.
- [6] Souhrn údajů o přípravku Xtandi 40 mg (revize textu 12/2014), dostupné na www. sukl.cz (navštíveno 6. 1. 2015)