Tofacitinib – nejstudovanější inhibitor Janusovy kinázy
V rámci 64. výročního sjezdu českých a slovenských revmatologů, který se konal na konci září 2021 v Olomouci, proběhlo satelitní sympozium společnosti Pfizer cílené na léčbu tofacitinibem. Příspěvek s tématem výběru vhodného pacienta s revmatoidní artritidou pro léčbu inhibitory Janusovy kinázy přednesl profesor MUDr. Pavel Horák, CSc., z III. interní kliniky – nefrologické, revmatologické a endokrinologické FN a LF UP Olomouc. Bezpečnosti tofacitinibu věnoval své sdělení profesor MUDr. Jiří Vencovský, DrSc., z Revmatologického ústavu Praha, a na tofacitinib jako novou možnost léčby juvenilní idiopatické artritidy se zaměřila profesorka MUDr. Pavla Doležalová, CSc., z Kliniky dětského a dorostového lékařství 1. LF UK a VFN v Praze. Sympoziem provázel profesor MUDr. Karel Pavelka, DrSc.
Pacient s revmatoidní artritidou vhodný pro léčbu inhibitory JAK
Metotrexát (MTX) stále představuje podle doporučení základní standardní terapii revmatoidní artritidy (RA), nicméně i při adekvátním použití kombinací konvenčních syntetických chorobu modifikujících antirevmatických léků (conventional synthetic disease modifying antirheumatic drugs, csDMARDs) je remise onemocnění dosahováno asi pouze u jedné třetiny pacientů, zdůraznil na úvod své přednášky profesor Horák. V případě nedostatečné odpovědi na MTX je indikováno použití biologických DMARDs (bDMARDs) nebo inhibitorů Janusovy kinázy (JAKi) jako přídavné terapie. V řadě případů jsou však biologika a JAKi podávány v monoterapii, neboť pacienti MTX netolerují. Podle registrů se jedná o 30-33,6 % osob (někdy uváděno až 40 %) [1-3].
Možnosti léčby po selhání metotrexátu
V první řadě lze zvažovat komedikaci několika csDMARDs. Je to ekonomická varianta, která je všeobecně dostupná a není závislá na centrové léčbě. Její efekt je podobný nebo pouze o něco menší než u biologické léčby. Nevýhodou je větší výskyt nežádoucích účinků, léčba je hůře tolerována a dochází k větší radiografické progresi než u pacientů s cílenou terapií.
Další možností je nasazení inhibitorů tumor nekrotizujícího faktoru (TNFi). S touto terapií jsou dobré zkušenosti, je účinná, s možností volby mezi přípravky podávanými intravenózně nebo subkutánně. Vlivem vývoje generik je tato léčba ekonomicky dostupnější. Nevýhodu představuje riziko rozvoje infekcí, alergických reakcí, je třeba sledovat možný výskyt TBC. Léčba má srovnatelný efekt jako MTX v případě monoterapie.
Jinou možností jsou biologické léky s jiným mechanismem účinku, u nichž máme k dispozici dlouhodobá data o účinnosti a bezpečnosti a můžeme opět volit mezi různými způsoby podání (s.c., i.v.). Tocilizumab je účinnější v monoterapii než samotný MTX, avšak v ČR má úhradu až po selhání TNFi. Uvedená léčba je dosud více ekonomicky náročná a jsou možné pouze parenterální formy.
Inhibitory JAK představují účinnou léčbu doloženou klinickými daty. Lze je podávat perorálně a pro cílenou terapii u RA se mohou podávat také v monoterapii. Léčba je inovativní, avšak ekonomicky náročnější, zkušenost s léky je zatím krátkodobá (např. v porovnání s TNFi) a nejsou zcela prozkoumány všechny mechanismy nežádoucích účinků, které s touto terapií mohou být spojeny.
Při porovnání z farmakologického hlediska jsou cílené JAKi stabilní malé molekuly s intercelulárními cíli, působí na základě inhibice enzymu, mají nízkou variabilitu a specificitu, krátké působení a nejsou imunogenní. Opačné farmakologické vlastnosti vykazují bDMARDs (proteiny/peptidy, nestabilní, cíle extracelulární, blokace a deplece cytokinů, receptoru, vysoká specificita, dlouho působící a imunogenní). Další rozdíly jsou v perorálním vs. parenterálním podání, JAKi jsou metabolizovány, u bDMARDs probíhá biodegradace. U JAKi jsou možné lékové interakce a mají odlišný profil toxicity v porovnání s bDMARDs. Zatímco biologické léky čekají na své biosimilars, v případě JAKi jsou vyvíjena generika [4].
Tři modely pacientů vhodných pro léčbu inhibitory JAK
- Pacientka dlouhodobě léčená MTX, u níž postupně dochází k navyšování aktivity choroby, má velké obavy z parenterální terapie a dala by přednost perorálnímu podání.
- Pacient, který musel přestat užívat MTX při komedikaci s TNFi z důvodu hepatopatie, narůstá u něj aktivita RA.
- Pacientka, u níž došlo ke zmírnění aktivity choroby po komedikaci MTX a TNFi, efekt v ústupu bolesti a únavy však není dostatečný.
První pacientka je pro RA léčena 15 let, dlouhodobě užívá MTX, jeho efekt však postupně mizí. V současné době žena užívá 20 mg MTX a sulfasalazin v dávce 2 500 mg, má větší počet bolestivých a oteklých kloubů, necítí se dobře, byla u ní zaznamenána vyšší sedimentace a zvýšená hodnota dle skóre aktivity nemoci (Disease Activity Score, DAS28) 5,36. V tomto případě se můžeme opřít o data ze studie ORAL Strategy, která prokázala účinnost tofacitinibu (Xeljanz) u pacientů se selháním léčby MTX. Při kombinaci tofacitinibu a MTX byla prokázána non inferiorita ve vztahu ke kombinaci adalimumabu a MTX, přičemž u obou bylo dosaženo klinicky významných odpovědí na základě měřeného parametru ACR50 (50% zlepšení podle American College of Rheumatology) v šestém měsíci. U tofacitinibu v monoterapii sice nebyla prokázána non inferiorita ve vztahu ke kombinaci adalimumab + MTX, ale i tak bylo dosaženo významné klinické odpovědi. Ve všech třech léčebných ramenech byly pozorovány klinicky relevantní odpovědi z hlediska účinnosti [5]. Jestliže bude v budoucnu třeba u této pacientky MTX vysadit, podle dostupných dat by měl být efekt léčby zachován. Dokládá to dvojitě zaslepená studie ORAL Shift, v jejíž první otevřené části dostávali všichni pacienti kombinaci tofacitinib a MTX. Ti, u kterých bylo dosaženo alespoň nízké klinické aktivity podle indexu CDAI (Clinical Disease Activity Index), pokračovali do dvojitě zaslepené části a byli randomizováni do větve s podáváním tofacitinibu v monoterapii (MTX byl nahrazen placebem) nebo do větve, jež pokračovala v podávání kombinované terapie. Účinnost léčby byla zachována v obou větvích [6]. Pokud u dotyčné pacientky zahájíme léčbu tofacitinibem, můžeme očekávat podobnou účinnost jako u biologika a můžeme dosáhnout remise či nízké aktivity choroby a udržet ji i bez případné komedikace s MTX.
Druhý pacient trpí aktivní RA čtyři roky, poslední dva roky užívá MTX s adalimumabem. Z důvodu zvýšení hodnot jaterních enzymů, které nereagovaly na snížení dávky MTX, byl lék vysazen. U muže došlo ke zvýšení aktivity choroby, vzestupu počtu oteklých a bolestivých kloubů a ke zvýšení sedimentace. Adalimumab v monoterapii u něj není dostatečně efektivní. Ve studii ORAL Solo byl porovnáván tofacitinib v monoterapii s placebem, do studie byli zařazeni pacienti, u nichž selhala léčba csDMARD či bDMARD. Nabízí se zde tedy podobnost s druhým pacientem. Na základě dosažení primárních cílových ukazatelů v podobě odpovědí ACR20, ACR50 a ACR70
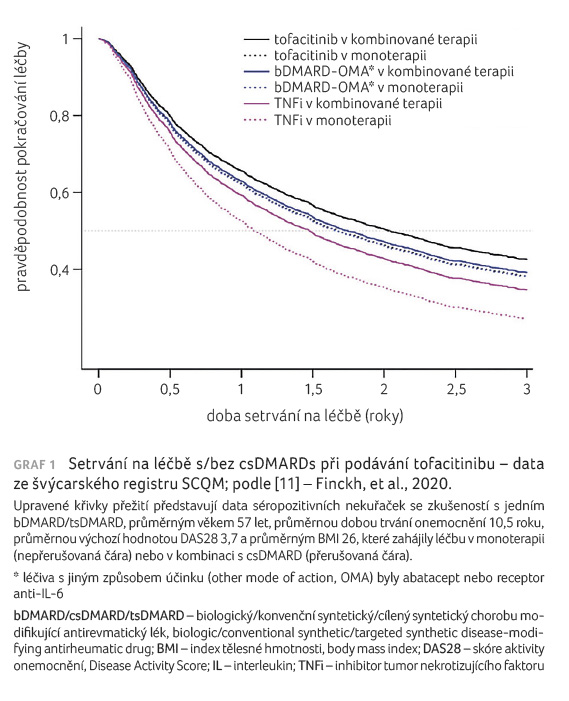
byla potvrzena účinnost tofacitinibu v monoterapii [7]. Studie ORAL Step hodnotící tofacitinib v kombinaci s MTX u pacientů, u nichž selhala léčba TNFi, pak doložila rychlý nástup účinku sledovaného JAKi a také přinesla data, která ukazují počty remisí ve třetím měsíci léčby a nízkou aktivitu choroby ve třetím měsíci v porovnání s kontrolami [8,9]. Dlouhodobá studie ORAL Sequel potvrdila podobné setrvání na léčbě monoterapií tofacitinibem v porovnání s léčbou tofacitinibem v kombinaci s MTX v průběhu devíti let [10]. Podobná data máme k dispozici ze švýcarského registru (SCQM), kdy tofacitinib v kombinaci i v monoterapii vykazoval velmi dobré setrvání na léčbě rovněž oproti ostatním biologickým lékům v monoterapii nebo v kombinaci (graf 1) [11]. Pacient tohoto typu může mít prospěch z rychlého nástupu účinku tofacitinibu, z významné šance na dosažení remise, z dlouhodobého setrvání na léčbě i v monoterapii tofacitinibem. Po selhání TNFi tedy můžeme volit léčbu tofacitinibem.
Třetí pacientka je s RA léčena šest let, jeden rok užívá kombinaci TNFi a MTX, avšak efekt není dostatečný. Žena má vysoký počet bolestivých kloubů, menší počet oteklých kloubů a trpí velkou únavou a dopadem na funkčnost. I v tomto případě můžeme volit terapii JAKi, jak dokládají data ze studie ORAL Step, neboť příznivý vliv sledované léčby zde navíc provázelo statisticky signifikantní zmírnění potíží souvisejících s únavou, rychlá úleva od bolesti a zvýšení vitality [12,13]. Analýza z australského registru (OPAL) ukázala v jednotlivých měsících roku 2020 při porovnání terapie biologickým lékem a terapie tofacitinibem srovnatelné výsledky, co se týče počtu remisí nemoci, přičemž více pacientů léčených tofacitinibem užívalo lék v monoterapii [14]. U třetí pacientky tedy můžeme při zahájení léčby tofacitinibem očekávat rychlý nástup účinku, podstatné zmírnění únavy a bolesti, zvýšení vitality a významnou míru remise.
Nežádoucí účinky, význam inhibitorů JAK
Inhibitory JAK mají jen mírně odlišný profil nežádoucích účinků ve srovnání s TNFi a biologickou léčbou s jiným mechanismem účinku. Pro JAKi jsou typické spíše bakteriální infekce a výskyt herpes zoster. Diskutuje se tromboembolické riziko u pacientů s rizikovými faktory a použití této léčby u starší populace. Rozdíly v profilu nežádoucích účinků je třeba brát v potaz při volbě terapie u konkrétního pacienta. Značná část nemocných nedosahuje remise či nízké aktivity choroby při terapii bDMARDs, z tohoto důvodu potřebujeme široké spektrum léků s rozdílným mechanismem účinku. Kromě účinnosti v monoterapii a možnosti perorálního podání je u JAKi výhodou také jejich vliv na širokou paletu výsledků hlášených pacienty, který byl prokázán v klinických hodnoceních.
Bezpečnost tofacitinibu
Tofacitinib byl v indikaci RA schválen americkým Úřadem pro kontrolu potravin a léčiv (FDA) v roce 2012 a Evropskou lékovou agenturou (EMA) v roce 2017. Lék je v současnosti indikován pro řadu diagnóz. Tofacitinib se podává i ve formě s prodlouženým uvolňováním jedenkrát denně, je rovněž schválen pro psoriatickou artritidu, ulcerózní kolitidu a v nedávné době byl EMA schválen pro juvenilní idiopatickou artritidu u pacientů ve věku od 2 let, uvedl své sdělení profesor Vencovský.
V nedávno dokončeném klinickém hodnocení (ORAL Surveillance) u pacientů s RA, kteří byli ve věku 50 let nebo starší a měli alespoň jeden další kardiovaskulární rizikový faktor, byla při léčbě tofacitinibem pozorována zvýšená incidence nefatálního infarktu myokardu v porovnání s TNFi. Ve studii byla rovněž pozorována vyšší incidence malignit s výjimkou nemelanomových nádorů kůže, zejména maligního nádorového onemocnění plic a lymfomu, při léčbě tofacitinibem v porovnání s TNFi [15]. Na základě těchto výsledků vydala v červenci 2021 EMA doporučení, že tofacitinib má být podáván pacientům starším 65 let, aktivním nebo bývalým kuřákům a těm, kteří mají další kardiovaskulární rizikové faktory nebo rizikové faktory pro malignity, pouze v případě, že není dostupná vhodná alternativní léčba. Je tedy nutné, aby předepisující lékaři s pacienty probrali rizika spojená s podáváním přípravku Xeljanz, včetně infarktu myokardu, maligního nádorového onemocnění plic a lymfomu.
FDA vydal rozhodnutí počátkem září a požaduje doplnit informace o rizicích výskytu závažných srdečních příhod, malignit, krevních sraženin a úmrtí do varování k přípravkům Xeljanz, Olumiant (baricitinib) a Rinvoq (upadacitinib), neboť předpokládá tzv. class effect (skupinový efekt) pro všechny JAKi schválené pro léčbu RA. Doporučení pro zdravotnické pracovníky má zahrnovat zvážení přínosů a rizik pro konkrétního pacienta před zahájením nebo pokračováním léčby. Aby bylo zajištěno, že přínos těchto tří léčivých přípravků převáží nad riziky, omezuje FDA všechna schválená použití na pacienty, kteří nereagovali na jeden nebo více TNFi nebo je netolerují [16].
Studie ORAL Surveillance
ORAL Surveillance bylo dlouhodobé randomizované, otevřené, postmarketingové klinické hodnocení bezpečnosti nařízené FDA. Jeho cílem bylo hodnocení bezpečnosti tofacitinibu v dávce 2 5 mg a 2 10 mg v porovnání s TNFi (v Severní Americe adalimumab, ve zbytku světa etanercept) [15].
Primárními cílovými ukazateli byly
velké kardiovaskulární příhody (MACE) a malignity (kromě
nemelanomových kožních nádorů). MACE byla definována jako úmrtí
z kardiovaskulárních příčin (infarkt myokardu, náhlá
kardiální smrt, srdeční selhání, cévní mozková příhoda,
kardiovaskulární procedura, krvácení, další, např. periferní
arteriální onemocnění), nefatální infarkt myokardu, nefatální
cévní mozková příhoda. Vstupní kritéria zahrnovala následující
ukazatele: věk ≥ 50 let,
aktivní RA (≥ 6 bolestivých
a ≥ 6 oteklých kloubů z 28),
nedostatečně efektivní léčba MTX a alespoň jeden
kardiovaskulární rizikový faktor. Tyto rizikové faktory
zahrnovaly současné kuřáctví, hypertenzi, hodnotu HDL
cholesterolu < 40 mg/dl, diabetes mellitus, anamnézu
onemocnění koronárních cév, anamnézu předčasného úmrtí
z kardiálních příčin nebo náhlou smrt v prvostupňovém
příbuzenstvu (u mužů mladších 55 let,
u žen mladších 65 let),
extraartikulární onemocnění u RA (např. revmatické
uzly, Sjögrenův syndrom, anémie u chronických onemocnění,
plicní manifestace). Všichni pacienti současně museli užívat
MTX.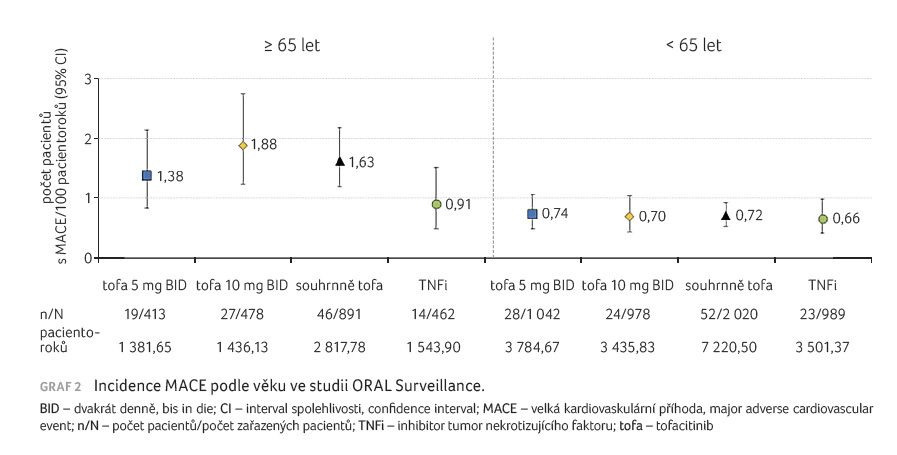
Do studie bylo zařazeno 4 372
pacientů. Cílem studie bylo prokázat non inferioritu
tofacitinibu v obou dávkách dohromady vůči TNFi.
Non inferiorita znamená, že uvedený lék není horší než
ten, s nímž je porovnáván; zde je prokázána, pokud horní
hranice dvoustranného 95% intervalu spolehlivosti pro poměr
rizik nepřekročí stanovenou hranici poměru rizik 1,8.
U incidence MACE podle věku se ukázalo, že není rozdíl
u pacientů mladších 65 let, ale odlišnosti se ukazují
v případě věku nad 65 let. Významným rizikovým faktorem
pro vznik MACE při léčbě tofacitinibem je tedy věk nad 65 let
(graf 2). Podobné výsledky byly doloženy pro všechny
skupiny pacientů, ale riziko výrazně stoupalo u nemocných
s dávkou 2 10 mg
tofacitinibu. V případě incidence MACE podle kouření je
toto významným rizikovým faktorem u pacientů léčených
tofacitinibem, ve skupinách s TNFi se uvedené riziko
neprojevilo, srovnatelné výsledky vykazovali současní i bývalí
kuřáci (graf 3).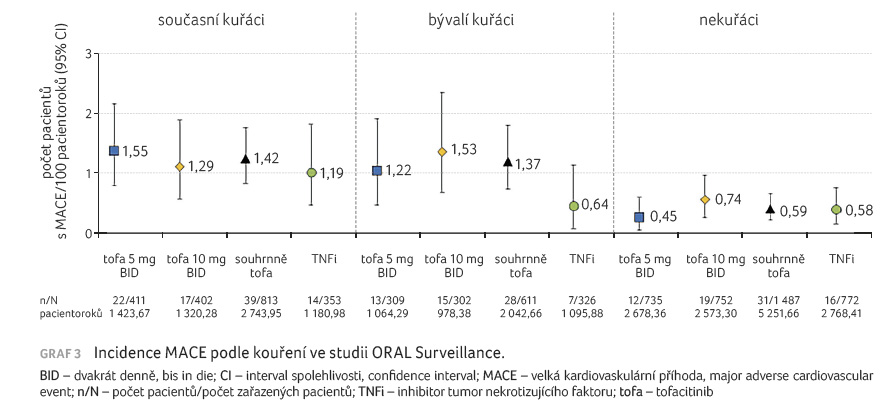
Studie s podobným uspořádáním proběhla v minulosti, s publikací výsledků v roce 2020. U tohoto hodnocení byl předpoklad pro vyšší výskyt MACE při léčbě tocilizumabem, neboť jeho podávání zvyšuje koncentraci LDL cholesterolu. Toto klinické sledování s názvem ENTRACTE přineslo z hlediska primárního cílového ukazatele dobré výsledky pro tocilizumab v porovnání s etanerceptem [17]. V této studii byl zaznamenán rozdíl v absolutním výskytu nežádoucích příhod, oproti ORAL Surveillance minimálně dvojnásobný, přestože studie ENTRACTE byla koncipována velmi podobně.
Při hodnocení incidence infarktu myokardu ve studii ORAL Surveillance byly při léčbě tofacitinibem významné rozdíly zaznamenány u nefatálních příhod, u fatálních příhod se neprojevily. V případě incidence malignit byl pak minimální rozdíl zachycen u nemocných mladších 65 let, zatímco u nemocných starších 65 let byly odlišné hodnoty výrazné.
Registr CorEvitas (dříve CORRONA)
sleduje pacienty léčené tofacitinibem od roku 2012 [18]. Jsou
v něm shromážděna dlouhodobá data z hlediska výskytu
nežádoucích příhod. V pětiletém hodnocení z tohoto
registru nebyl shledán rozdíl ve výskytu nežádoucích
příhod při užívání tofacitinibu ve srovnání s bDMARDs
vyjma vyššího výskytu herpes zoster. Výskyt MACE i malignit
byl srovnatelný v obou skupinách (graf 4). Je však
nutné si uvědomit, že se jedná o běžné pacienty, a ne
o vybranou populaci, na rozdíl od klinických
hodnocení.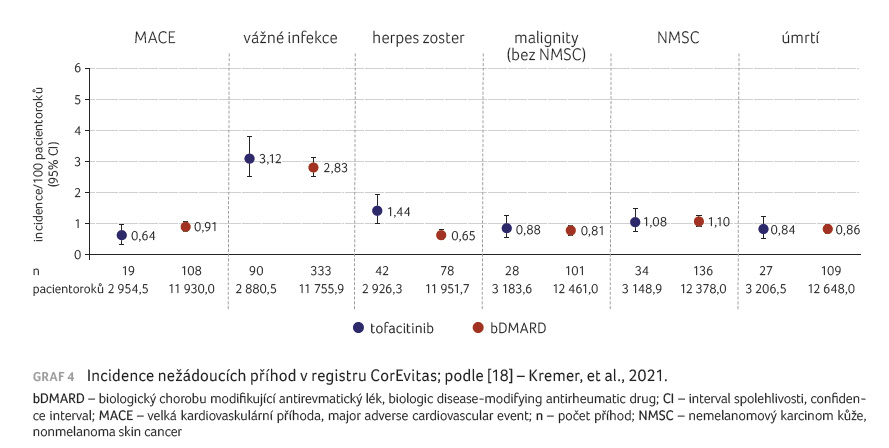
Shrnutí
Dlouhodobá bezpečnost tofacitinibu u neselektované populace je srovnatelná s ostatními DMARDs používanými v léčbě RA. Bezpečnost tofacitinibu je pravděpodobně závislá na populaci nemocných. Nemocní vyššího věku a kuřáci mají vyšší riziko rozvoje MACE a malignit. Otázkou jsou také infekce a žilní tromboembolie. FDA považuje tyto vlastnosti za tzv. class effect pro všechny JAKi. Pro jiné JAKi nejsou k dispozici údaje o bezpečnosti u vybrané rizikové populace. Podle FDA by léčba JAKi měla následovat až po selhání TNFi, přičemž je nezbytné zvážení prospěchu a rizika a konzultace s pacientem. EMA a následně Státní ústav pro kontrolu léčiv se k problematice stavějí odlišně: u pacientů starších 65 let, u pacientů, kteří jsou nebo bývali kuřáky, a u pacientů s jinými kardiovaskulárními rizikovými faktory nebo rizikovými faktory pro malignity (např. současná malignita nebo malignity v anamnéze kromě úspěšně vyléčeného nemelanomového karcinomu kůže) se má tofacitinib používat, pouze pokud nejsou k dispozici vhodné alternativy léčby. Je nutné, aby předepisující lékaři s pacienty probrali rizika spojená s podáváním přípravku Xeljanz. EMA nemá výslovné doporučení používat JAKi až v léčebné linii po selhání TNFi.
Tofacitinib jako nová možnost léčby JIA
Tofacitinib je prvním JAKi
registrovaným pro použití u juvenilní idiopatické artritidy
(JIA). V České republice máme zatím pro tuto léčbu
z klasických antirevmatik k dispozici MTX
a intraartikulární triamcinolon hexacetonid a z registrovaných
bDMARDs etanercept, adalimumab, golimumab, tocilizumab, bez úhrady
abatacept, kanakinumab a anakinru, vysvětlila profesorka
Doležalová. Armamentarium dostupné pro děti je podstatně užší
než u pacientů v dospělém věku. Společnost Pfizer
koncipovala celý systematický program pro vývoj tofacitinibu
a jeho použití u pacientů v dětském věku (tab. 1). Ze studií zaměřených na léčbu tofacitinibem
u JIA cílilo první klinické hodnocení na věk
a hmotnost pacientů ve vztahu k dávkování. Tato
otevřená farmakokinetická studie s mnohočetným
dávkováním u dětí s JIA ve věku od 2 do 18 let
byla již ukončena. Výsledky druhé studie vedly k evropské
registraci tofacitinibu. Jednalo se o randomizovanou, dvojitě
zaslepenou, placebem kontrolovanou studii u dětí od 2
do 18 let s polyartikulárně probíhajícím onemocněním,
která byla ukončena roku 2019. Stále probíhá studie u dětí
s aktivní systémovou JIA, s aktivními systémovými
projevy a také dlouhodobá pokračovací studie u pacientů,
kteří se účastnili předchozích hodnocení s doloženým
dostatečným efektem léčby a její dobrou tolerancí.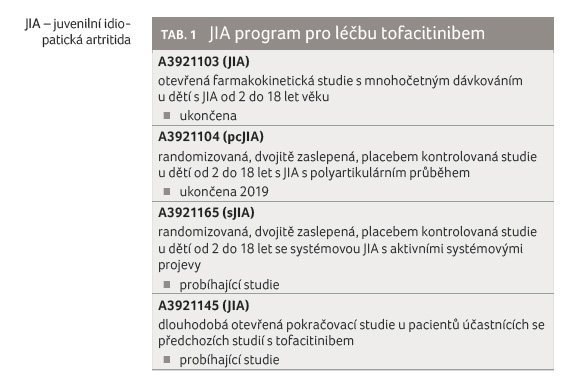
JIA s polyartikulárním průběhem
Polyartikulárně probíhající JIA představuje spíše funkční koncept, který spojuje různé typy kategorií onemocnění a je charakterizován přítomností pěti a více aktivních kloubů [19-21]. Koncept zahrnuje systémovou JIA s polyartikulárním průběhem, perzistující oligoartritidu a tzv. extendovanou oligoartritidu, kdy se po šesti měsících rozvine aktivita většího počtu kloubů (z původního méně než 5), klasickou revmatoidní faktor (RF) negativní polyartikulární JIA, která se v uvedené kategorii vyskytuje asi nejčastěji (RF pozitivní se u dětí objevuje pouze zhruba v 1 %). Součástí jsou i další kategorie (psoriatická artritida, artritida s entezitidou, nediferencovaná artritida), které však nemusejí mít polyartikulární průběh, a nejsou tedy předmětem tohoto sdělení.
Studie u dětí s polyartikulárním průběhem JIA
Vstupními kritérii pro vstup do randomizované, dvojitě zaslepené a placebem kontrolované studie byly věk 2-18 let, aktivní onemocnění, nedostatečná odpověď na léčbu alespoň jedním DMARD nebo jeho intolerance, JIA bez systémových projevů (minimálně 6 měsíců před vstupem do studie). K vylučovacím kritériím patřily systémové projevy, perzistující oligoartritida, nediferencovaná JIA a aktivní uveitida. První část studie tvořila otevřená fáze v trvání 18 týdnů, kdy pacienti s hmotností více než 40 kg dostávali 5 mg tofacitinibu a pacienti s hmotností nižší než 40 kg dávku dle tělesné hmotnosti. Ve dvojitě zaslepené části trvající 26 týdnů byli pacienti randomizováni v poměru 1 : 1 k podávání tofacitinibu a placeba [22].
Primárním cílovým ukazatelem byla identifikace relapsů ve 44. týdnu a hlavními sekundárními cílovými ukazateli odpověď JIA ACR30/50/70 ve 44. týdnu oproti výchozí hodnotě v otevřené fázi a změna dle skóre CHAQ DI (Childhood Health Assessment Questionnaire Disability Index) ve 44. týdnu oproti výchozí hodnotě ve dvojitě zaslepené fázi. Dále byly hodnoceny např. intervaly do relapsu, skóre ACR a byla sledována bezpečnost léčby.
V rámci tzv. JIA core setu jsou brány v potaz počet aktivních kloubů, počet omezených kloubů, globální hodnocení aktivity onemocnění lékařem a pacientem, resp. rodičem, laboratorní hodnoty, hodnota C reaktivního proteinu (CRP), funkční hodnocení (dle CHAQ). Relaps je definován jako zhoršení o ≥ 30 % u tří nebo více z uvedených šesti parametrů a zlepšení ≥ 30 % u ne více než jednoho parametru core setu. Kritéria terapeutické odpovědi JIA ACR30/50/70 definují zlepšení o ≥ 30/50/70 % u tří ze šesti parametrů core setu při zhoršení o ≥ 30 % u ne více než jednoho parametru core setu [23,24].
Celkově do studie vstoupilo 225
pacientů, 88 jich bylo randomizováno k podávání aktivního
léku, 85 pacientů k podávání placeba. Z demografických
charakteristik můžeme zmínit odpovídající poměr věku a podílu
dívek a chlapců, medián trvání předchozí choroby kolem
dvou let, tedy relativně pokročilé onemocnění, selhání léčby
minimálně jedním DMARD a distribuci jednotlivých typů JIA
s polyartikulárním průběhem. Relapsy byly během zaslepené
fáze signifikantně více přítomny v placebové větvi (až
v 53 %), u tofacitinibu to bylo necelých 30 % (graf 5). Odpověď na léčbu podle ACR30/50/70 byla významná
v tofacitinibové skupině, u více než 50 % léčených
dětí nastalo více než 70% zlepšení. Závažných nežádoucích
příhod bylo zaznamenáno pouze minimum, k nejčastějším
reakcím patřily infekce horních cest dýchacích, progrese nemoci
nebo její exacerbace.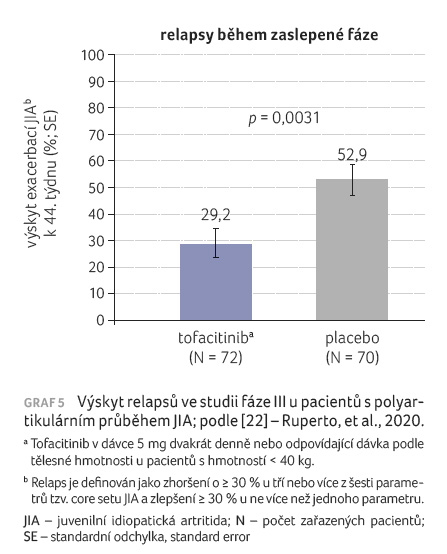
Závěrem
Úspěšně proběhla studie u JIA s polyartikulárním průběhem u pacientů s pěti a více aktivními klouby (extendovaná oligoartritida, RF negativní/pozitivní polyartritida, JIA bez systémových projevů) [22]. Randomizované, dvojitě zaslepené, placebem kontrolované klinické hodnocení fáze III ukázalo významně nižší výskyt relapsů u pacientů léčených tofacitinibem oproti placebo. Nemocní s polyartikulárním průběhem JIA dosáhli rychlého a trvajícího zlepšení aktivity onemocnění [25]. Bezpečnostní profil tofacitinibu byl u dětí s polyartikulární JIA, psoriatickou artritidou a časnou RA srovnatelný s dospělými pacienty s RA [29].
Redakčně zpracovala PhDr. Nikola Homolová Richtrová
Seznam použité literatury
- [1] Grigor C, Capell H, Stirling A, et al. Effect of a treatment strategy of tight control for rheumatoid arthritis (the TICORA study): a single‑blind randomised controlled trial. Lancet 2004; 364: 263−269.
- [2] Yazici Y, Shi N, John A. Utilization of biologic agents in rheumatoid arthritis in the United States: analysis of prescribing patterns in 16,752 newly diagnosed patients and patients new to biologic therapy. Bull NYU Hosp Jt Dis 2008; 66: 77−85.
- [3] Soliman MM, Ashcroft DM, Watson KD, et al. Impact of concomitant use of DMARDs on the persistence with anti‑TNF therapies in patients with rheumatoid arthritis: results from the British Society for Rheumatology Biologics Register. Ann Rheum Dis 2011; 70: 583−589.
- [4] Mócsai A, Kovács L, Gergely P. What is the future of targeted therapy in rheumatology: biologics or small molecules? BMC Med 2014; 12: 43.
- [5] Fleischmann R, Mysler E, Hall S, et al. Efficacy and safety of tofacitinib monotherapy, tofacitinib with methotrexate, and adalimumab with methotrexate in patients with rheumatoid arthritis (ORAL Strategy): a phase 3b/4, double blind, head to head, randomised controlled trial. Lancet 2017; 390: 457‒468.
- [6] Cohen SB, Pope JE, Haraoui B, et al. Methotrexate withdrawal in patients with rheumatoid arthritis who achieve low disease activity with tofacitinib modified‑release 11 mg once daily plus methotrexate (ORAL Shift): a randomised, phase 3b/4, non‑inferiority trial. Lancet Rheumatology 2019; 1: E23−E34.
- [7] Fleischmann R, Kremer J, Cush J, et al. Placebo‑Controlled Trial of Tofacitinib Monotherapy in Rheumatoid Arthritis. N Engl J Med 2012; 367: 495−507.
- [8] Burmester GR, Blanco R, Charles‑Schoeman Ch, et al. Tofacitinib (CP‑690,550) in combination with methotrexate in patients with active rheumatoid arthritis with an inadequate response to tumour necrosis factor inhibitors: a randomised phase 3 trial. Lancet 2013; 381: 451−460.
- [9] Smolen JS, Aletaha D, Gruben D, et al. Brief Report: Remission Rates With Tofacitinib Treatment in Rheumatoid Arthritis: A Comparison of Various Remission Criteria. Arthritis Rheumatol 2017; 69: 728−734.
- [10] Pope JE, Keystone E, Jamal S, et al. Persistence of Tofacitinib in the Treatment of Rheumatoid Arthritis in Open‑Label, Long‑Term Extension Studies up to 9.5 Years. ACR Open Rheumatol 2019; 1: 73−82.
- [11] Finckh A, Tellenbach C, Herzog L, et al. Comparative effectiveness of antitumour necrosis factor agents, biologics with an alternative mode of action and tofacitinib in an observational cohort of patients with rheumatoid arthritis in Switzerland. RMD Open 2020; 6: e001174.
- [12] Strand V, Burmester GR, Zerbini CAF, et al. Tofacitinib with methotrexate in third‑line treatment of patients with active rheumatoid arthritis: patient‑reported outcomes from a phase III trial. Arthritis Care Res (Hoboken) 2015; 67: 475−483.
- [13] Strand V, Kremer J, Wallenstein G, et al. Effects of tofacitinib monotherapy on patient‑reported outcomes in a randomized phase 3 study of patients with active rheumatoid arthritis and inadequate responses to DMARDs. Arthritis Res Ther 2015; 17: 307.
- [14] Bird P, Littlejohn G, Butcher B, et al. Real‑world evaluation of effectiveness, persistence, and usage patterns of tofacitinib in treatment of rheumatoid arthritis in Australia. Clin Rheumatol 2020; 39: 2545−2551.
- [15] Safety Study Of Tofacitinib Versus Tumor Necrosis Factor (TNF) Inhibitor In Subjects With Rheumatoid Arthritis; https://clinicaltrials.gov/ct2/show/NCT02092467
- [16] FDA requires warnings about increased risk of serious heart‑related events, cancer, blood clots, and death for JAK inhibitors that treat certain chronic inflammatory conditions. Dostupné na: https://www.fda.gov/drugs/drug‑safety‑and‑availability/fda‑requires‑warnings‑about‑increased‑risk‑serious‑heart‑related‑events‑cancer‑blood‑clots‑and‑death
- [17] Giles JT, Sattar N, Gabriel S, et al. Cardiovascular Safety of Tocilizumab Versus Etanercept in Rheumatoid Arthritis: A Randomized Controlled Trial. Arthritis Rheumatol 2020; 72: 31−40.
- [18] Kremer JM, Bingham CO, Cappelli LC, et al. Postapproval Comparative Safety Study of Tofacitinib and Biological Disease‑Modifying Antirheumatic Drugs: 5‑Year Results from a United States–Based Rheumatoid Arthritis Registry. ACR Open Rheumatol 2021; 3: 173−184.
- [19] Lovell DJ, Giannini EH, Reiff A, et al. Etanercept in Children with Polyarticular Juvenile Rheumatoid Arthritis. N Engl J Med 2000; 342: 763769.
- [20] Oberle EJ, Harris JG, Verbsky JW. Polyarticular juvenile idiopathic arthritis – epidemiology and management approaches. Clin Epidemiol 2014; 6: 379393.
- [21] Giancane G, Alongi A, Ravelli A. Update on the pathogenesis and treatment of juvenile idiopathic arthritis. Curr Opin Rheumatol 2017; 29: 523−529.
- [22] Ruperto N, Synoverska O, Ting T, et al. [Abstract: OP0291]. Tofacitinib for the treatment of polyarticular course juvenile idiopathic arthritis: results of a phase 3, randomised, double‑blind, placebo‑controlled withdrawal study. Ann Rheum Dis 2020; 79(S1): 180−181.
- [23] Brunner H, Lovell DJ, Finck BK, Giannini EH. Preliminary definition of disease flare in juvenile rheumatoid arthritis. J Rheumatol 2002; 29: 1058–1064.
- [24] Giannini EH, Ruperto N, Ravelli A, et al. Preliminary definition of improvement in juvenile arthritis. Arthritis Rheum 1997; 40: 1202–1209.
- [25] Wollenhaupt J, Lee E‑B, Curtis JR, et al. Safety and efficacy of tofacitinib for up to 9.5 years in the treatment of rheumatoid arthritis: final results of a global, open‑label, long‑term extension study. Arthritis Res Ther 2019; 21: 89.