Ustekinumab v léčbě psoriázy
Souhrn:
Psoriáza je chronické, imunitně zprostředkované zánětlivé onemocnění kůže, které postihuje přibližně 2–4 % středoevropské populace. V jeho léčbě se v posledních letech používají tzv. biologika, která jsou vyhrazena pro středně těžké a těžké formy onemocnění, jež nereagují na konvenční systémovou terapii (methotrexat, cyklosporin, acitretin, fototerapie), anebo u pacientů, kteří tuto terapii netolerují. V současné době je k biologické léčbě chronické ložiskové psoriázy schváleno pět přípravků: léky blokující tumor nekrotizující faktor alfa (adalimumab, etanercept, infliximab), léky blokující interleukin 12 a 23 (ustekinumab) a nově lék blokující interleukin 17 (secukinumab). Uvádíme případ pacienta s těžkou formou psoriázy, který byl úspěšně léčen ustekinumabem.
Key words: ustekinumab – IL-12, IL-23 – biologic treatment
Summary:
Psoriasis is a chronic, immune mediated inflammatory skin condition, affecting about 2–4% of the Central European population. So-called biologics have been used for its treatment recently; the biologics are reserved for moderate and severe forms of the disease which do not respond to conventional systemic therapy (methotrexate, cyclosporine, acitretin, and phototherapy) or which are not tolerated by the patients. Until now, five products have been approved for the biologic treatment of the chronic focal psoriasis: the tumor necrosis factor-alpha blockers (adalimumab, etanercept, infliximab), the interleukin-12 and -23 blocking agents (ustekinumab), and, recently, interleukin-17 blocking agent (secukinumab). The case of a patient suffering from severe form of psoriasis, successfully treated with ustekinumab, is presented.
Úvod
Psoriáza je chronické, imunitně zprostředkované zánětlivé onemocnění kůže postihující přibližně 2‒4 % středoevropské populace [1]. Poslední výzkumy ukázaly, že se nejedná pouze o chorobu kůže ‒ psoriáza je v současné době považována za systémové zánětlivé onemocnění spojené s řadou komorbidit, jako jsou psoriatická artritida, Crohnova choroba, ulcerózní kolitida, ankylozující spondylitida a metabolický syndrom (diabetes mellitus 2. typu, arteriální hypertenze, dyslipidemie, hyperurikemie, obezita) [2]. V roce 2009 byl uveden do klinické praxe ustekinumab, který byl zpočátku používán až po selhání terapie anti TNF, aktuálně patří do první linie léčby psoriázy [3].
Ustekinumab je plně humánní monoklonální protilátka, která se váže s vysokou afinitou na proteinovou podjednotku p40 interleukinu 12 (IL 12) a interleukinu 23 (IL 23). Blokuje vazbu IL 12 a IL 23 na receptor na povrchu T lymfocytů, čímž je zabráněno aktivaci T lymfocytů a jejich diferenciaci v podtypy Th1 a Th17. Aktivované T lymfocyty uvolňují celou řadu prozánětlivých cytokinů. Lymfocyty Th1 secernují interferon gama (IFNγ) a tumor nekrotizující faktor alfa (TNFα). Lymfocyty Th17, které hrají u psoriázy klíčovou roli, produkují IL 17, který aktivuje další prozánětlivé mediátory a IL 22. Ustekinumab tím brání patologické aktivaci cytokinové kaskády v časnější fázi než přípravky anti TNFα [4,5].
Ustekinumab je indikován k léčbě středně těžké a těžké ložiskové psoriázy u dospělých pacientů, u nichž se nedostavila klinická odpověď na konvenční systémovou léčbu (cyklosporin, methotrexat nebo fototerapie), popř. je u nich tato léčba kontraindikována nebo netolerována. Ustekinumab se aplikuje v úvodní dávce 45 mg subkutánně (s.c.) v 0. týdnu, další dávka 45 mg s.c. se aplikuje ve 4. týdnu, poté se lék podává v dávce 45 mg s.c. každých 12 týdnů. Dávkování po 12 týdnech je možné díky pomalé absorpci a eliminaci přípravku s průměrným poločasem 15‒45 dní. U pacientů s tělesnou hmotností více než 100 kg se aplikuje dvojnásobná dávka, neboť je účinnější [4,6]. Terapie probíhá v centrech biologické léčby. Nástup účinku ustekinumabu je rychlý a zřejmý již během dvou týdnů po zahájení léčby, léčebná odpověď onemocnění se hodnotí za 3‒4 měsíce, maximální léčebná odpověď bývá patrna mezi 20.‒24. týdnem terapie. Po jejím ukončení nedochází k rebound fenoménu a podobné odpovědi na léčbu bylo dosaženo i při opakované terapii [7]. Během léčby biologiky může dojít ke vzniku protilátek proti přípravku. Protilátky proti ustekinumabu se vyskytují u 5 % pacientů a jsou častější u osob s horší léčebnou odpovědí. Kontraindikací pro terapii ustekinumabem je přítomnost klinicky významné aktivní infekce (např. aktivní tuberkulózy) a hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku. Přípravek by neměl být podáván během těhotenství a laktace. Očkování živými vakcínami se nedoporučuje [8].
Kazuistika
Čtyřicetiletý pacient (narozený v roce 1977) trpěl psoriázou od 27 let, v péči našeho oddělení je od roku 2013. V rodinné anamnéze lze vysledovat lupénku u babičky pacienta. Nemocný trpí silnou obezitou (výška 190 cm, hmotnost 140 kg, BMI 38,8), z důvodu hypertenze je léčen kombinací antihypertenziv. V roce 2004 se u něj poprvé objevila lupénka lokalizovaná nad velkými klouby. Zpočátku byl pacient léčen lokálními kortikosteroidy bez výraznějšího účinku, poté docházel na fototerapii UVB 311 nm po dobu tří měsíců. Tato léčba měla krátkodobý přínos. V roce 2009 byl nemocný léčen celkově retinoidy po dobu devíti měsíců (acitretin 25 mg denně) s nevýrazným účinkem a léčba byla ukončena kvůli nežádoucím účinkům (elevaci hodnot jaterních testů a krevních tuků). Ostatní konvenční systémová léčba nebyla podávána z důvodu hypertenze, hepatopatie a poruchy metabolismu tuků. V dubnu 2013 byl pacient zařazen do klinické studie AMAGINE 2 s brodalumabem. Vstupní hodnota skóre závažnosti kožních změn PASI (Psoriasis Area Severity Index) byla 34,4 a hodnota rozsahu postižení BSA (Body Surface Area) 50 %, index kvality života (Dermatology Life Quality Index, DLQI) byl zaznamenán v hodnotě 17. Nemocný byl z klinické studie předčasně vyřazen po 28 týdnech (primární non responder). Biologická léčb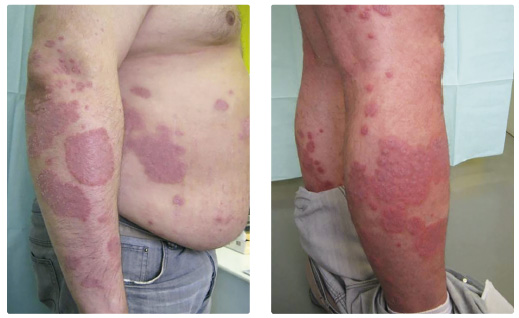 a adalimumabem v dávce 40 mg každé dva týdny byla zahájena v prosinci 2013 (PASI 18, BSA 35 %), po dvou měsících léčby došlo k poklesu PASI na 3,4 a BSA na 4 %. Po přechodném zlepšení postupně docházelo ke zhoršování psoriatických projevů, v srpnu 2014 dosáhla hodnota PASI 9,5 a hodnota BSA 10 %. Aplikační schéma adalimumabu bylo zkráceno na 40 mg 1× týdně, bez výraznějšího účinku na klinické projevy psoriázy. V listopadu 2014 byla k biologické léčbě přidána fototerapie UVB 311 nm s frekvencí 2‒3× týdně, opět bez výraznějšího terapeutického přínosu. Zhoršování klinického stavu progredovalo, PASI a BSA dosáhly v březnu 2015 hodnoty 24,4, resp. 20 % (obr. 1, 2) a fototerapie byla ukončena. Krevními testy byly zjištěny protilátky proti adalimumabu a léčba tímto přípravkem byla ukončena. Pacient byl v dubnu 2015 převeden na terapii ustekinumabem v dá
a adalimumabem v dávce 40 mg každé dva týdny byla zahájena v prosinci 2013 (PASI 18, BSA 35 %), po dvou měsících léčby došlo k poklesu PASI na 3,4 a BSA na 4 %. Po přechodném zlepšení postupně docházelo ke zhoršování psoriatických projevů, v srpnu 2014 dosáhla hodnota PASI 9,5 a hodnota BSA 10 %. Aplikační schéma adalimumabu bylo zkráceno na 40 mg 1× týdně, bez výraznějšího účinku na klinické projevy psoriázy. V listopadu 2014 byla k biologické léčbě přidána fototerapie UVB 311 nm s frekvencí 2‒3× týdně, opět bez výraznějšího terapeutického přínosu. Zhoršování klinického stavu progredovalo, PASI a BSA dosáhly v březnu 2015 hodnoty 24,4, resp. 20 % (obr. 1, 2) a fototerapie byla ukončena. Krevními testy byly zjištěny protilátky proti adalimumabu a léčba tímto přípravkem byla ukončena. Pacient byl v dubnu 2015 převeden na terapii ustekinumabem v dá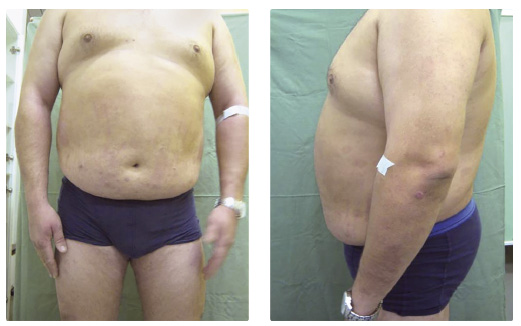 vce 90 mg. Po čtyřech týdnech od první aplikace došlo k poklesu PASI na 16,8, DLQI byl zaznamenán v hodnotě 2. Po čtyřech měsících léčby došlo ke zlepšení PASI na hodnotu 1,2 (o více než 90 %), BSA 1 %, pacient měl ojedinělá drobná, mírně infiltrovaná světle červená psoriatická ložiska bez zašupení pouze na končetinách, ostatní projevy byly zhojeny. Při poslední kontrole v prosinci 2016 byl nemocný pozitivně laděný, spokojený s přetrvávajícím účinkem terapie, hodnota PASI 1,2, BSA 1 % a DLQI 1 (obr. 3, 4). Léčba ustekinumabem bude pro výborný účinek pokračovat nadále. Pacienta se stále snažíme motivovat k redukci hmotnosti, zatím bez většího úspěchu.
vce 90 mg. Po čtyřech týdnech od první aplikace došlo k poklesu PASI na 16,8, DLQI byl zaznamenán v hodnotě 2. Po čtyřech měsících léčby došlo ke zlepšení PASI na hodnotu 1,2 (o více než 90 %), BSA 1 %, pacient měl ojedinělá drobná, mírně infiltrovaná světle červená psoriatická ložiska bez zašupení pouze na končetinách, ostatní projevy byly zhojeny. Při poslední kontrole v prosinci 2016 byl nemocný pozitivně laděný, spokojený s přetrvávajícím účinkem terapie, hodnota PASI 1,2, BSA 1 % a DLQI 1 (obr. 3, 4). Léčba ustekinumabem bude pro výborný účinek pokračovat nadále. Pacienta se stále snažíme motivovat k redukci hmotnosti, zatím bez většího úspěchu.
Diskuse
Klinická účinnost, bezpečnost a snášenlivost ustekinumabu byla hodnocena ve dvou multicentrických studiích PHOENIX 1 a PHOENIX 2. V obou případech se jednalo o randomizované, placebem kontrolované dvojitě zaslepené studie ve fázi III a bylo do nich zařazeno celkem 1 996 pacientů. Závěry studií ukazují vysokou účinnost s vyrovnanou a přetrvávající klinickou odpovědí a zachování dlouhodobého terapeutického přínosu přípravku během tříletého sledování [9,10].
Dále byla provedena srovnávací multicentrická randomizovaná studie ACCEPT, která hodnotila účinnost ustekinumabu ve srovnání s etanerceptem ve 12. týdnu. Účinnost ustekinumabu byla vyšší než účinnost etanerceptu, ve 12. týdnu dosáhlo hodnoty PASI 75 celkem 68 % pacientů s dávkou 45 mg ustekinumabu, 74 % pacientů s dávkou 90 mg ustekinumabu ve srovnání s 57 % pacientů léčených etanerceptem [11].
Účinnost ustekinumabu byla rovněž sledována u nemocných s psoriatickou artritidou. Jednalo se o srovnávací randomizované studie PSUMMIT 1 (v 16. týdnu) a PSUMMIT 2 (ve 24. týdnu), které byly kontrolovány placebem. Výsledky obou studií ukázaly vyšší podíl responderů ve skupině aplikující ustekinumab ve srovnání s placebem [12].
Ustekinumab je indikován k léčbě středně těžké až těžké plakové psoriázy i u dospívajících pacientů ve věku od 12 let, kteří nereagují na jiné systémové přípravky nebo na fototerapii či tuto léčbu netolerují. Doporučená dávka závisí na tělesné hmotnosti. U pacientů s hmotností nižší než 60 kg se podává 0,75 mg/kg ustekinumabu, při hmotnosti nad 60 kg se podává stejná dávka jako u dospělých pacientů, také dávkovací schéma je totožné [6]. Přípravek je dále indikován k léčbě dospělých pacientů se středně těžkou až těžkou aktivní Crohnovou chorobou, u nichž nenastala dostatečná odpověď na konveční terapii nebo na léčbu antagonisty TNFα či kteří tuto léčbu netolerovali, popř. jsou u nich tyto terapie kontraindikovány [6].
Závěr
Ustekinumab se ukázal být účinným v léčbě středně těžké a těžké psoriázy. Přípravek je indikován u pacientů s psoriázou, kteří nereagují na konvenční systémovou léčbu nebo ji netolerují. Ustekinumab je dobře snášen a snadno se aplikuje, díky výhodnému dávkovacímu schématu vykazuje velmi dobrou compliance pacientů.
Seznam použité literatury
- [1] Nestle FO, Kaplan DH, Barker J. Psoriasis. N Engl J Med 2009; 361: 496–509.
- [2] Christophers E. Comorbidites in psoriasis. J Eur Acad Dermatol Venerol 2006; 20: 52–55.
- [3] Menter A, Korman NJ, Elmets CA, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis. Section 6. Guidelines of care for the treatment psoriasis and psoriatic arthritis: Case‑based presentations and evidence‑based conclusions. J Am Acad Dermatol 2011; 65: 134–174.
- [4] Benson JM, Peritt D, Scallon BJ, et al. Discovery and mechanism of ustekinumab. MAbs 2011; 3: 535–545.
- [5] Benáková N. Ustekinumab v celkové léčbě psoriázy. Farmakoterapie 2009; 5: 249–356.
- [6] SPC STELARA, Státní ústav pro kontrolu léčiv: Databáze léků [online]. Dostupné na: http://www.sukl.cz/modules/medication/detail.php?code=0500964
- [7] Smith CH, Anstey AV, Barker JN, et al. British Association of Dermatologists’ guidelines for biologic interventions for psoriasis 2009. Br J Dermatol 2009; 161: 987–1019.
- [8] Nast A, Boehncke WH, Mrowietz U, et al. S3 – Guidelines on the treatment of psoriasis vulgaris. Update 2011. JDDG 2011; 9(Suppl 2): 1–95.
- [9] Leonardi C, Kimball AB, Papp KA, et al. Efficacy and safety of ustekinumab, a human interleukin‑12/23 monoclonal antibody, in patients with psoriasis: 76‑week results from a randomised, double‑blind, placebo‑controlled trial (PHOENIX 1). Lancet 2008; 371: 1665–1674.
- [10] Papp KA, Langley RG, Lebwohl M, et al. Efficacy and safety of ustekinumab, a human interleukin‑12/23 monoclonal antibody, in patients with psoriasis: 52‑week results from a randomised, double‑blind, placebo‑controlled trial (PHOENIX 2). Lancet 2008; 371: 1675–1684.
- [11] Griffiths CEM, Strober BE, van de Kerkhof P, et al. Comparison of ustekinumab and etanercept for moderate‑to‑severe psoriasis. N Engl J Med 2010; 362: 118–128.
- [12] Gottlieb A, Menter A, Mendelsohn A, et al. Ustekinumab, a human interleukin‑12/23 monoclonal antibody for psoriatic arthritis: randomised, double‑blind, placebo‑controlled, cross‑over trial. Lancet 2009; 373: 633–640.