Vericiguat v léčbě pacientů se symptomatickým srdečním selháním se sníženou ejekční frakcí: současné poznatky a perspektiva do budoucna
Souhrn:
Miklík R. Vericiguat v léčbě pacientů se symptomatickým srdečním selháním se sníženou ejekční frakcí: současné poznatky a perspektiva do budoucna. Remedia 2022; 32: 84–89.
Významná morbidita a mortalita spojené se srdečním selháním se sníženou ejekční frakcí levé komory (HFrEF) jsou důvodem k hledání nových terapeutických modalit. Signální dráha vedoucí k aktivaci cyklického guanosinmonofosfátu (cGMP) interakcí oxidu dusnatého (NO) a solubilní guanylátcyklázy (sGC) hraje důležitou roli v regulaci kardiovaskulárních funkcí. Snížená dostupnost NO vlivem přítomnosti chronického zánětu a zvýšeného oxidativního stresu, které jsou časté u srdečního selhání, způsobuje deficit cGMP, který v konečném důsledku vede k fibróze a remodelaci myokardu, k poškození kardiomyocytů, omezení vazodilatace a ke zvýšení neurohumorální aktivace. Stimulátor sGC vericiguat zvyšuje citlivost sGC na endogenní NO. Explorativní studie fáze II SOCRATES‑REDUCED doložila u pacientů s progresí srdečního selhání, kteří užívali dávku 5–10 mg vericiguatu denně, dobrou toleranci léčby a snížení hodnot NT‑proBNP v průběhu 12 týdnů. Následovala klinická studie fáze III VICTORIA, která potvrdila klinickou bezpečnost a účinnost vericiguatu u pacientů s nedávnou dekompenzací HFrEF. Podrobnější rozbor těchto studií a náhled na perspektivu vericiguatu jako dalšího nadějného léku pro léčbu manifestního systolického srdečního selhání je předmětem tohoto souhrnného článku.
Summary:
Miklik R. Vericiguat in the treatment of patients with symptomatic heart failure with decreased ejection fraction: current knowledge and future perspectives. Remedia 2022; 32: 84–89.
The significant morbidity and mortality associated with heart failure with reduced left ventricular ejection fraction (HFrEF) justify the search for new therapeutic agents. The signalling pathway leading to cyclic guanosine monophosphate (cGMP) activation by nitric oxide (NO) and soluble guanylate cyclase (sGC) interaction plays an important role in the regulation of cardiovascular function. Decreased NO availability due to the presence of chronic inflammation and increased oxidative stress, which is common in heart failure, causes cGMP deficiency that ultimately leads to myocardial fibrosis and remodelling, cardiomyocyte damage, decreased vasodilation and increased neurohumoral activation. The sGC stimulator vericiguat sensitises sGC to endogenous NO. A phase II exploratory study, the SOCRATES‑REDUCED trial, found good tolerance to vericiguat and a reduction in NT‑proBNP levels over 12 weeks of follow‑up in patients with progressive heart failure taking 5–10 mg of vericiguat daily. Followed by a phase III clinical study, the VICTORIA trial, the results confirmed the clinical safety and efficacy of vericiguat in patients with recently decompensated HFrEF. A more detailed analysis of these studies and an insight into the future perspective of vericiguat as another promising drug for the treatment of manifest systolic heart failure is the subject of this review article.
Key words: vericiguat, heart failure with reduced ejection fraction, soluble guanylate cyclase, hospitalisation, mortality.
Úvod k farmakologii srdečního
selhání se sníženou ejekční frakcí levé komory
Epidemiologická data z multicentrického českého registru akutního srdečního selhání AHEAD (Acute HEArt failure Database) potvrdila závěry jiných evropských registrů, že morbidita a mortalita pacientů se srdečním selháním jsou i přes progresivně se zlepšující léčebné postupy vysoké. V průběhu dvouletého sledování pacienti se srdečním selháním se sníženou ejekční frakcí (heart failure with reduced ejection fraction, HfrEF), kteří přežili úvodní hospitalizaci pro de novo srdeční selhání nebo dekompenzaci již známého srdečního selhání, umírali v 82,4 % případů z kardiovaskulárních příčin, 28,6 % nemocných bylo minimálně jednou rehospitalizováno pro dekompenzaci srdečního selhání a 53,1 % pacientů bylo buď rehospitalizováno pro srdeční selhání, nebo zemřelo. Celková mortalita dosáhla 37,8 %; pouze třetina nemocných přežila dva roky bez jakékoliv hospitalizace. Nejvyšší výskytvyšší výskyt rehospitalizací pro srdeční selhání a kardiovaskulárních příhod byl zaznamenáno v prvních 3−6 měsících po propuštění [1].
I z těchto ryze českých dat z let 2006−2012 vyplývá, že je nutné hledat další léčebné možnosti, které by kvalitu života i prognózu nemocných s HFrEF zlepšily. Základem chronické léčby těchto pacientů byla po mnoho let triáda betablokátor, inhibitor angiotenzin konvertujícího enzymu (ACEI) nebo blokátor receptoru pro angiotenzin II (sartan) a inhibitor mineralokortikoidního receptoru spironolakton. Až v roce 2010 byla publikována studie SHIFT s blokátorem If kanálu sinoatriálního uzlu ivabradinem, který dále zlepšil prognózu nemocných s těžkou systolickou dysfunkcí levé komory a přetrvávající vyšší tepovou frekvencí [2]. Od října 2017 je v České republice na základě výsledků studie PARADIGM HF [3] v léčbě nemocných s HFrEF schválen supramolekulární komplexní přípravek sakubitril/valsartan (léková skupina Angiotensin Receptor Neprilysin Inhibitor, ARNI). V listopadu 2020 Evropská léková agentura schválila indikaci dapagliflozinu (na základě studie DAPA HF [4]) jako prvního zástupce ze skupiny inhibitorů sodíko glukózového kotransportéru 2 (SGLT2, glifloziny) v léčbě symptomatického HFrEF. Všechny tyto léky prokázaly snížení mortality pacientů, proto by se kombinace těchto přípravků měla stát pilířem moderní terapie nemocných s HFrEF [5].
Neustálou výzvou v léčbě pacientů s HFrEF je individualizace a cílení kombinační terapie za účelem dosažení co nejlepší kvality života, snížení počtu rehospitalizací, zlepšení dlouhodobé prognózy a také omezení nežádoucích účinků. Nejvíce limitujícími faktory, které zabraňují nasazení nových léčiv nebo uptitraci dávek již zavedených léků, jsou progresivní zhoršování renálních funkcí a hypotenze. V tomto ohledu představují velkou naději právě glifloziny, které jsou nefroprotektivní a mají zanedbatelný vliv na krevní tlak. Nejsou ovšem jediné. Dosud posledním lékem, kterému udělila Evropská léková agentura v červenci 2021 indikaci pro léčbu chronického HFrEF s nedávnou dekompenzací a nutností hospitalizace nebo intravenózní diuretické terapie, je stimulátor solubilní guanylátcyklázy (sGC) vericiguat. Tato molekula byla vyvinuta tak, aby na rozdíl od svého předchůdce cinaciguatu, jehož účinek je spojen s významným rizikem hypotenze [6], nebo krátce působícího riociguatu [7] mohla být užívána jednou denně a měla zanedbatelný hypotenzní efekt, minimum lékových interakcí a mohla být aplikována pacientům s renální insuficiencí.
Další statě tohoto článku budou zaměřeny na mechanismus účinku vericiguatu, na výsledky klinických studií, které byly dosud s tímto přípravkem u HFrEF pacientů provedeny, a na další perspektivy do budoucna.
Mechanismus účinku
a farmakokinetika vericiguatu
Oxid dusnatý (NO) je při správné funkci endotelu vytvářen endoteliální NO syntázou na podkladě kontaktu laminárního proudu krve s výstelkou cév. NO difunduje do okolních buněk, kde aktivuje sGC k tvorbě cyklického guanosinmonofosfátu (cGMP), který dále prostřednictvím aktivace proteinkinázy G fosforyluje proteiny zapojené v srdci a cévách do mechanismů, jež zlepšují diastolickou relaxaci, optimalizují koronární a renální průtok, brání rozvoji zánětu, hypertrofii a fibróze myokardu jako reakci na srdeční poškození [8]. Vericiguat přímo stimuluje sGC prostřednictvím vazebného místa nezávislého na NO a také zvyšuje citlivost sGC na endogenně produkovaný NO. Vzhledem k tomu, že receptory pro srdeční natriuretické peptidy (ANP, BNP), které zprostředkovávají jejich biologické účinky, jsou také spjaty s aktivitou GC, někteří autoři spekulují, že aktivátor signální dráhy NO sGC cGMP by mohl pozitivně ovlivnit rezistenci na natriuretické peptidy, která doprovází syndrom srdečního selhání, a tím zlepšit jejich působení v cílových tkáních [9].
Inaktivace cGMP na GMP probíhá v srdci za účasti různých izoforem enzymu fosfodiesterázy (PDE). Některé z inhibitorů PDE jsou farmakologicky využívány v léčbě akutního srdečního selhání (např. inhibitory PDE3 enoximon, milrinon) nebo jsou zodpovědné za pozitivní kardiální a cévní účinky při primárně jiné indikaci (inhibitory PDE5 typu sildenafil, tadalafil aj.).
Farmakokinetický profil vericiguatu je pro nemocné velmi příznivý. Dávkování při biologickém poločasu 18−30 hodin je stanoveno na jednou denně, obvykle ráno, maximální účinné koncentrace v plazmě je dosaženo za 2−4 hodiny v závislosti na užití bez jídla nebo s jídlem. Užívání s jídlem je doporučeno, protože biologická dostupnost vericiguatu se zvyšuje a zároveň je méně proměnlivá. Nebyly zjištěny žádné interakce na cytochromu P450 nebo v transportních proteinech, protože biotransformace vericiguatu probíhá glukuronidací. Vylučován je rovnoměrně močí a stolicí [10]. Tyto vlastnosti předurčují vericiguatu velmi nízký potenciál k interakcím s jinými léčivy, což bylo potvrzeno v mnoha studiích fáze I [11].
Klinické studie SOCRATES REDUCED
a VICTORIA
Vericiguat byl u nemocných
s HFrEF testován oproti placebu ve dvou klinických
studiích SOCRATES REDUCED [12] a VICTORIA [13,14]. Jejich
uspořádání a výsledky efektivity a bezpečnosti
stručně shrnuje tabulka 1. Vstupní kritéria si byla
v mnohém podobná. Obě studie cílily na velmi rizikové
pacienty se srdečním selháním a s ejekční frakcí
levé komory sníženou na méně než 45 %, kteří prodělali
nedávnou hospitalizaci pro dekompenzaci srdečního selhání
(SOCRATES REDUCED: do 4 týdnů; VICTORIA: do 6
měsíců) nebo vyžadovali intravenózní diuretikum v ambulantním
režimu (SOCRATES REDUCED: do 4 týdnů; VICTORIA: do 3
měsíců). Dále bylo nutné splnit limit pro hodnotu některého
ze dvou natriuretických peptidů: BNP ≥ 300 ng/l
(≥ 500 ng/l při fibrilaci síní na EKG) nebo
N terminálního konce natriuretického propeptidu typu B
(NT proBNP) ≥ 1 000 ng/l (≥ 1 600 ng/l
při fibrilaci síní na EKG). Ze studie SOCRATES REDUCED
byli vyloučeni pacienti s glomerulární
filtrací < 30 ml/min/1,73 m2
a systolickým krevním tlakem < 110 mm Hg;
následující studie VICTORIA již zařazovala pacienty
s glomerulární filtrací ≥ 15 ml/min/1,73 m2
a systolickým tlakem ≥ 100 mm Hg.
Klinická studie SOCRATES REDUCED
SOCRATES REDUCED byla studie fáze II, jejímž hlavním cílovým ukazatelem byla změna hladiny NT proBNP mezi vstupní hodnotou a hodnotou na konci 12týdenního sledování. Ostatní echokardiografické, klinické i bezpečnostní cílové ukazatele byly pouze explorativní. Pacienti byli randomizováni do čtyř větví s vericiguatem (cílové maximální denní dávky 1,25 mg, 2,5 mg, 5 mg a 10 mg) a do kontrolní větve s placebem. Celkem 77 % pacientů dokončilo 12týdenní sledování a z těch, kteří byli randomizováni k postupné uptitraci do dávky 10 mg denně, jich 72 % této dávky dosáhlo. Hlavním závěrem studie bylo zjištění, že změna logaritmicky transformovaného NT proBNP na konci 12. týdne sledování se v souhrnu významně nelišila mezi pacienty užívajícími lék a placebo (p = 0,15). Nicméně, podrobnější subanalýza ukázala, že mezi větví s nejvyšší dávkou vericiguatu a placebem významný rozdíl existoval (p = 0,048). Pacienti léčení touto dávkou také vykazovali významné zlepšení ejekční frakce levé komory oproti placebu (+3,68 % vs. +1,52 %, p = 0,02). V analýze biomarkerů bylo prokázáno významné snížení sérových koncentrací C reaktivního proteinu a kyseliny močové u pacientů léčených vericiguatem, a to v závislosti na zvyšující se dávce léku. Stran bezpečnosti nebyl zaznamenán rozdíl v systolickém ani diastolickém krevním tlaku mezi terapií vyššími dávkami vericiguatu (5−10 mg) a placebem. Celkový počet nežádoucích příhod a počet závažných nežádoucích příhod během studie byl u těchto lékových větví dokonce numericky nižší než u pacientů užívajících placebo (vericiguat 5 mg: 73,6 % a 26,4 %; vericiguat 10 mg 71,4 % a 31,9 %; placebo 77,2 % a 39,1 %).
Klinická studie VICTORIA
Na základě výsledků studie fáze II byla do klinické studie fáze III VICTORIA zvolena cílová dávka vericiguatu 10 mg jedenkrát denně. Nábor nemocných probíhal od září 2016 do prosince 2018 v 616 centrech situovaných ve 42 zemích. Celkem bylo zařazeno 5 050 pacientů s HFrEF, z nichž 76 % tvořili muži, průměrný věk zařazených pacientů byl 67 let, medián NT proBNP 2 816 ng/l a průměrná ejekční frakce levé komory 29 %. Základní „triple terapii“ srdečního selhání (betablokátor + spironolakton + ACEI/sartan nebo sakubitril/valsartan) mělo při vstupu do studie 60 % subjektů, implantovaný kardioverter defibrilátor 28 % a biventrikulární stimulátor 15 % nemocných. Nejen tyto vstupní charakteristiky, ale také fakt, že 40 % pacientů bylo ve funkční třídě NYHA III a u dvou třetin nemocných došlo k hospitalizaci pro dekompenzaci srdečního selhání v posledních třech měsících, zřetelně potvrzovaly vysokou rizikovost zařazené populace s předpokladem vyššího počtu cílových ukazatelů než v jiných studiích. Pacienti byli randomizováni v poměru 1 : 1 do větve s léčbou vericiguatem v iniciální dávce 2,5 mg denně s postupnou dvoutýdenní uptitrací na 5 mg a poté na maximální dávku 10 mg denně (dosažena v 89 % případů) a do větve s odpovídajícím podáváním placeba. Medián sledování ve studii byl 10,8 měsíce a adherence ke studijní medikaci byla velmi dobrá (minimálně 80 % léčiva užilo 94 % pacientů).
Incidence primárního klinického
ukazatele studie – kombinace kardiovaskulárního úmrtí/první
hospitalizace pro srdeční selhání – byla významně nižší
ve větvi s vericiguatem než u placeba (35,5 % vs.
38,5 %, poměr rizik [hazard ratio, HR] 0,90, 95% interval
spolehlivosti [confidence interval, CI] 0,82−0,98, p = 0,019,
graf 1). Výskyt sekundárních cílových ukazatelů
zaznamenal významný rozdíl v počtu všech hospitalizací pro
srdeční selhání (1 223 vs. 1 336, HR 0,91, 95% CI 0,84–0,99,
p = 0,02) a počtu všech úmrtí/první
hospitalizace pro srdeční selhání (37,9 % vs. 40,9 %, HR
0,90, 95% CI 0,83−0,98, p = 0,02). Samotná
kardiovaskulární mortalita nebo celková mortalita nebyly
vericiguatem oproti placebu statisticky významně ovlivněny.
Tolerance vericiguatu byla podobně jako ve studii
SOCRATES REDUCED velmi dobrá a celkový výskyt
symptomatické hypotenze (9,1 % vs. 7,9 %), synkopy (4,0 % vs.
3,5 %) či jiných závažných událostí (32,8 % vs. 34,8 %)
nebyl zkoumaným lékem ovlivněn.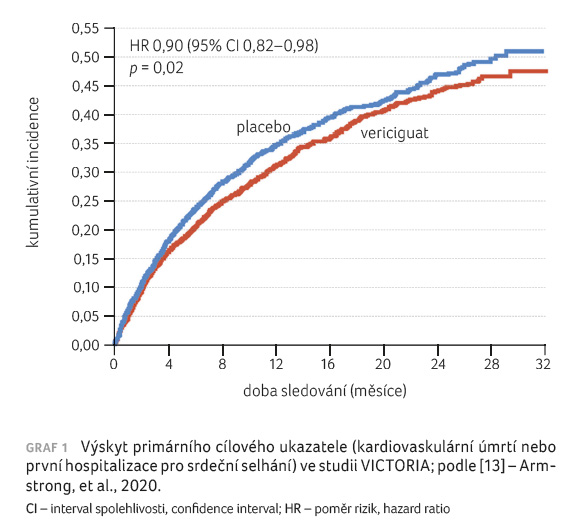
Subanalýzy studie VICTORIA
I přes konzistenci výsledků při analýze podskupin dle ejekční frakce, renálních funkcí, funkční třídy NYHA, hodnot krevního tlaku nebo podle konkomitantní medikace vyšly najevo při následných podrobnějších analýzách některé zajímavé skutečnosti, které budou zohledněny v dalším klinickém vývoji vericiguatu u pacientů s HFrEF.
Analýza podskupin dle vstupních hodnot natriuretických peptidů zjistila, že vericiguat byl nejefektivnější u stabilizovaných pacientů s hodnotou NT proBNP ≤ 4 000 ng/l. U těchto pacientů bylo dosaženo redukce výskytu primárního cílového ukazatele o 23 % (HR 0,77, 95% CI 0,68−0,88). Přínos ve smyslu snížení kardiovaskulární mortality/první hospitalizace pro srdeční selhání byl ještě zachován u pacientů se vstupní hodnotou NT proBNP ≤ 8 000 ng/l (HR 0,85, 95% CI 0,76−0,95); u nemocných s hodnotami > 8 000 ng/l již přínos vericiguatu pozorován nebyl (HR 1,16, 95% CI 0,94−1,41). Tito nemocní byli starší, s nižším zastoupením „triple terapie“ srdečního selhání, s horšími renálními funkcemi a kratším odstupem od primární hospitalizace pro srdeční selhání [15]. Z předchozích publikovaných studií víme, že prognóza pacientů s HFrEF a hodnotami NT proBNP > 1 000 ng/l při plné terapii včetně ARNI je všeobecně špatná [16] a progresivně se zhoršuje s narůstající hodnotou NT proBNP [17]. Uptitrace medikace s cílem snížit hodnoty NT proBNP a tím zlepšit prognózu nemocných se oproti předpokladům minula účinkem v randomizované studii [18]. Logicky tedy vyplývá, že ovlivnit osud nemocných s „příliš“ vysokými hodnotami NT proBNP bude i do budoucna obtížné, a to pro jakýkoliv nový přípravek. Jak ukázala tato subanalýza, celkové 10% snížení výskytu primárního cílového ukazatele v celkové populaci studie VICTORIA není v kontextu s výsledky studií s ARNI nebo glifloziny nijak ohromující, ale nutno vzít v potaz rozdílnou rizikovost zařazených pacientů, kterou vyjadřují mediány vstupních hodnot NT proBNP (VICTORIA [vericiguat] – 2 816 ng/l, PARADIGM HF [sakubitril/valsartan] – 1 615 ng/l, DAPA HF [dapagliflozin] – 1 437 ng/l) nebo počty sledovaných událostí v placebovém rameni (VICTORIA – 37,8/100 pacientoroků, PARADIGM HF – 13,2/100 pacientoroků, DAPA HF – 15,6/100 pacientoroků) [3,4,13]. Přímo se tedy nabízí otázka, jak by si vedl vericiguat u méně rizikové populace zkoumané v jiných studiích.
Při analýze změn renálních funkcí nebyly zjištěny rozdíly mezi léčenou a kontrolní skupinou pacientů ani žádná asociace mezi hodnotou glomerulární filtrace a efektivitou léčby vericiguatem. Významný rozdíl byl ale nalezen ve výskytu nově zjištěné anémie, a to v neprospěch léčby vericiguatem (284 [13,6 %] vs. 219 [10,5 %], p < 0,001) již po 16 týdnech léčby. Dobrou zprávou je, že v dalším průběhu studie až do 96. týdne anémie neprogredovala a jen výjimečně byla hlášena jako závažná nežádoucí příhoda. Nebyla zjištěna souvislost mezi hodnotou hemoglobinu a efektivitou podávání vericiguatu a výskyt cílových ukazatelů v obou větvích studie narůstal se snižující se hodnotou hemoglobinu (u pacientů s koncentrací hemoglobinu < 150 mg/l) [14]. Z předchozích prací víme, že anémie je častým nálezem u nemocných se srdečním selháním a má multifaktoriální původ [19,20]. Ve studii VICTORIA ji měla třetina pacientů při randomizaci a nejčastěji byla anémie nově diagnostikována u pacientů s nižší normální hodnotou hemoglobinu (tedy již klinicky nevýznamný pokles koncentrace hemoglobinu o méně než 10 % je „kvalifikoval“ jako subjekty s de novo anémií dle kritérií Světové zdravotnické organizace). Vysvětlení pro významně častější anémii ve větvi s vericiguatem dosud nemáme, spekuluje se i o možnosti zvýšeného „odklízení“ starých poškozených erytrocytů vlivem modulace sGC. Zvýšené krvácení, hemolýza, elevace hodnot zánětlivých markerů nebo efekt na funkci kostní dřeně nebyly ve studii VICTORIA prokázány [14]. V dalším klinickém vývoji je nutné se na problematiku anémie při léčbě vericiguatem zaměřit a dále studovat možné interakce mezi modulátory signální cesty NO sGC cGMP a hemoglobinem.
Na závěr si zaslouží zmínku subanalýza efektivity vericiguatu s ohledem na časový odstup od kvalifikující srdeční dekompenzace po randomizaci. V českém registru akutního srdečního selhání AHEAD [1] nebo i v klinické studii s ARNI [21] měli nejvíce rehospitalizací nebo kardiovaskulárních úmrtí pacienti v prvních měsících po propuštění z nemocnice. S delším odstupem od hospitalizace pro dekompenzaci selhání se pacient stává stabilnějším a pravděpodobnost vzniku nežádoucí události klesá. Jak již bylo popsáno v úvodní části, pacienti mohli být do studie zařazeni do šesti měsíců od hospitalizace pro srdeční selhání nebo do tří měsíců od ambulantně léčené dekompen
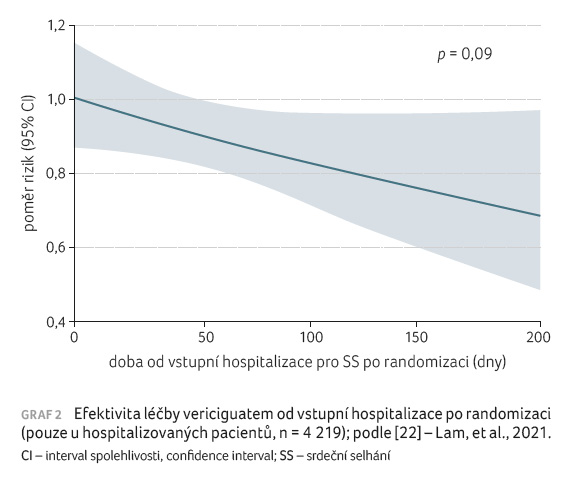
zace s nutností intravenózní aplikace kličkového diuretika. Byly tedy vytvořeny tři skupiny pacientů: 1. méně než tři měsíce od vstupní hospitalizace pro dekompenzaci městnání, 2. tři až šest měsíců od vstupní hospitalizace pro dekompenzaci městnání a 3. skupina s intravenózní aplikací diuretika bez hospitalizace. Výskyt primárního cílového ukazatele byl 40,9, 29,6 a 23,4 na 100 pacientoroků (srovnání 1. a 3. skupiny: HR 1,48, 95% CI 1,27−1,73), což jen potvrdilo předchozí známá fakta. Nicméně v analýze efektivity vericiguatu byl zjištěn kontinuální trend (p = 0,09) ve snížení počtu sledovaných událostí při zahájení terapie s delším časovým odstupem od vstupní dekompenzace městnání (graf 2). Sami autoři naznačují důležitost tohoto zjištění pro budoucí plánování klinických studií u rizikových nemocných s HFrEF [22].
Budoucí perspektivy vývoje vericiguatu
Studie SOCRATES REDUCED a VICTORIA poskytly cenné informace o účinnosti (laboratorní i klinické), bezpečnosti a dobré toleranci vericiguatu u pacientů s HFrEF léčených moderní farmakoterapií. Ve srovnání s jinými recentními farmakologickými studiemi zaměřenými na glifloziny či ARNI se výsledky studií s vericiguatem nezdají nijak oslnivé. Nicméně opak může být pravdou − nelze totiž srovnávat nesrovnatelné. Nepřímé porovnání účinnosti léků je sice možné například pomocí síťové metaanalýzy, která již v tomto případě byla provedena a nezjistila rozdíl v efektivitě gliflozinů, ARNI a vericiguatu na redukci výskytu kombinovaného cílového ukazatele kardiovaskulárního úmrtí nebo hospitalizace pro srdeční selhání [23], ale práce tohoto typu mají mnoho limitací (délka sledování ve studiích, různá rizikovost populace, odlišná vstupní kritéria atd.) a jsou spíše orientačního charakteru. Také neposkytují informace o efektivitě kombinací zkoumaných léků, i když lze předpokládat jejich synergické působení. Subanalýzy studie VICTORIA definovaly subpopulace pacientů s HFrEF, u kterých je předpoklad větší efektivity vericiguatu, a také možná úskalí této léčby (např. anémie). Proto byla navržena další randomizovaná, placebem kontrolovaná zaslepená multicentrická studie fáze III VICTOR (NCT05093933), která je zaměřena na pacienty s HFrEF s ejekční frakcí levé komory < 40 %, s hodnotou NT proBNP při vstupu v rozmezí 600−6 000 ng/l (respektive 900−6 000 ng/l při fibrilaci síní), s odstupem od předchozí hospitalizace pro srdeční selhání minimálně šest měsíců a se stabilními dávkami „triple terapie“ srdečního selhání minimálně čtyři týdny. Studie počítá minimálně s 30% zastoupením ARNI a 15% zastoupením gliflozinů v zavedené farmakoterapii, aby bylo možné posoudit efektivitu kombinací léků. Primární cílové ukazatele studie jsou obdobné jako ve studii VICTORIA, očekává se delší doba sledování při snížení celkové rizikovosti nemocných. Důraz je kladen na sledování výskytu hypotenze, synkop (při kombinaci s dalšími léky) a již zmíněné anémie [24]. První pacient byl do studie zařazen v listopadu 2021, v České republice proběhl screening první pacientky 16. prosince 2021. Výsledky studie jsou očekávány v roce 2025.
Závěr
Stimulátor sGC vericiguat je novým nadějným lékem pro nemocné se systolickým srdečním selháním. Na základě výsledků studie VICTORIA byl americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) v lednu 2021 schválen k užívání a v červenci 2021 přijala kladné stanovisko k jeho registraci také Evropská léková agentura. Vericiguat má minimum lékových interakcí, dle dostupných dat nezvyšuje riziko hypotenze a synkopálních stavů, v plné dávce 10 mg denně snižuje hodnoty NT proBNP a redukuje riziko kardiovaskulárního úmrtí nebo hospitalizace pro srdeční selhání u nejrizikovější populace nemocných s HFrEF, včetně pacientů s pokročilou renální insuficiencí. Své definitivní místo v léčbě srdečního selhání, kde nyní dominují glifloziny a sakubitril/valsartan, si musí ale ještě vydobýt. Předpoklady k tomu má dostatečné. Ty mohou dále podpořit výsledky právě probíhající randomizované studie.
Seznam použité literatury
- [1] Miklik R, Miklikova M, Spacek R, et al. Differences in risk profiles and long‑term outcomes in acute heart failure patients with preserved and reduced left ventricular ejection fraction in the Czech Republic: The AHEAD registry sub‑analysis. Biomedical Papers 2021; 165: 34–42.
- [2] Swedberg K, Komajda M, Böhm M, et al. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo‑controlled study. Lancet 2010; 376: 875–885.
- [3] McMurray JJV, Packer M, Desai AS, et al. Angiotensin‑neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371: 993–1004.
- [4] McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med 2019; 381: 1995–2008.
- [5] McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42: 3599–3726.
- [6] Gheorghiade M, Greene SJ, Filippatos G, et al. Cinaciguat, a soluble guanylate cyclase activator: results from the randomized, controlled, phase IIb COMPOSE programme in acute heart failure syndromes. Eur J Heart Fail 2012; 14: 1056–1066.
- [7] Bonderman D, Ghio S, Felix SB, et al. Riociguat for patients with pulmonary hypertension caused by systolic left ventricular dysfunction: a phase IIb double‑blind, randomized, placebo‑controlled, dose‑ranging hemodynamic study. Circulation 2013; 128: 502–511.
- [8] Breitenstein S, Roessig L, Sandner P, Lewis KS. Novel sGC Stimulators and sGC Activators for the Treatment of Heart Failure. Handb Exp Pharmacol 2017; 243: 225–247.
- [9] Aimo A, Castiglione V, Vergaro G, et al. The place of vericiguat in the landscape of treatment for heart failure with reduced ejection fraction. Heart Fail Rev 2021. Dostupné na: https://doi.org/10.1007/s10741‑021‑10146‑1.
- [10] Souhrn údajů o přípravku Verquvo 2,5 mg. Dostupné na: https://www.medicines.org.uk/emc/product/12773/smpc#PHARMACOKINETIC_PROPS
- [11] Boettcher M, Gerisch M, Lobmeyer M, et al. Metabolism and Pharmacokinetic Drug‑Drug Interaction Profile of Vericiguat, A Soluble Guanylate Cyclase Stimulator: Results From Preclinical and Phase I Healthy Volunteer Studies. Clin Pharmacokinet 2020; 59: 1407–1418.
- [12] Gheorghiade M, Greene SJ, Butler J, et al. Effect of Vericiguat, a Soluble Guanylate Cyclase Stimulator, on Natriuretic Peptide Levels in Patients With Worsening Chronic Heart Failure and Reduced Ejection Fraction: The SOCRATES‑REDUCED Randomized Trial. JAMA 2015; 314: 2251–2262.
- [13] Armstrong PW, Pieske B, Anstrom KJ, et al. Vericiguat in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med 2020; 382: 1883–1893.
- [14] Ezekowitz JA, Zheng Y, Cohen‑Solal A, et al. Hemoglobin and Clinical Outcomes in the Vericiguat Global Study in Patients With Heart Failure and Reduced Ejection Fraction (VICTORIA). Circulation 2021; 144: 1489–1499.
- [15] Ezekowitz JA, O’Connor CM, Troughton RW, et al. N‑Terminal Pro‑B‑Type Natriuretic Peptide and Clinical Outcomes: Vericiguat Heart Failure With Reduced Ejection Fraction Study. JACC Heart Fail 2020; 8: 931–939.
- [16] Zile MR, Claggett BL, Prescott MF, et al. Prognostic Implications of Changes in N‑Terminal Pro‑B‑Type Natriuretic Peptide in Patients With Heart Failure. J Am Coll Cardiol 2016; 68: 2425–2436.
- [17] Savarese G, Orsini N, Hage C, et al. Utilizing NT‑proBNP for Eligibility and Enrichment in Trials in HFpEF, HFmrEF, and HFrEF. JACC Heart Fail 2018; 6: 246–256.
- [18] Felker GM, Anstrom KJ, Adams KF, et al. Effect of Natriuretic Peptide–Guided Therapy on Hospitalization or Cardiovascular Mortality in High‑Risk Patients With Heart Failure and Reduced Ejection Fraction: A Randomized Clinical Trial. JAMA 2017; 318: 713–720.
- [19] Anand IS, Gupta P. Anemia and Iron Deficiency in Heart Failure: Current Concepts and Emerging Therapies. Circulation 2018; 138: 80–98.
- [20] Miklík R, Felšöci M, Pařenica J, et al. The prevalence of anemia and its impact on hospitalization mortality in patients with acute heart failure. Vnitř Lék 2010; 56 382–391.
- [21] Solomon SD, Claggett B, Packer M, et al. Efficacy of Sacubitril/Valsartan Relative to a Prior Decompensation: The PARADIGM‑HF Trial. JACC Heart Fail 2016; 4: 816–822.
- [22] Lam CSP, Giczewska A, Sliwa K, et al. Clinical Outcomes and Response to Vericiguat According to Index Heart Failure Event: Insights From the VICTORIA Trial. JAMA Cardiol 2021; 6: 706–712.
- [23] Aimo A, Pateras K, Stamatelopoulos K, et al. Relative Efficacy of Sacubitril‑Valsartan, Vericiguat, and SGLT2 Inhibitors in Heart Failure with Reduced Ejection Fraction: a Systematic Review and Network Meta‑Analysis. Cardiovasc Drugs Ther 2021; 35: 1067–1076.
- [24] A Study of Vericiguat (MK‑1242) in Participants With Chronic Heart Failure With Reduced Ejection Fraction (HFrEF) (MK‑1242‑035) (VICTOR). https://www.clinicaltrials.gov/ct2/show/NCT05093933