Výsledky hodnocení osimertinibu u dosud neléčených nemocných s EGFR mutovaným pokročilým NSCLC: studie FLAURA
Souhrn:
Zemanová M. Výsledky hodnocení osimertinibu u dosud neléčených nemocných s EGFR mutovaným pokročilým NSCLC: studie FLAURA. Remedia 2018; 28: 364–369.
Osimertinib je ireverzibilní inhibitor tyrozinkinázy (TKI) třetí generace na receptoru epidermálního růstového faktoru (epidermal growth factor receptor, EGFR) vyvinutý tak, aby inhiboval senzibilizující mutace EGFR (deleci exonu 19 a L858R), předcházel vzniku mutace EGFR T790M, která je odpovědná za rezistenci, a měl minimální vliv na nemutovanou (wild‑type) formu EGFR. Osimertinib přechází přes nepoškozenou hematoencefalickou bariéru. U nemocných dříve léčených TKI a s rezistentní mutací T790M prokázal osimertinib lepší účinnost než chemoterapie a je standardem u předléčených pacientů. Na podkladě výsledků studie FLAURA se stal osimertinib novým standardem v první linii léčby u pokročilého nemalobuněčného plicního karcinomu (non‑small cell lung cancer, NSCLC) se senzibilizující mutací v genu pro EGFR (EGFRm NSCLC). Osimertinib dosáhl mimořádné hodnoty mediánu doby do progrese (progression free survival, PFS) v délce 18,9 měsíce ve srovnání s mediánem 10,2 měsíce ve skupině léčené EGFR-TKI komparátorem. Osimertinib vykázal shodný přínos z hlediska zlepšení PFS u všech předem specifikovaných podskupin, včetně pacientů s mozkovými metastázami. Osimertinib v plánované předběžné (interim) analýze celkového přežití (overall survival, OS) snížil riziko úmrtí o 37 % ve srovnání s EGFR-TKI komparátorem.
Summary:
Zemanova M. Results of the evaluation of osimertinib in previously non‑treated patients with EGFR‑mutated advanced NSCLC: FLAURA study. Remedia 2018; 28: 364–369.
Osimertinib is a third generation irreversible tyrosine kinase inhibitor (TKI) targeting epidermal growth factor receptor (EGFR) developed to inhibit sensitizing EGFR mutations (exon 19 deletion and L858R), prevent the occurrence of T790M mutation responsible for resistance and exert minimal effect on non‑mutated (wild‑type) EGFR form. Osimertinib crosses the intact hematoencephalic barrier. In patients previously treated with TKI together with resistant T790M mutation, osimertinib demonstrated better efficacy than chemotherapy and it became a standard therapeutic option in pre‑treated patients. Based on FLAURA study results, osimertinib became a new standard first‑line treatment in advanced non‑small cell lung cancer (NSCLC) with sensitizing mutation in EGFR gene (EGFRm NSCLC). Osimertinib reached outstanding median length of progression free survival (PFS) of 18.9 months in comparison with 10.2 months in the EGFR‑TKI comparator group. Osimertinib had comparable PFS improvement benefit in all pre‑specified subgroups, including patients with brain metastases. In a planned interim overall survival (OS) analysis, osimertinib decreased the mortality risk by 37% compared with EGFR-TKI comparator.
Key words: non‑small cell lung cancer, senzitizing mutation of EGFR, T790M mutation, osimertinib
Úvod
Většina pacientů s plicním karcinomem, který má ověřenou přítomnost senzibilizující mutace v genu pro receptor epidermálního růstového faktoru (epidermal growth factor receptor, EGFR), má prospěch z léčby některým ze tří nyní u nás dostupných tyrozinkinázových inhibitorů (TKI). I když malá část pacientů může být léčena bez progrese dva roky a déle, u naprosté většiny nemocných nastupuje neodvratně rezistence na gefitinib, erlotinib nebo afatinib s mediánem 9–13 měsíců při první linii léčby [1]. Nejčastější příčinou progrese u více než 50 % případů je vznik mutace T790M v genu pro EGFR, i když je možné, že ve skutečnosti jde o progresi primárně nedetekovaných T790M pozitivních nádorových buněk, které jsou rezistentní na TKI první a druhé generace [2]. Farmakologický výzkum přinesl nové molekuly umožňující blokádu maligního signálu i v přítomnosti této mutace. Jednou z nich je osimertinib, selektivní ireverzibilní TKI, který blokuje jak obvyklé aktivační mutace, tak rezistentní mutaci T790M [3].
Farmakologické vlastnosti osimertinibu
Osimertinib je ireverzibilní inhibitor EGFR se senzibilizujícími (také aktivačními) mutacemi (EGFRm) a s mutací T790M rezistentní k TKI. Ve studiích in vitro bylo prokázáno, že osimertinib má vysokou účinnost a inhibiční aktivitu proti EGFR u všech klinicky významných aktivačních mutací a u mutace T790M v buněčných liniích nemalobuněčného karcinomu plic (non small cell lung cancer, NSCLC). V buněčných liniích divokého typu (wild type) EGFR má osimertinib významně nižší aktivitu.
Po perorálním podání osimertinibu bylo dosaženo maximálních plazmatických koncentrací s mediánem šest hodin. Podávání osimertinibu jednou denně vede k přibližně trojnásobné kumulaci a rovnovážné expozice je dosaženo po 15 dnech užívání. Absolutní biologická dostupnost osimertinibu je 70 % a potrava ji neovlivňuje klinicky významným způsobem. V podmínkách in vitro je vazba osimertinibu na plazmatické bílkoviny 94,7 %. Studie in vitro prokázaly, že osimertinib je metabolizován převážně přes cytochrom P450 3A4 (CYP3A4) a 3A5 (CYP3A5), hlavní metabolickou cestou osimertinibu je oxidace a dealkylace. Osimertinib je vylučován převážně játry, a tedy u pacientů s poruchou funkce jater lze očekávat zvýšenou expozici, ale u nemocných s lehkou a střední poruchou funkce jater nebyla pozorována změna expozice oproti subjektům s normální jaterní funkcí. Osimertinib v dávce 80 mg může navodit prodloužení normalizovaného QT intervalu (QTc) průměrně o 14 ms s horní hranicí 16 ms. V preklinickém zkoumání u zvířat osimertinib vykazoval schopnost prostupovat přes neporušenou hematoencefalickou bariéru [4].
Osimertinib ve druhé linii léčby
Osimertinib prokázal svoji aktivitu u nemocných předléčených TKI, kteří měli v době progrese prokázanou mutaci T790M, s četností léčebných odpovědí 62‒70 % a s mediánem doby do progrese 9,9–12,3 měsíce [5,6] a při porovnání s chemoterapií [7] měl více než dvojnásobnou účinnost v četnosti odpovědí (71 % vs. 31 %) i v mediánu doby do progrese (10,1 měsíce vs. 4,4 měsíce). Na podkladě těchto výsledků je osimertinib registrován a podáván u pacientů s přítomností T790M mutace, většinou ve druhé nebo další linii léčby.
První linie léčby – výsledky studie FLAURA
Studie fáze I/II s osimertinibem
v první linii léčby EGFR mutovaných pokročilých NSCLC
prokázala účinnost v závislosti na testované dávce
s četností odpovědí 67‒87 % a s mediánem doby
do progrese 19,3–22,1 měsíce, bez detekce mutace T790M
v době progrese [8]. Vzhledem k těmto výsledkům byla
navržena a provedena studie fáze III porovnávající
randomizovaně 1 : 1 osimertinib s některým z TKI
první generace, tzn. s gefitinibem nebo s erlotinibem,
ve dvojitě zaslepeném uspořádání [9]. Do studie byli
zařazeni nemocní s pokročilým NSCLC bez předchozí
systémové léčby (TKI nebo chemoterapie) pro pokročilé
onemocnění, s běžnými mutacemi EGFR, tedy s delecí
v exonu 19 (ex19del) nebo s bodovou mutací L858R v exonu
21 (L858R). Bylo povoleno zařazovat pacienty s mozkovými
metastázami, pokud byli neurologicky stabilní a jejich léčba
včetně podávání kortikoidů byla ukončena více než dva týdny
před zahájením studie. Osimertinib byl podáván v dávce
80 mg 1× denně p.o., gefitinib v dávce 250 mg
a erlotinib v dávce 150 mg, rovněž 1× denně
perorálně. Stratifikačními faktory byly typ EGFR mutace
(ex19del/L858R) a etnická příslušnost asijská/neasijská.
Ve studii byla povolena tzv. c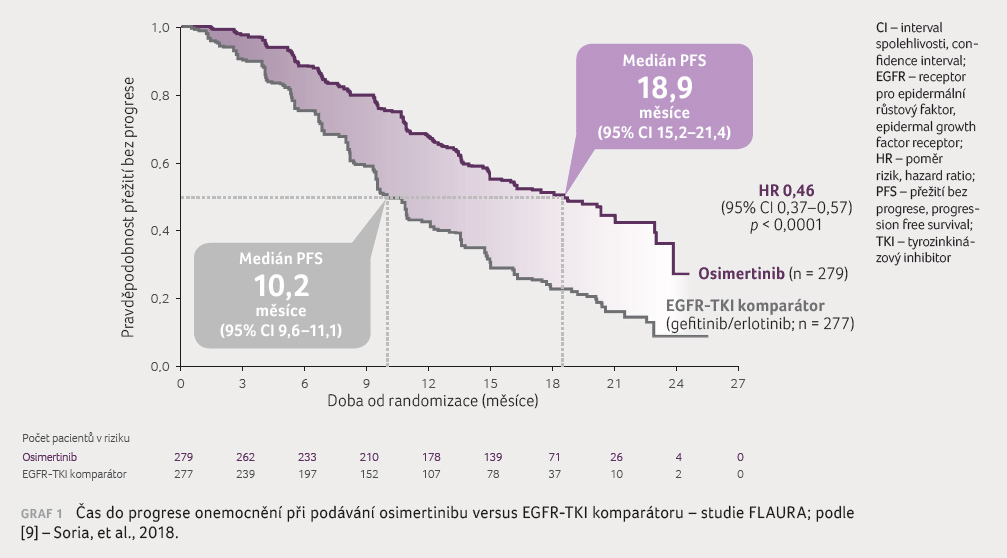 ross over léčba
osimertinibem u těch nemocných, kteří byli randomizováni
do ramene s EGFR TKI komparátorem a v době
progrese měli zjištěnu přítomnost T790M mutace. Primárním
ukazatelem výsledku studie byl čas do progrese (progression
free survival, PFS) hodnocený řešiteli podle kritérií RECIST
1.1. V celosvětově organizované studii bylo zařazeno celkem
556 nemocných, 279 v rameni s osimertinibem
a 277 v rameni s EGFR TKI komparátorem. Obě
ramena studie byla dobře vyvážená, zastoupení v ramenech
osimertinib/EGFR TKI komparátor bylo u žen 64 %/62 %,
u Asiatů 62 %/62 %, u delecí v exonu 19 pak
63 %/63 %, u nekuřáků 65 %/63 % a u mozkových
metastáz při vstupu do studie 19 %/23 %. V hlavním
ukazateli studie byla prokázána významně lepší účinnost
osimertinibu oproti standardní léčbě, riziko progrese/úmrtí
bylo sníženo o 54 % (poměr rizik [HR] 0,46; 95% interval
spolehlivosti [CI] 0,37‒0,75; p < 0,0001),
s mediánem PFS 18,9 měsíce u osimertinibu oproti
10,2 měsíce u EGFR TKI komparátoru (graf 1). Osimertinib byl účinnější ve všech
hodnocených podskupinách (graf 2). I v d
ross over léčba
osimertinibem u těch nemocných, kteří byli randomizováni
do ramene s EGFR TKI komparátorem a v době
progrese měli zjištěnu přítomnost T790M mutace. Primárním
ukazatelem výsledku studie byl čas do progrese (progression
free survival, PFS) hodnocený řešiteli podle kritérií RECIST
1.1. V celosvětově organizované studii bylo zařazeno celkem
556 nemocných, 279 v rameni s osimertinibem
a 277 v rameni s EGFR TKI komparátorem. Obě
ramena studie byla dobře vyvážená, zastoupení v ramenech
osimertinib/EGFR TKI komparátor bylo u žen 64 %/62 %,
u Asiatů 62 %/62 %, u delecí v exonu 19 pak
63 %/63 %, u nekuřáků 65 %/63 % a u mozkových
metastáz při vstupu do studie 19 %/23 %. V hlavním
ukazateli studie byla prokázána významně lepší účinnost
osimertinibu oproti standardní léčbě, riziko progrese/úmrtí
bylo sníženo o 54 % (poměr rizik [HR] 0,46; 95% interval
spolehlivosti [CI] 0,37‒0,75; p < 0,0001),
s mediánem PFS 18,9 měsíce u osimertinibu oproti
10,2 měsíce u EGFR TKI komparátoru (graf 1). Osimertinib byl účinnější ve všech
hodnocených podskupinách (graf 2). I v d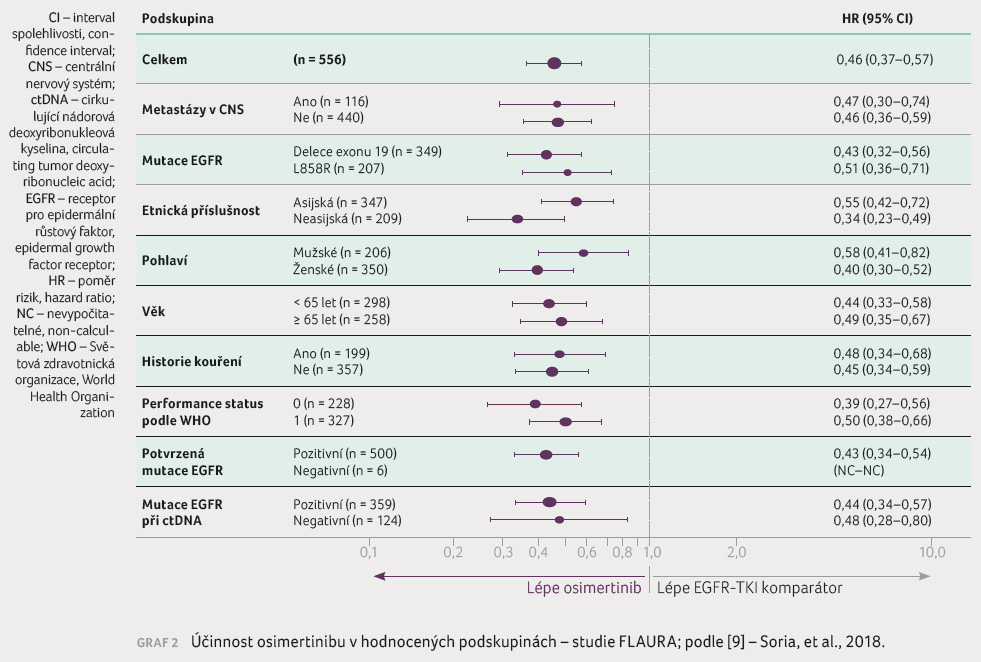 alších ukazatelích byla zjištěna
lepší účinnost osimertinibu, četnost objektivních odpovědí
80 % vs. 76 % byla nevýznamně vyšší (poměr šancí [OR]
1,27; 95% CI 0,9–1,9; p = 0,24),
trvání léčebné odpovědi bylo více než dvojnásobné – 17,2
měsíce (95% CI 13,8‒22,0) versus 8,5 měsíce
(95% CI 7,3–9,8). I přesto, že celkové přežití
(overall survival, OS) nelze dosud hodnotit vzhledem k pouze
25 % zralých dat, předběžná analýza ukazuje na snížení
rizika úmrtí o 37 % ‒ HR 0,63, 95% CI 0,45‒0,88,
p = 0,0068,
NS (jako statisticky významná hodnota při 25%
alších ukazatelích byla zjištěna
lepší účinnost osimertinibu, četnost objektivních odpovědí
80 % vs. 76 % byla nevýznamně vyšší (poměr šancí [OR]
1,27; 95% CI 0,9–1,9; p = 0,24),
trvání léčebné odpovědi bylo více než dvojnásobné – 17,2
měsíce (95% CI 13,8‒22,0) versus 8,5 měsíce
(95% CI 7,3–9,8). I přesto, že celkové přežití
(overall survival, OS) nelze dosud hodnotit vzhledem k pouze
25 % zralých dat, předběžná analýza ukazuje na snížení
rizika úmrtí o 37 % ‒ HR 0,63, 95% CI 0,45‒0,88,
p = 0,0068,
NS (jako statisticky významná hodnota při 25%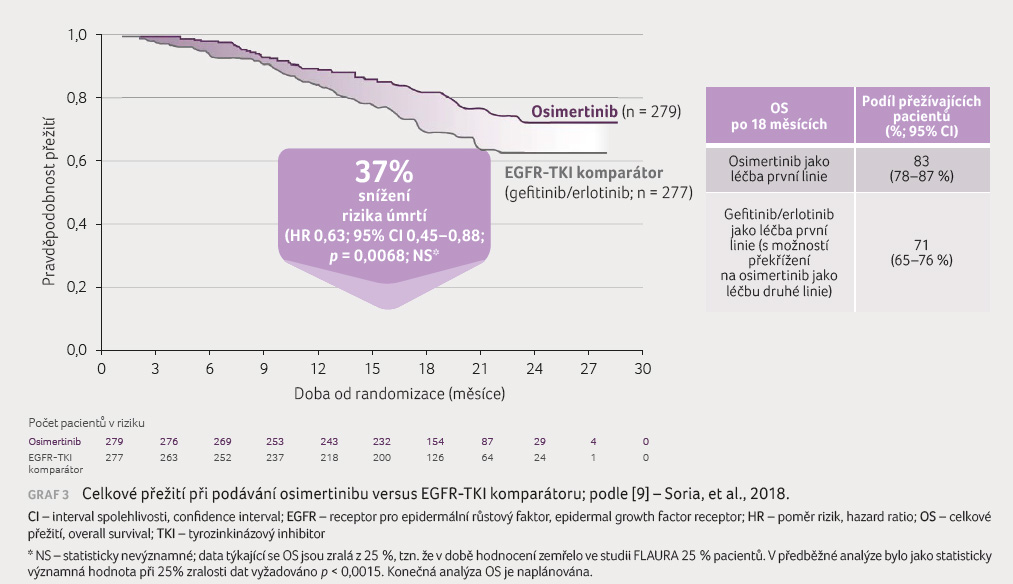 zralosti dat je
vyžadováno p < 0,0015),
graf 3.
zralosti dat je
vyžadováno p < 0,0015),
graf 3.
Osimertinib a mozkové metastázy
V době stanovení diagnózy
pokročilého EGFRm NSCLC má až 25 % pacientů mozkové metastázy
a jejich četnost se v průběhu onemocnění zhruba
zdvojnásobí [10]. Nemocní s mozkovými metastázami mají
horší prognózu než ti, u nichž se mozkové metastázy
nevyskytly. I když EGFR TKI první generace mají lepší
účinnost v centrální nervové soustavě (CNS) než
chemoterapie, i zde je vysoká četnost progresí v mozku
[11]. Osimertinib prochází nepoškozenou hematoencefalickou
bariérou, jak bylo zjištěno v preklinických modelech [12].
Klinická účinnost osimertinibu u nemocných s mozkovými
metastázami je pozoruhodná. Ve studii FLAURA [9] u celkem
116 nemocných s mozkovými metastázami byl medián doby
do progrese mozkových metastáz (CNS PFS) 15,2 měsíce
ve skupině s osimertinibem versus 9,6 měsíce ve skupině
s EGFR TKI komparátorem (p <
0,001). Osimertinib vykázal nominálně statisticky významné
a klinicky přínosné zlepšení CNS PFS ve srovnání
s EGFR TKI komparátorem s hodnotou HR 0,48 (95% CI
0,26–0,86; p = 0,014),
graf 4. Četnost
progresí v CNS byla při léčbě osimertinibem menší, a to
20 % 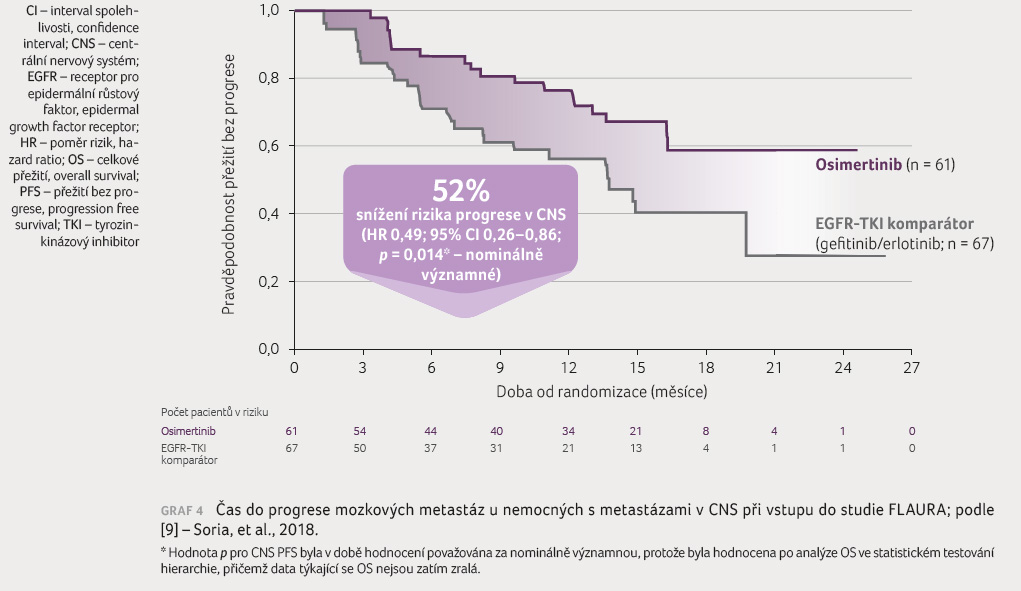 u osimertinibu oproti 39 % u EGFR TKI
komparátoru, stejně tak počet nových mozkových metastáz ‒
12 % u osimertinibu oproti 30 % u EGFR TKI
komparátoru. Četnost objektivních odpovědí (objective response
rate, ORR) v CNS byla při léčbě osimertinibem vyšší než
při léčbě EGFR TKI komparátorem, a to v celém
souboru 66 % versus 43 %, zatímco analýza souboru pacientů,
u nichž bylo možné hodnotit objektivní odpověď v CNS,
prokázala ORR 91 % versus 68 %, odpovědi v CNS byly
dlouhodobé a často přetrvávaly i v případě
progrese primárního tumoru nebo metastáz v oblasti trupu.
U pacientů, kteří měli metastázy v CNS při vstupu do
studie, bylo v první léčebné linii u osimertinibu 19 %
progresí v CNS a 81 % somatických, zatímco
u standardních TKI bylo 43 % progresí v CNS
a 53 % somatických [9,13].
u osimertinibu oproti 39 % u EGFR TKI
komparátoru, stejně tak počet nových mozkových metastáz ‒
12 % u osimertinibu oproti 30 % u EGFR TKI
komparátoru. Četnost objektivních odpovědí (objective response
rate, ORR) v CNS byla při léčbě osimertinibem vyšší než
při léčbě EGFR TKI komparátorem, a to v celém
souboru 66 % versus 43 %, zatímco analýza souboru pacientů,
u nichž bylo možné hodnotit objektivní odpověď v CNS,
prokázala ORR 91 % versus 68 %, odpovědi v CNS byly
dlouhodobé a často přetrvávaly i v případě
progrese primárního tumoru nebo metastáz v oblasti trupu.
U pacientů, kteří měli metastázy v CNS při vstupu do
studie, bylo v první léčebné linii u osimertinibu 19 %
progresí v CNS a 81 % somatických, zatímco
u standardních TKI bylo 43 % progresí v CNS
a 53 % somatických [9,13].
Bezpečnost léčby osimertinibem
Co se týče bezpečnosti léčby, při léčbě osimertinibem se vyskytují podobné nežádoucí účinky, jaké známe u ostatních TKI, zejména kožní a gastrointestinální, jejich frekvence a závažnost je však nižší. Veškeré nežádoucí účinky stupně 3 a výše se ve studii FLAURA [9] vyskytly s četností 34 % po osimertinibu a ve 45 % po EGFR TKI komparátoru. Počet případů vedoucích k přerušení léčby byl také nižší při podávání osimertinibu než ve skupině EGFR TKI komparátoru (13 % vs. 18 %). Většina nežádoucích účinků byla intenzity stupně 1 nebo 2. Nejčastěji hlášenými nežádoucími účinky jsou průjem a vyrážka, dále se často vyskytla stomatitida, keratitida, suchá kůže, paronychie, pruritus, snížení počtu trombocytů, leukocytů a neutrofilů. Intersticiální plicní nemoc (intersticial lung disease, ILD) byla zachycena u 4 % nemocných léčených osimertinibem, proto se doporučuje u všech pacientů s akutními projevy a/nebo s nevysvětleným zhoršováním respiračních symptomů (např. dušnost, kašel a horečka) provést pečlivé vyšetření k vyloučení ILD. Léčbu osimertinibem je nutné přerušit na dobu do vyšetření symptomů, a pokud je potvrzena diagnóza ILD, má být podávání osimertinibu trvale ukončeno. Méně častým, avšak obávaným nežádoucím účinkem užívání osimertinibu je vliv na srdeční frekvenci, většinou detekovaný jako prodloužení QTc intervalu, což může vést ke komorové tachykardii nebo k jiným poruchám rytmu s rizikem srdečního selhání nebo náhlé smrti. Ve studii FLAURA bylo prodloužení QTc intervalu zaznamenáno po osimertinibu v 10 % a po EGFR TKI komparátoru v 5 %, většinou stupně závažnosti 1 nebo 2, a nedošlo k žádné fatální příhodě komorové tachykardie nebo jiné dysrytmie. Největší rozdíl v mediánu QTc ve srovnání se vstupní hodnotou byl zaznamenán ve 12. týdnu léčby, později již byly tyto změny stabilizované. Nicméně tento nežádoucí účinek vede k doporučení, aby osimertinib nebyl používán u pacientů s vrozeným syndromem dlouhého QT intervalu. U pacientů trpících městnavým srdečním selháním, abnormalitami hodnot elektrolytů nebo užívajících léčivé přípravky prodlužující QTc interval je nutno zvážit pravidelné monitorování EKG a elektrolytů. Při prodloužení QTc intervalu nad 500 ms u nejméně dvou separátních měření EKG je nutno podávání přípravku ukončit a léčbu znovu zahájit v souladu s doporučenou úpravou dávkování. Užívání osimertinibu by mělo být trvale ukončeno u pacientů, u nichž dojde k prodloužení QTc intervalu v kombinaci s polymorfní komorovou tachykardií nebo s příznaky jiné závažné arytmie. U pacientů s rizikovými srdečními faktory a při stavech, které mohou ovlivnit funkci levé komory, je třeba zvážit monitorování srdeční činnosti včetně vyšetření ejekční frakce levé komory srdeční na počátku a v průběhu léčby [4].
Závěr
Na základě výsledků studie FLAURA je osimertinib novým standardem v léčbě první linie dospělých pacientů s lokálně pokročilým nebo metastazujícím NSCLC se senzibilizující mutací genu pro EGFR. Dále je indikován k léčbě dospělých pacientů s lokálně pokročilým nebo metastazujícím NSCLC s přítomnou mutací EGFR T790M.
Za nejvýznamnější lze pokládat zejména efekt osimertinibu v přítomnosti mozkových metastáz, nejen pro vysokou četnost odpovědí, ale i pro přetrvávající kontrolu v mozku v době progrese a pro nízkou frekvenci nově vzniklých mozkových metastáz při terapii osimertinibem.
Seznam použité literatury
- [1] Lee CK, Davies L, Wu YL, et al. Gefitinib or erlotinib vs chemotherapy for EGFR mutation‑positive lung cancer: individual patient data meta‑analysis of overal survival. J Natl Cancer Inst 2017; 109; doi: 10.1093/jnci/djw279.
- [2] Oxnard GR, Arcila ME, Sima CS, et al. Acquired resistance to EGFR tyrosine kinase inhibitors in EGFR‑mutant lung cancer: distinct natural history of patients with tumors harboring the T790M mutation. Clin Cancer Res 2011; 17: 1616‒1622.
- [3] Cross DA, Ashton SE, Ghiorghiu S, et al. AZD9291, an irreversible EGFR TKI, overcomes T790M‑mediated resistance to EGFR inhibitors in lung cancer. Cancer Discov 2014; 4: 1046‒1061.
- [4] Tagrisso. Souhrn údajů o přípravku, 2016. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004124/WC500202022.pdf
- [5] Goss G, Tsai C‑M, Shepherd FA, et al. Osimertinib for pretreated EGFR Thr790Met‑positive advanced non‑small‑cell lung cancer (AURA2): A multicentre, open‑label, single‑arm, phase 2 study. Lancet Oncol 2016; 17: 1643‒1652.
- [6] Yang JC, Ahn MJ, Kim DW, et al. Osimertinib in pretreated T790M‑positive advanced non‑small cell lung cancer: AURA study phase II extension component. J Clin Oncol 2017; 35: 1288‒1296.
- [7] Mok TS, Wu Y‑L, Ahn M‑J, et al. Osimertinib or platinum‑pemetrexed in EGFR T790M‑positive lung cancer. N Engl J Med 2017; 376: 629‒640.
- [8] Ramalingam SS, Yang JC, Lee CK, et al. Osimertinib as first‑line treatment of EGFR mutation‑positive advanced non‑small‑cell lung cancer. J Clin Oncol 208; 36: 841‒849.
- [9] Soria J‑C, Ohe Y, Vansteenkiste J, et al; FLAURA Investigators. Osimertinib in untreated EGFR‑mutated advanced non‑small‑cell lung cancer. N Engl J Med 2018; 378: 113‒125.
- [10] Bhatt VR, D’Souza SP, Smith LM, et al. Epidermal growth factor receptor mutational status and brain metastases in non‑small‑cell lung cancer. J Glob Oncol 2016; 3: 208‒217.
- [11] Heon S, Yeap BY, Lindeman NI, et al. The impact of initial gefitinib or erlotinib versus chemotherapy on central nervous system progression in advanced non‑small cell lung cancer with EGFR mutations. Clin Cancer Res 2012; 18: 4406‒4414.
- [12] Ballard P, Yates JW, Yang Z, et al. Preclinical comparison of osimertinib with other EGFR‑TKIs in EGFR‑mutant NSCLC brain metastases models, and early evidence of clinical brain metastases activity. Clin Cancer Res 2016; 22: 5130‒5140.
- [13] Vansteenkiste J, Reungwetwattana T, Nakagawa K, et al. CNS response to osimertinib vs standard of care (SoC) EGFR‑TKI as first‑line therapy in patients (pts) with EGFR‑TKI sensitising mutation (EGFRm)‑positive advanced non‑small cell lung cancer (NSCLC): data from the FLAURA study. Ann Oncol 2017; 28(Suppl 10), Abstr; doi: 10.1093/annonc/mdx782.