Využití lipozomálního doxorubicinu v léčbě metastatického karcinomu prsu
Souhrn:
Malejčíková M. Využití lipozomálního doxorubicinu v léčbě metastatického karcinomu prsu. Remedia 2021; 31: 255–259.
Karcinom prsu představuje heterogenní onemocnění. I přes rozšíření nových terapeutických možností pro jednotlivé podtypy karcinomu chemoterapie stále zaujímá důležité místo v adjuvantní léčbě i v léčbě metastatického onemocnění. Cílem léčby metastatického onemocnění je prodloužení života a udržení jeho kvality. Pořadí léčebných modalit a přípravků se stanovuje pro každou pacientku individuálně. Antracykliny mají významné postavení z hlediska účinnosti léčby. V managementu metastatického onemocnění je problémem jejich kumulativní dávka, při jejímž překročení se výrazně zvyšuje kardiotoxicita. Snížení dávky při současném zachování účinnosti lze dosáhnout využitím lipozomálních forem léků.
Summary:
Malejcikova M. Use of liposomal doxorubicin in the treatment of metastatic breast cancer. Remedia 2021; 31: 255–259.
Breast cancer is a heterogeneous disease. Despite the expansion of new therapeutic options for individual subtypes, chemotherapy still plays an important role in adjuvant treatment as well as in the treatment of metastatic disease. The goal of treating metastatic disease is to prolong life and maintain its quality. The order of treatment modalities and preparations is individual for each patient. Anthracyclines have an important place for their efficiency. A problem in the management of metastatic disease is their cumulative dose, above which cardiotoxicity increases significantly. Its reduction and at the same time maintaining efficiency can be achieved by using liposomal forms.
Key words: doxorubicin, liposomal doxorubicin, cardiotoxicity, cumulative dose, liposome
Úvod
Antracykliny redukují riziko úmrtí
na karcinom prsu u žen mladších 50 let o 38 %
a u žen ve věku 50−70 let o 20 % [1].
V léčbě metastatického onemocnění jsou svojí účinností
srovnatelné s taxany. Dosahují delší doby do progrese
onemocnění (progression free survival, PFS) a srovnatelného
podílu odpovědí na léčbu. Kombinace antracyklinů s taxany
zvyšuje podíl odpovědí na léčbu, ale neovlivňuje celkové
přežití (overall survival, OS) [2]. Problém užití antracyklinů
při diseminovaném onemocnění představuje kumulativní dávka,
při jejímž překročení se exponenciálně zvyšuje riziko
kardiotoxicity (tab. 1, 2) [3]. Rizikovější jsou v tomto
směru pacientky po předchozí kardiotoxické léčbě (např.
trastuzumabem), ženy ve vyšším věku, které absolvovaly
radioterapii v oblasti hrudníku, a pacientky se srdečními
komorbiditami.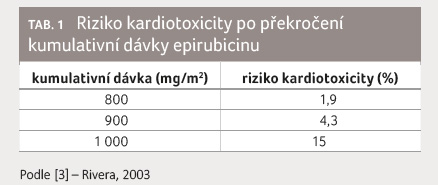
Kardiotoxicitu můžeme rozdělit
na dva typy. Antracyklinová (typ 1) je způsobena působením
volných radikálů na kardiomyocyt. Dochází
k poškození jeho membrány a destrukci buňky. Tato
kardiotoxicita je závislá na dávce a může se projevit
jako akutní, subakutní a chronická. Akutní se objevuje
několik dní až týdnů po podání antracyklinů. Projevuje
se nespecifickými změnami na EKG v úseku ST a v T
vlně. Subakutní nastupuje do roka po podání
léčby a je spojena se snížením ejekční frakce levé
komory. Chronická se projevuje kardiomyopatií a chronickým
srdečním selháním. Vyskytuje se i několik let po ukončení
léčby antracykliny.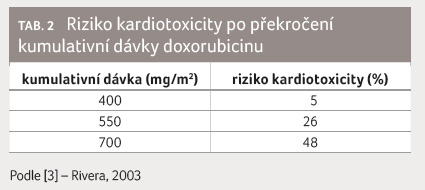
Kardiotoxicita po podání trastuzumabu (typ 2) je závislá na dávce, způsobuje poruchu kontraktility myokardu a je většinou reverzibilní. Před zahájením kardiotoxické léčby bychom měli u pacientky zvážit rizikové faktory, korigovat hypertenzi, zhodnotit podání inhibitorů angiotenzin konvertujícího enzymu (ACEi) a betablokátorů, provést vstupní echokardiografické vyšetření a EKG [4].
K dispozici máme několik možností, jak redukovat kardiotoxicitu při léčbě antracykliny:
- prodloužit podání antracyklinů na šesti až devadesátihodinovou kontinuální infuzi;
- podat dexrazoxan při překročení kumulativní dávky doxorubicinu 300 mg/m2;
- použít epirubicin, který má vyšší kumulativní dávku (k dosažení stejné efektivity je třeba navýšit dávku 1,5násobně);
- využít lipozomální formu léku [5].
Lipozomální forma antracyklinů
Lipozomální antracykliny jsou
k dispozici v pegylované nebo nepegylované formě. V obou
případech je doxorubicin obalen fosfolipidovou dvojvrstvou. Dochází
ke zvětšení částice, která není schopna proniknout přes
těsnou endotelovou vrstvu cév myokardu nebo gastrointestinálního
traktu, prochází však přes nedokonalou výstelku cévní stěny
nádoru (obr. 1) [6]. Navíc v nádorové tkáni probíhá
zánětlivý proces, k němuž fosfolipidová membrána adheruje
[7]. Lipozomální doxorubicin má delší plazmatický poločas
a koncentrace volného doxorubicinu je vždy nižší oproti
konvenční formě. Tímto způsobem lze tedy dosáhnout redukce
kardiotoxicity přípravku a možnosti podat více cyklů léčby
při zachování účinnosti [8].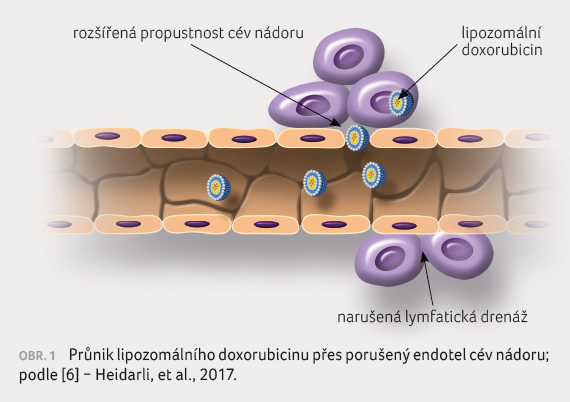
Non inferiorita lipozomální formy oproti standardní byla potvrzena ve třech klinických studiích (tab. 3). Dvě sledování porovnávala lipozomální doxorubicin s konvenčním doxorubicinem a zařazené pacientky mohly být v minulosti léčeny antracykliny do kumulativní dávky 300 mg/m2 [9,10]. Ve třetím klinickém hodnocení byl lipozomální doxorubicin porovnáván s epirubicinem a zařazené pacientky nebyly předléčeny antracyklinovým režimem [11].
Ve studii Batista a kol. byl
srovnáván lipozomální doxorubicin se standardním doxorubicinem,
oba v kombinaci s cyklofosfamidem. Bylo v ní dosaženo
primárního cílového ukazatele (podíl dosažených odpovědí
na léčbu) i sekundárních cílových ukazatelů (PFS,
OS). Kumulativní dávka v rameni s lipozomálním
doxorubicinem činila 2 200 mg/m2. Pokud byly
pacientky předléčeny antracykliny, kumulativní dávka činila
1 260 mg/m2. Výskyt srdečních příhod byl
zaznamenán ve prospěch lipozomální formy (6 %) oproti
standardnímu doxorubicinu (21 %), tabulka 3. Lipozomální
doxorubicin je možné podávat v kombinaci s cyklofosfamidem
v dávce 60−75 mg/m2 každé tři týdny
v intravenózní formě [12].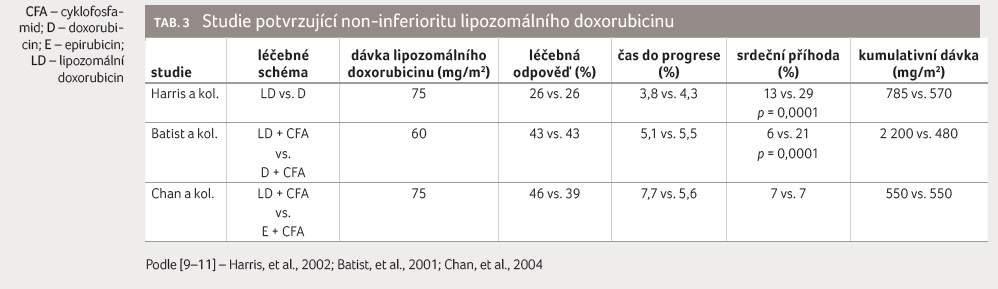
Ve studii Harrise a kol. byl lipozomální doxorubicin podáván v monoterapii [9]. Výhodou kombinovaného režimu je však nižší dávka, menší toxicita a možnost podání více cyklů léčby.
U předléčených pacientek, které už v minulosti antracykliny dostaly, lze zvážit podání lipozomálního doxorubicinu v týdenním režimu v dávce 20 mg/m2. V malé studii dokázal lipozomální doxorubicin navodit léčebnou odpověď u 42,6 % pacientek, u 57,4 % nemocných došlo k progresi onemocnění. V rámci sledování nebyla zaznamenána žádná srdeční příhoda [13].
Kazuistika
Pacientka ve věku 54 let, která byla po dobu pěti let léčena ACEi pro arteriální hypertenzi, byla poprvé vyšetřena z důvodu anamnézy tři měsíce trvající nejprve námahové a poté i klidové dušnosti, suchého kašle, progrese slabosti a zhoršení výkonnosti. Při fyzikálním vyšetření byla pacientka kachektická, s exulcerovaným levým prsem, hmatnou axilární lymfadenopatií, bilaterálně oslabeným dýcháním, tachykardií, edémem dolních končetin a revmatoidními uzly na drobných kloubech horních končetin.
Laboratorně byla zjištěna leukocytóza s posunem doleva, hypochromní anémie středně těžkého stupně, elevace hodnot zánětlivých markerů a nízké hodnoty nutričních parametrů. Při vyšetření výpočetní tomografií (CT) se zobrazil masivní fluidotorax vlevo, plicní metastázy bilaterálně, rozsáhlý exulcerovaný tumor levého prsu přerůstající na hrudní stěnu a axilární lymfadenopatie. Přítomno bylo rovněž skeletální postižení především v oblasti hrudní páteře, bez spinálního útlaku. Minibiopsie z levého prsu potvrdila invazivní duktální karcinom, luminální B podtyp.
Ejekční frakce levé komory byla na úrovni 60 %. V úvodu byla u pacientky zahájena symptomatická léčba, podána analgetika, denosumab, nutriční podpora a provedena odlehčovací punkce fluidotoraxu. Po stabilizaci mohla být u nemocné aplikována systémová léčba. Její stav byl zhodnocen jako viscerální krize při hormonálně pozitivním HER2 (humánní epidermální receptor 2) negativním karcinomu prsu. U nemocné byla potřebná rychlá odpověď pro zvládnutí pokročilého nádorového onemocnění. Indikovali jsme u ní chemoterapii ve schématu lipozomální doxorubicin v dávce 60 mg/m2 a cyklofosfamid v dávce 600 mg/m2 každé tři týdny. Vzhledem k celkovému výkonnostnímu stavu a obavě z toxicity léčby byly dávky v prvním cyklu redukovány o 25 %. Pacientka léčbu tolerovala bez komplikací, při druhém cyklu byly proto dávky eskalovány. Po šesti cyklech léčby nemocná nepotřebovala odlehčovací punkce fluidotoraxu, zlepšil se lokální nález na prsu, na CT byla zaznamenána parciální remise onemocnění podle kritérií RECIST (Response Evaluation Criteria in Solid Tumors). Léčbu bylo možné změnit na inhibitor aromatázy.
Závěr
Antracykliny představují důležitý článek v léčbě metastatického karcinomu prsu. Snížit kardiotoxicitu pomáhá užití lipozomálních forem léků, které zároveň umožňují podat více cyklů léčby. Větší počet klinických studií potvrdil non inferioritu lipozomálních forem antracyklinů v porovnání s konvenčním doxorubicinem a epirubicinem. Lze je podat rovněž pacientkám, které už antracyklinovou léčbu v minulosti podstoupily.
Seznam použité literatury
- [1] Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15‑year survival: an overview of the randomised trials. Lancet 2005; 366: 2087−2106.
- [2] Piccart‑Gebhart MJ, Burzykowski T, Buyse M, et al. Taxanes alone or in combination with anthracyclines as first‑line therapy of patients with metastatic breast cancer. J Clin Oncol 2008; 26: 1980−1986.
- [3] Rivera E. Liposomal anthracyclines in metastatic breast cancer: clinical update. Oncologist 2003; 8(Suppl 2): 3−9.
- [4] Puchnerova V, Novakova Z, Wilhelm Z. Antracykliny – kardiotoxicita a kardioprotekce – se zaměřením na mechanizmus účinku. Interv Akut Kardiol 2016; 15: 102–105.
- [5] Pai VB, Nahata MC. Cardiotoxicity of chemotherapeutic agents: incidence, treatment and prevention. Drug Saf 2000; 22: 263−302.
- [6] Heidarli E, Dadashzadeh S, Haeri A. State of the Art of Stimuli‑Responsive Liposome for Cancer Therapy. Iran J Pharm Res 2017; 16: 1273−1304.
- [7] Minotti G, Menna P, Savatorelli E, et al. Anthracyclines: Molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. Pharmacol Rev 2004; 56: 185–229.
- [8] Speyer JL, Green MD, Zeleniuch‑Jacquotte A, et al. ICRF‑187 permits longer treatment with doxorubicin in women with breast cancer. J Clin Oncol 1992; 10: 117−127.
- [9] Harris L, Batist G, Belt R, et al. Liposome‑encapsulated doxorubicin compared with conventional doxorubicin in a randomized multicenter trial as first‑line therapy of metastatic breast carcinoma. Cancer 2002; 94: 25−36.
- [10] Batist G, Ramakrishnan G, Rao CS, et al. Reduced cardiotoxicity and preserved antitumor efficacy of liposome‑encapsulated doxorubicin and cyclophosphamide compared with conventional doxorubicin and cyclophosphamide in a randomized, multicenter trial of metastatic breast cancer. J Clin Oncol 2001; 19: 1444−1454.
- [11] Chan S, Davidson N, Juozaityte E, et al. Phase III trial of liposomal doxorubicin and cyclophosphamide compared with epirubicin and cyclophosphamide as first‑line therapy for metastatic breast cancer. Ann Oncol 2004; 15: 1527−1534.
- [12] SPC Myocet. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/myocet‑liposomal‑previously‑myocet‑epar‑product‑information_sk.pdf [navštíveno 5/2021].
- [13] Masci G, Gandini Ch, Zuradelli M, et al. Weekly non‑pegylated liposomal doxorubicin chemotherapy in heavily pre‑treated patients with metastatic breast cancer. Anticancer Res 2013; 33: 4603−4609.