Medikamentózní léčba perianální formy Crohnovy nemoci
Souhrn
Ďuricová D. Medikamentózní léčba perianální formy Crohnovy nemoci. Remedia 2024; 34: 221–224.
Perianální projevy jsou fenotypovým projevem u části pacientů s Crohnovou chorobou a mohou postihovat až čtvrtinu nemocných. Mezi typické klinické projevy patří perianální absces a píštěle. Terapie perianálních píštělí vyžaduje multidisciplinární přístup se zapojením gastroenterologa, chirurga a radiologa a měla by být výsledkem kombinace medikamentózní a chirurgické léčby. Velmi důležitým aspektem je léčba luminální formy onemocnění, hlavně v oblasti rekta. Randomizované kontrolované studie primárně zaměřené na posouzení účinnosti léčiva u pacientů s perianálními píštělemi jsou zatím velmi omezené, a současná evidence je proto založena především na výsledcích post hoc analýz klinických studií, na observačních sledováních a názorech odborníků. Anti‑TNF přípravky (infliximab) jsou v současné době považovány za nejefektivnější medikamentózní terapii perianální formy Crohnovy nemoci. Účinnost novějších biologických přípravků a inovativních léků (ustekinumab, vedolizumab, risankizumab, upadacitinib) je zatím nejistá a jsou potřeba další data.
Klíčové slova: Crohnova nemoc – perianální píštěl – terapie.
Summary
Duricova D. Medical treatment of the perianal form of Crohn’s disease. Remedia 2024; 34: 221–224.
Perianal Crohn’s disease may affect up to a quarter of patients. Typical clinical manifestations include perianal abscess and fistulas. Treatment of perianal fistulas requires a multidisciplinary approach involving a gastroenterologist, a surgeon and a radiologist and should result from a combination of medical and surgical treatment. A very important aspect consists of the treatment of the luminal form of the disease, especially in the rectum. Randomised controlled trials primarily aimed at assessing the efficacy of drugs in patients with perianal fistulas are still very limited and the current evidence is therefore based mainly on post‑hoc analyses of clinical trials, observational studies and expert opinion. Anti‑TNFα agents (infliximab) are currently considered the most effective drug therapy for the perianal Crohn’s disease. The efficacy of newer biologics and innovative drugs (ustekinumab, vedolizumab, risankizumab, upadacitinib) is still uncertain and more data are needed.
Key words: Crohn’s disease – perianal fistula – treatment.
Perianální forma Crohnovy nemoci (PACD) je fenotypovým projevem u části pacientů s Crohnovou chorobou (CD) a může postihovat až čtvrtinu nemocných [1]. Kumulativní incidence PACD narůstá s délkou trvání onemocnění. Až u 17 % pacientů s PACD může její manifestace předcházet diagnóze střevního onemocnění o více než šest měsíců, u 27 % jedinců dojde k manifestaci PACD v období mezi šesti měsíci před stanovením a šest měsíců po stanovení diagnózy CD, zatímco u většiny nemocných (56 %) se perianální projevy manifestují až v průběhu onemocnění (po 6 měsících od diagnózy) [1,2]. Prevalence PACD závisí na lokalizaci střevního zánětu. Nejméně často se vyskytuje u pacientů s izolovaným postižením ilea (12 %) nebo s ileokolickou lokalizací (15 %), nejčastější výskyt je při kolickém postižení (41 %), a zvláště pak v případě, kdy je postiženo i rektum (92 %) [2].
Klinické projevy
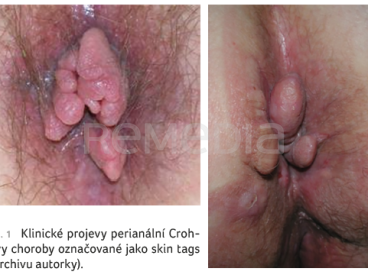 Mezi typické klinické projevy patří perianální absces a píštěle. Méně známou manifestací jsou tzv. skin tags, což jsou zbytnělé řitní papily (obr. 1). Často jsou mylně zaměňovány za hemoroidy. Skin tags jsou obvykle projevem aktivity luminálního onemocnění. Jejich léčba spočívá v úpravě/intenzifikaci medikamentózní terapie. Nedoporučuje se odstraňovat je chirurgicky, protože tento postup může vést ke vzniku nehojících se defektů a píštělí. V určitých selektovaných případech, pokud dosahují větších rozměrů a činí hygienický problém, je možno uvažovat o jejich snesení zkušeným chirurgem specializujícím se na léčbu pacientů s PACD.
Mezi typické klinické projevy patří perianální absces a píštěle. Méně známou manifestací jsou tzv. skin tags, což jsou zbytnělé řitní papily (obr. 1). Často jsou mylně zaměňovány za hemoroidy. Skin tags jsou obvykle projevem aktivity luminálního onemocnění. Jejich léčba spočívá v úpravě/intenzifikaci medikamentózní terapie. Nedoporučuje se odstraňovat je chirurgicky, protože tento postup může vést ke vzniku nehojících se defektů a píštělí. V určitých selektovaných případech, pokud dosahují větších rozměrů a činí hygienický problém, je možno uvažovat o jejich snesení zkušeným chirurgem specializujícím se na léčbu pacientů s PACD.
Klasifikace perianálních píštělí
 V klinické praxi jsou známé hlavně dvě klasifikace – tzv. Parksova klasifikace a klasifikace AGA (American Gastroenterology Association) [2]. Parksova klasifikace je převážně klasifikací anatomickou, podává údaje o průběhu píštělových traktů ve vztahu ke svěračům a svalům pánevního dna. Její nevýhodou je, že neposkytuje informace o komplexitě píštělí (přítomnost abscesu a sekundárních píštělových traktů) a postižení rekta. V klinické praxi se proto využívá hlavně tzv. klasifikace AGA, která má i určitý prognosticko‑terapeutický význam a rozděluje perianální píštěle do dvou kategorií – na simplexní a komplexní (většina pacientů s CD). Toto rozdělení je založeno na anatomickém průběhu píštělového traktu, počtu zevních ústí, přítomnosti abscesu anebo proktitidy (tab. 1).
V klinické praxi jsou známé hlavně dvě klasifikace – tzv. Parksova klasifikace a klasifikace AGA (American Gastroenterology Association) [2]. Parksova klasifikace je převážně klasifikací anatomickou, podává údaje o průběhu píštělových traktů ve vztahu ke svěračům a svalům pánevního dna. Její nevýhodou je, že neposkytuje informace o komplexitě píštělí (přítomnost abscesu a sekundárních píštělových traktů) a postižení rekta. V klinické praxi se proto využívá hlavně tzv. klasifikace AGA, která má i určitý prognosticko‑terapeutický význam a rozděluje perianální píštěle do dvou kategorií – na simplexní a komplexní (většina pacientů s CD). Toto rozdělení je založeno na anatomickém průběhu píštělového traktu, počtu zevních ústí, přítomnosti abscesu anebo proktitidy (tab. 1).
Terapie PACD
Obecný princip léčby PACD
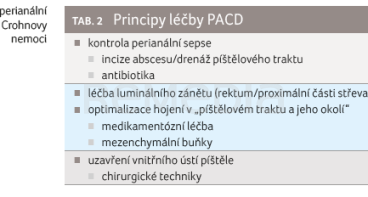 Léčba (hlavně komplexní) PACD vyžaduje vždy multidisciplinární přístup se zapojením gastroenterologa, chirurga a radiologa a měla by být výsledkem kombinace medikamentózní a chirurgické léčby. Základní principy terapie PACD lze zjednodušeně rozdělit do tří fází (tab. 2). Prvním krokem je kontrola perianální sepse, která spočívá v chirurgickém ošetření ev. abscesu a drenáži píštělových traktů. Z medikamentózní terapie se zde uplatňují hlavně antibiotika, a to převážně kombinace ciprofloxacinu a metronidazolu [3,4]. Základem další fáze, která bývá často nejdelší, je intenzivní protizánětlivá léčba s cílem potlačit luminální aktivitu nemoci (hlavně v oblasti rekta) a optimalizovat hojení v oblasti píštělových traktů a okolí. Z medikamentózních přípravků se zde používá hlavně biologická léčba a můžeme sem zařadit i relativně novou léčebnou metodu – aplikaci mezenchymálních kmenových buněk. Poslední fází je pak v ideálním případě chirurgická „eradikace“ píštěle, která spočívá v chirurgickém uzavření vnitřního ústí a ošetření píštělového traktu. Používají se různé techniky, jako je například „advancement flap“. Celý proces od zahájení léčby až po eradikaci píštěle je časově poměrně náročný a může trvat od několika týdnů až po několik let, v závislosti na závažnosti nemoci a odpovědi na medikamentózní léčbu.
Léčba (hlavně komplexní) PACD vyžaduje vždy multidisciplinární přístup se zapojením gastroenterologa, chirurga a radiologa a měla by být výsledkem kombinace medikamentózní a chirurgické léčby. Základní principy terapie PACD lze zjednodušeně rozdělit do tří fází (tab. 2). Prvním krokem je kontrola perianální sepse, která spočívá v chirurgickém ošetření ev. abscesu a drenáži píštělových traktů. Z medikamentózní terapie se zde uplatňují hlavně antibiotika, a to převážně kombinace ciprofloxacinu a metronidazolu [3,4]. Základem další fáze, která bývá často nejdelší, je intenzivní protizánětlivá léčba s cílem potlačit luminální aktivitu nemoci (hlavně v oblasti rekta) a optimalizovat hojení v oblasti píštělových traktů a okolí. Z medikamentózních přípravků se zde používá hlavně biologická léčba a můžeme sem zařadit i relativně novou léčebnou metodu – aplikaci mezenchymálních kmenových buněk. Poslední fází je pak v ideálním případě chirurgická „eradikace“ píštěle, která spočívá v chirurgickém uzavření vnitřního ústí a ošetření píštělového traktu. Používají se různé techniky, jako je například „advancement flap“. Celý proces od zahájení léčby až po eradikaci píštěle je časově poměrně náročný a může trvat od několika týdnů až po několik let, v závislosti na závažnosti nemoci a odpovědi na medikamentózní léčbu.
Hodnocení efektu léčby
K hodnocení efektu léčby bylo vyvinuto několik, převážně klinických, indexů [2]. Nejčastěji používaným indexem pro posouzení efektivity léčiv ve studiích, který byl akceptován i regulačními orgány, je tzv. fistula drainage assessment index. Tento index je velmi jednoduchý a založený na posouzení míry sekrece z perianálních píštělí po kompresi na oblast zevního ústí píštěle. Nevýhodou tohoto a jiných klinických indexů je absence objektivního hodnocení hojení a subjektivní vliv vyšetřujícího. V posledních letech se proto do hodnocení efektu léčby zařazuje magnetická rezonance jako objektivní parametr posouzení hojení perianálních píštělí [5]. Navíc se ukazuje, že dosažení tzv. radiologického zhojení perianálních píštělí oproti klinickému zhojení je spojeno s lepším dlouhodobějším výsledkem [6].
Účinnost medikamentózní terapie
Randomizované kontrolované studie primárně zaměřené na posouzení účinnosti léčiva u pacientů s PACD jsou zatím velmi omezené [7,8]. Současná evidence je proto založena především na výsledcích post hoc analýz klinických studií, na observačních sledováních a názorech odborníků.
Konvenční terapie
Aminosalicyláty nemají žádnou roli v léčbě PACD. Podobně ani kortikosteroidy nejsou doporučeny pro léčbu PACD z důvodu neúčinnosti v této indikaci; lze je však využít v terapii přidruženého luminálního onemocnění [3,4].
U thiopurinů chybějí prospektivní kontrolované studie zaměřené na posouzení účinnosti u PACD a údaje o jejich efektivitě v léčbě perianálních píštělí jsou založeny na celkově velmi omezeném počtu pacientů a heterogenním hodnocení efektu v jednotlivých studiích [3]. Thiopuriny proto nejsou indikovány pro léčbu PACD v monoterapii, lze je využít do kombinace s přípravky proti tumor nekrotizujícímu faktoru (anti‑TNF) [3,4].
Antibiotika se využívají jak v kontrole perianální sepse, tak i v léčbě perianálních píštělí, kde mají často symptomatický efekt na snížení sekrece. Metronidazol a ciprofloxacin představují dvě nejběžněji používaná léčiva. Navzdory jejich širokému a častému použití jsou důkazy o jejich účinnosti velmi limitované a omezené na malé studie. Efekt antibiotické léčby je krátkodobý a její dlouhodobé použití je kromě jiného limitováno výskytem nežádoucích účinků nebo intolerance [2–4].
Biologická léčba
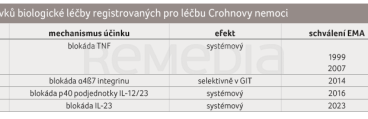 Biologická léčba v současné době zahrnuje několik typů přípravků s různým mechanismem účinku (tab. 3). Prvními a nejdéle používanými léčivy jsou anti‑TNF protilátky (infliximab a adalimumab), druhou skupinu tvoří anti‑integrinová monoklonální protilátka vedolizumab a třetím přípravkem je ustekinumab, monoklonální protilátka proti interleukinu (IL) 12 a 23. Posledním léčivem registrovaným v roce 2023 je risankizumab, monoklonální protilátka proti IL‑23.
Biologická léčba v současné době zahrnuje několik typů přípravků s různým mechanismem účinku (tab. 3). Prvními a nejdéle používanými léčivy jsou anti‑TNF protilátky (infliximab a adalimumab), druhou skupinu tvoří anti‑integrinová monoklonální protilátka vedolizumab a třetím přípravkem je ustekinumab, monoklonální protilátka proti interleukinu (IL) 12 a 23. Posledním léčivem registrovaným v roce 2023 je risankizumab, monoklonální protilátka proti IL‑23.
Anti‑TNF léčba
Infliximab je zatím jediným biologickým přípravkem, s nímž byly provedeny randomizované kontrolované studie zaměřené primárně na posouzení efektivity v léčbě perianálních píštělí u CD. První studie hodnotila krátkodobou účinnost infliximabu a zahrnovala 94 pacientů s CD, z nichž většina (94 %) měla perianální píštěl [7]. Primárním cílem bylo snížení sekrece z píštěle o minimálně 50 %, což bylo pozorováno u 68 % pacientů léčených infliximabem vs. 26 % pacientů na placebu (p = 0,002). Úplné vymizení sekrece jako sekundárního cíle léčby dosáhlo 55 % pacientů na infliximabu oproti 13 % pacientů v placebové skupině (p = 0,001) [7]. Druhá studie byla zaměřena na hodnocení efektivity infliximabu v udržovací fázi léčby (ACCENT II) [9]. Po otevřené indukci dosáhlo 64 % pacientů léčených infliximabem odpovědi v týdnu 10 a pacienti byli následně randomizováni do udržovací fáze. Primárním cílovým ukazatelem byla ztráta léčebné odpovědi, která byla delší ve skupině léčené infliximabem ve srovnání s placebem (> 40 týdnů oproti 14 týdnům, p < 0,001) [9]. Dle českých i mezinárodních doporučení je proto infliximab lékem první volby u pacientů s komplexní PACD [4,10].
V posledních několika letech je v klinické praxi k dispozici i subkutánní varianta infliximabu – biosimilární infliximab – CT‑P13 SC. Kromě odlišného způsobu aplikace se infliximab CT‑P13 SC od intravenózního přípravku liší i ve farmakokinetickém profilu, který vede k vyšším údolním koncentracím léčiva a jeho nižší imunogenicitě [11]. U subkutánní formy infliximabu byla v léčbě luminální formy CD prokázána minimálně stejná účinnost jako u intravenózně aplikovaného přípravku [11]. Údaje o efektivitě subkutánní formy specificky u pacientů s PACD jsou však zatím omezené. Recentně byla prezentována retrospektivní francouzská multicentrická studie GETAID, která zahrnula 192 pacientů s aktivní a neaktivní formou PACD léčených subkutánním infliximabem. Tato studie potvrdila obdobnou účinnost a bezpečnost subkutánní formy infliximabu jak v léčbě aktivní PACD, tak i v udržení remise neaktivní formy onemocnění [12].
V případě adalimumabu je evidence o účinnosti v léčbě PACD méně robustní a pochází převážně z post hoc analýzy kontrolované studie fáze III (CHARM) u pacientů s CD, kteří vstupovali do studie současně s perianálním postižením, a dále pak z observačních studií z reálné klinické praxe [2,3].
Terapeutické lékové monitorování a vliv lékových hladin na účinnost léčby byly v posledních letech velkým předmětem výzkumu u biologické léčby, převážně anti‑TNF přípravků. Většina studií konzistentně prokázala pozitivní vztah mezi sérovou koncentrací léčiva a terapeutickým efektem, včetně hojení perianálních píštělí [13,14]. Nicméně dle výsledků publikovaných prací se zdá, že cílové minimální koncentrace se různí v závislosti na terapeutickém cíli, fenotypu pacienta a použité metodě. Obecně platí, že vyšší koncentrace léčiva bývají spojeny s „přísnějším“ terapeutickým cílem, jako je dosažení endoskopické a histologické remise nebo právě hojení perianálních píštělí [15]. Například podle izraelské retrospektivní studie byl medián koncentrace infliximabu u pacientů se zhojením perianálních píštělí signifikantně vyšší oproti pacientům s aktivním onemocněním (15,8 µg/ml vs. 4,4 µg/ml, p = 0,0001). Při rozdělení hladin léčiva do jednotlivých kvartilů byla nejvyšší účinnost pozorována při koncentraci infliximabu > 10 µg/ml [13].
Samotná anti‑TNF terapie však jen velmi zřídka vede k radiologickému zhojení píštěle. Podle prospektivní multicentrické studie z Nizozemska, do které byli zařazeni pacienti s CD a perianální píštělí, radiologické zhojení po 18 měsících od zahájení studie bylo pozorováno u 32 % pacientů na kombinované anti‑TNF a chirurgické léčbě (chirurgické uzavření vnitřního ústí píštěle), zatímco jen u 9 % jedinců na samotné biologické léčbě bez pokusu o chirurgickou eradikaci píštěle [6]. Tato studie i přes své limity (jen částečná randomizace pacientů, selektovaná skupina pacientů s určitým typem perianální píštěle) poukazuje na superioritu kombinace medikamentózní a chirurgické léčby k dosažení lepšího dlouhodobého výsledku.
Vedolizumab
Vedolizumab, inhibitor α4β7 integrinového receptoru, blokuje přestup aktivovaných lymfocytů do střeva a má převážně selektivní působení v trávicím traktu. Evidence z prospektivních kontrolovaných studií o účinnosti vedolizumabu v léčbě PACD zatím chybí. Výsledky post hoc analýzy randomizované kontrolované studie (GEMINI 2) hodnotící primárně účinnost léčiva na luminální formu CD a údaje z observačních prací z klinické praxe naznačují možnou účinnost vedolizumabu v léčbě PACD [3,16]. Nicméně, vzhledem k celkově malému počtu hodnocených pacientů a celkově nízké kvalitě dat jsou potřeba další prospektivní a kontrolované studie k posouzení efektivity léčiva v této indikaci.
Ustekinumab
Ustekinumab je anticytokinová protilátka, která vazbou na p40 podjednotku blokuje účinek dvou cytokinů – IL‑12 a IL‑23. Podobně jako v případě vedolizumabu nejsou zatím ani u ustekinumabu k dispozici data z kontrolovaných studií primárně zaměřených na pacienty s PACD. Podle systematického review a metaanalýzy 25 studií (post hoc analýza randomizovaných kontrolovaných studií UNITI‑1/UNITI‑2 a sledování z klinické praxe) došlo ke klinické remisi (absence sekrece z píštělí) u 25 % pacientů po 8–12 týdnech a u 42 % pacientů po 12 měsících od zahájení léčby ustekinumabem [17]. Obdobně jako u vedolizumabu jsou potřebné prospektivní kontrolované studie k ověření účinnosti ustekinumabu v léčbě PACD.
Risankizumab
Risankizumab – monoklonální protilátka proti IL‑23 – je nejnovějším biologickým přípravkem pro léčbu CD (registrace v roce 2023) [18]. Údaje o účinnosti risankizumabu v léčbě PACD zatím chybějí.
Inovativní terapie „malými molekulami“
JAK (Janus kinázy) jsou čtyři nitrobuněčné enzymy (JAK 1, 2, 3 a tyrozinkináza 2), které zprostředkovávají odpovědi na různé cytokiny nebo růstové faktory zapojené do široké škály buněčných procesů, včetně zánětlivé odpovědi, hematopoezy a imunitních reakcí [19]. Pro léčbu idiopatických střevních zánětů (IBD) jsou v současnosti k dispozici tři přípravky ze skupiny inhibitorů JAK. Prvním z nich je tofacitinib (neselektivní inhibitor JAK s preferenční inhibicí JAK 1 a 3), druhým filgotinib (selektivní nebo preferenční inhibitor JAK 1) a třetím upadacitinib (selektivní inhibitor JAK 1). Všechny tři přípravky jsou registrovány pro léčbu ulcerózní kolitidy, zatímco upadacitinib jako jediný zástupce inhibitorů JAK byl v roce 2023 schválen i pro léčbu CD.
DIVERGENCE 2 byla randomizovaná kontrolovaná studie fáze II, která hodnotila efektivitu filgotinibu u 57 pacientů s PACD. V týdnu 24 pacienti léčení filgotinibem 200 mg denně měli oproti placebu numericky vyšší šanci dosáhnout zmírnění perianálního postižení (47,1 % vs. 25 %) nebo remise definované jako uzavření zevních ústí a současně absence tekutinové kolekce > 1 cm na magnetické rezonanci (47,1 % vs. 16,7 %) [8]. Obdobně post hoc analýza klinických studií fáze III s upadacitinibem u CD (studie U‑EXCEL, U‑EXCEED, U‑ENDURE) prokázala vyšší efektivitu upadacitinibu ve srovnání s placebem u pacientů s aktivní perianální píštělí při vstupu do studie [20].
Závěr
Terapie perianální Crohnovy nemoci vyžaduje multidisciplinární přístup a kombinaci medikamentózní a chirurgické léčby. Velmi důležitým aspektem je léčba luminální formy onemocnění, hlavně v oblasti rekta. Anti‑TNF přípravky (infliximab) jsou v současné době považovány za nejefektivnější medikamentózní terapii PACD. Optimalizace jejich účinku lze pravděpodobně dosáhnout využitím lékového monitorování. Účinnost novějších biologických přípravků a inovativní terapie je zatím nejistá a jsou potřeba další data.
MUDr. Dana Ďuricová, Ph.D.
Klinické a výzkumné centrum pro střevní záněty, ISCARE, a.s.
Českomoravská 2510/19, 190 00 Praha 9
e-mail: dana.duricova@seznam.cz
Literatura
[1] Zhao M, Lo BZS, Vester‑Andersen MK, et al. A 10‑Year Follow‑up Study of the Natural History of Perianal Crohn’s Disease in a Danish Population‑Based Inception Cohort. Inflamm Bowel Dis 2019; 25: 1227–1236.
[2] Panés J, Rimola J. Perianal fistulizing Crohn’s disease: pathogenesis, diagnosis and therapy. Nat Rev Gastroenterol Hepatol 2017; 14: 652–664.
[3] Kotze PG, Shen B, Lightner A, et al. Modern management of perianal fistulas in Crohn’s disease: future directions. Gut 2018; 67: 1181–1194.
[4] Torres J, Bonovas S, Doherty G, et al. ECCO Guidelines on Therapeutics in Crohn’s Disease: Medical Treatment. J Crohns Colitis 2020; 14: 4–22.
[5] Caron B, D’Amico F, Danese S, Peyrin‑Biroulet L. Endpoints for Perianal Crohn’s Disease Trials: Past, Present and Future. J Crohns Colitis 2021; 15: 1387–1398.
[6] Meima‑van Praag EM, Becker MAJ, van Rijn KL, et al. Short‑term anti‑TNF therapy with surgical closure versus anti‑TNF therapy alone for Crohn’s perianal fistulas (PISA‑II): long‑term outcomes of an international, multicentre patient preference, randomised controlled trial. EClinicalMedicine 2023; 61: 102045.
[7] Present DH, Rutgeerts P, Targan S, et al. Infliximab for the treatment of fistulas in patients with Crohn’s disease. N Engl J Med 1999; 340: 1398–1405.
[8] Reinisch W. OP18 Efficacy and safety of filgotinib for the treatment of perianal fistulizing Crohn’s Disease: Results from the phase 2 DIVERGENCE 2 study. Presented at: 17th Congress of ECCO 2022. J Crohns Colitis 2022; 16(Suppl 1): i19‑i21.
[9] Sands BE, Anderson FH, Bernstein CN, et al. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med 2004; 350: 876–885.
[10] Bortlík M, Ďuricová D, Douda T, et al. Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: čtvrté, aktualizované vydání. Gastroent Hepatol 2019; 73: 11–24.
[11] Schreiber S, Ben‑Horin S, Leszczyszyn J, et al. Randomized Controlled Trial: Subcutaneous vs Intravenous Infliximab CT‑P13 Maintenance in Inflammatory Bowel Disease. Gastroenterology 2021; 160: 2340–2353.
[12] Andre M, Kirchgesner J, Laharie D, et al. P857 Effectiveness and safety of subcutaneous infliximab in perianal Crohn’s disease: a multicentre cohort study. J Crohns Colitis 2024; 18(Suppl.1): i1587–i1587.
[13] Yarur AJ, Kanagala V, Stein DJ, et al. Higher infliximab trough levels are associated with perianal fistula healing in patients with Crohn’s disease. Aliment Pharmacol Ther 2017; 45: 933–940.
[14] De Gregorio M, Lee T, Krishnaprasad K, et al. Higher Anti‑tumor Necrosis Factor‑α Levels Correlate With Improved Radiologic Outcomes in Crohn’s Perianal Fistulas. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc 2022; 20: 1306–1314.
[15] Cheifetz AS, Abreu MT, Afif W, et al. A Comprehensive Literature Review and Expert Consensus Statement on Therapeutic Drug Monitoring of Biologics in Inflammatory Bowel Disease. Am J Gastroenterol 2021; 116: 2014–2025.
[16] Ayoub F, Odenwald M, Micic D, et al. Vedolizumab for perianal fistulizing Crohn’s disease: systematic review and meta‑analysis. Intest Res 2022; 20: 240–250.
[17] Godoy Brewer GM, Salem G, Afzal MA, et al. Ustekinumab is effective for perianal fistulising Crohn’s disease: a real‑world experience and systematic review with meta‑analysis. BMJ Open Gastroenterol 2021; 8: e000702.
[18] Parigi TL, Iacucci M, Ghosh S. Blockade of IL‑23: What is in the Pipeline? J Crohns Colitis 2022; 16(Suppl.2): ii64–ii72.
[19] Pippis EJ, Yacyshyn BR. Clinical and Mechanistic Characteristics of Current JAK Inhibitors in IBD. Inflamm Bowel Dis 2021; 27: 1674–1683.
[20] Colombel J. Upadacitinib is Effective for the Treatment of Fistulizing Crohn’s Disease: Phase 3 Data. Presented at: DDW; May 2023.