Adjuvantní chemoterapie kolorektálního karcinomu – současné poznatky
V článku je popsán vývoj adjuvantní chemoterapie u nádoru tlustého střeva a konečníku a současné trendy ve výzkumu tohoto onemocnění.
Úvod
Kolorektální karcinom je termín používaný pro adenokarcinom vycházející z oblasti tlustého střeva a konečníku.
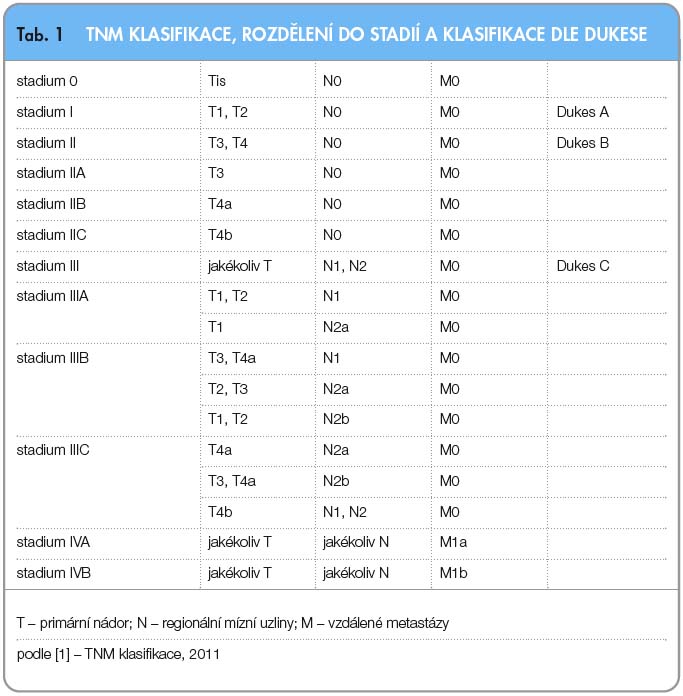 K popisu rozsahu onemocnění se používá systém TNM klasifikace popisující pokročilost nádoru (T klasifikace, T1–T4), rozsah postižení spádových uzlin (N klasifikace, N0–N2) a přítomnost metastatického postižení (M klasifikace, M0–M1). Onemocnění jsou zařazována do klinických stadií (I–IV), která určují prognózu. V současnosti je platné sedmé vydání TNM klasifikace z roku 2009, česká verze z roku 2011 (tab. 1) [1]. V minulosti byly používány i jiné systémy, jako například klasifikace dle Dukese (tab. 1). V České republice jsou asi dvě třetiny onemocnění diagnostikovány ve stadiu II nebo III, zhruba 20 % ve stadiu IV a 13–14 % v časnějších stadiích [2].
K popisu rozsahu onemocnění se používá systém TNM klasifikace popisující pokročilost nádoru (T klasifikace, T1–T4), rozsah postižení spádových uzlin (N klasifikace, N0–N2) a přítomnost metastatického postižení (M klasifikace, M0–M1). Onemocnění jsou zařazována do klinických stadií (I–IV), která určují prognózu. V současnosti je platné sedmé vydání TNM klasifikace z roku 2009, česká verze z roku 2011 (tab. 1) [1]. V minulosti byly používány i jiné systémy, jako například klasifikace dle Dukese (tab. 1). V České republice jsou asi dvě třetiny onemocnění diagnostikovány ve stadiu II nebo III, zhruba 20 % ve stadiu IV a 13–14 % v časnějších stadiích [2].
Dominantní kurativní léčbou adenokarcinomů tlustého střeva a konečníku je včas a správně provedený chirurgický zákrok. U pacientů s nádorem konečníku zde má roli i radioterapie. Za potenciálně kurabilní se považují resekabilní nádory stadia I–III a stadia IV s možností kompletní resekce primárního nádoru a metastatického postižení. Po resekci v závislosti na rozsahu onemocnění a biologických charakteristikách nádoru přetrvává výrazné riziko mikrometastáz ohrožujících pacienta relapsem onemocnění.
Princip adjuvantní chemoterapie
Adjuvantní terapie u nádorů tlustého střeva a konečníku znamená podání „zajišťující“ léčby pacientovi po radikálním chirurgickém výkonu za absence makroskopicky patrného nebo jinak detekovatelného reziduálního nádoru se záměrem snížit riziko návratu onemocnění. V současnosti je adjuvantní léčba podávána u pacientů ve stadiu III (pacienti s postižením spádových lymfatických uzlin bez ohledu na velikost primárního nádoru; T1–4 N1–2 M0) a u vybraných pacientů stadia II. Pacienti stadia II jsou nemocní bez postižení spádových lymfatických uzlin s rozsahem postižení primárního nádoru T3 (nádor prorůstající přes stěnu colon nebo rekta) nebo T4 (nádor prorůstající do okolních tkání a orgánů). Účinnost adjuvantní terapie nelze dobře kontrolovat. Hodnocení je možné pouze dlouhodobým sledováním statistických ukazatelů. Indikace adjuvantní terapie vychází ze znalosti míry a časového výhledu rizik, jejichž naplnění chceme předejít, a ze znalosti toho, jak lze tato rizika ovlivnit. Pouze potom je možné určit nákladovou efektivitu léčby.
Historie
Již od zavedení fluorovaných pyrimidinů do klinické praxe se objevovaly snahy o prokázání efektu adjuvantní terapie. Až do 80. let minulého století nebyl v žádné studii prokázán význam této terapie u kolorektálních karcinomů. Příčinou byl nedostatečný počet léčených pacientů při menším efektu chemoterapie, kombinace méně účinných cytostatik [3–5]. V metaanalýze všech publikovaných studií s adjuvantní léčbou u nádorů kolorekta do roku 1986 (17 studií porovnávajících chemoterapii s kontrolní skupinou, 6791 pacientů) byl pouze u režimů používajících fluorouracil prokázán malý přínos ve snížení mortality. Rozdíl v celkovém přežití nebylo možno statisticky prokázat. Všechny ostatní kombinace neprokázaly statisticky významné rozdíly, nebo dokonce prokázaly zhoršení výsledků [6].
Poprvé byl přínos adjuvantní chemoterapie doložen ve studii NSABP C-01 v roce 1988 [7]. Další studie, publikovaná v roce 1989, prokázala vliv kombinace fluorouracilu a levamizolu na celkové přežití u pacientů stadia C dle Dukese; toxicita této kombinace byla akceptovatelná [8]. Tento výsledek vedl k provedení velké konfirmační studie s kombinací levamizolu a fluorouracilu a aplikací chemoterapie po dobu jednoho roku [9, 10].
Studie NSABP s protokolem C-03 [11] a poté C-04 s použitou kombinací fluorouracilu s leukovorinem prokázala zlepšení DFS (disease free survival, přežití bez známek onemocnění) a snížení mortality ve skupině léčené fluorouracilem a leukovorinem [12]. Další významnou studií byla Intergroup 0089, publikovaná v roce 2005 s více než 3700 zařazenými pacienty, z nichž 80 % mělo stadium III a 20 % tzv. vysoce rizikové stadium II (s obstrukcí, perforací) [13]. Léčebné režimy podle Roswell Park a Mayo Clinic (kombinace fluorouracilu s leukovorinem podávaná 30–32 týdnů) přinesly podobné výsledky. V kontrolním rameni byl podáván fluorouracil s levamizolem po dobu 12 měsíců. Pětileté celkové přežití bylo kolem 65 % s menší toxicitou u kombinace flurouracilu s leukovorinem a kratší dobou podávání oproti kombinaci fluorouracilu s levamizolem. Tyto výsledky potvrdily další klinické studie, jako například adjCCA-01 [14]. Další studií byla italská studie INTACC [15] porovnávající kombinace fluorouracilu s levamizolem a leukovorinem. Tato studie neprokázala efekt přidání leukovorinu ke kombinaci fluorouracilu a levamizolu při 6měsíčním podávání. Na základě těchto studií se stala standardem 6měsíční zajišťující léčba fluorouracilem a leukovorinem.
Adjuvantní terapií pouze stadia II se zabývala studie QUASAR 1, publikovaná v roce 2007 [16]. Bylo zařazeno 3239 pacientů (91 % stadia II, 71 % nádorů colon). Typy podávané chemoterapie se v průběhu náboru měnily, základem bylo podávání fluorouracilu v různých modifikacích. Studie QUASAR 1 prokázala skromné, ale statisticky významné zlepšení DFS (disease-free survival, přežití bez známek onemocnění) a OS (overall survival, celkové přežití; hazard ratio [HR] = 0,78 a 0,82, respektive s absolutním rozdílem 5letého přežití 2,9 %) u pacientů s podanou kombinací fluorouracilu a leukovorinu oproti kontrolní skupině bez adjuvantní léčby.
Současnost
V současnosti je indikace adjuvantní chemoterapie na základě mnoha studií zcela jasná u pacientů s kolorektálním karcinomem stadia III a pacientů stadia II s karcinomem rekta. Kontroverzní zůstává podání u pacientů s karcinomem colon a sigmoidea ve stadiu II. U 20 % až 30 % pacientů s karcinomem tlustého střeva bez uzlinových metastáz se následně vyvine lokoregionální relaps onemocnění nebo generalizace během 5 let. Podle doporučení platných v současnosti se adjuvantní chemoterapie podává u vybraných pacientů stadia II (s rizikovými faktory jako T4, perforace, perineurální invaze, angioinvaze, nedostatečný počet vyšetřených uzlin), ale data nejsou zcela jednoznačná a probíhají zde další studie k objasnění problematiky. V současnosti používané kombinace jsou zvoleny na základě dále uvedených studií.
Kombinace s irinotekanem
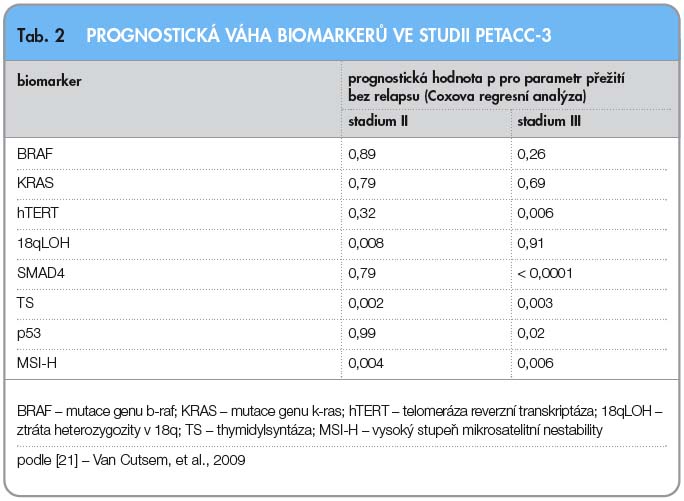 Po prokázání efektu cytostatika irinotekanu (CPT-11) v léčbě metastatického kolorektálního karcinomu [17–19] byly snahy o zařazení irinotekanu do protokolů adjuvantní terapie. Studie CALGB 89803 s 1264 randomizovanými pacienty, publikovaná v roce 2007, ale neprokázala zlepšení výsledků DFS ani OS [20]. Naopak v rameni s irinotekanem bylo zaznamenáno více toxicity. Při dalších analýzách byl ale prokázán efekt z přidání irinotekanu u pacientů s MSI-H tumory (s vysokým stupněm mikrosatelitní nestability). Také vyšetřování mutace KRAS neprokázalo rozdíly v přežití a DFS mezi pacienty s mutovaným a nemutovaným genem KRAS. Uskutečnily se ještě další studie na zhodnocení vlivu irinotekanu v adjuvantním podání s podobně neúspěšnými výsledky, například studie PETACC-3 [21]. V této studii bylo retrospektivně doplněno hodnocení prognostických faktorů, jako jsou MSI, 18qLOH, hladiny exprese p53, SMAD4, TS, mutace genů KRAS a BRAF. Na rozdíl od studie CALGB 89803 nález MSI-H nepredikoval prospěch z přidaného irinotekanu.
Po prokázání efektu cytostatika irinotekanu (CPT-11) v léčbě metastatického kolorektálního karcinomu [17–19] byly snahy o zařazení irinotekanu do protokolů adjuvantní terapie. Studie CALGB 89803 s 1264 randomizovanými pacienty, publikovaná v roce 2007, ale neprokázala zlepšení výsledků DFS ani OS [20]. Naopak v rameni s irinotekanem bylo zaznamenáno více toxicity. Při dalších analýzách byl ale prokázán efekt z přidání irinotekanu u pacientů s MSI-H tumory (s vysokým stupněm mikrosatelitní nestability). Také vyšetřování mutace KRAS neprokázalo rozdíly v přežití a DFS mezi pacienty s mutovaným a nemutovaným genem KRAS. Uskutečnily se ještě další studie na zhodnocení vlivu irinotekanu v adjuvantním podání s podobně neúspěšnými výsledky, například studie PETACC-3 [21]. V této studii bylo retrospektivně doplněno hodnocení prognostických faktorů, jako jsou MSI, 18qLOH, hladiny exprese p53, SMAD4, TS, mutace genů KRAS a BRAF. Na rozdíl od studie CALGB 89803 nález MSI-H nepredikoval prospěch z přidaného irinotekanu. 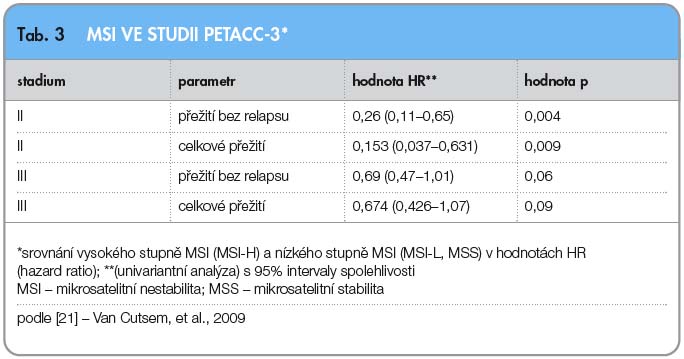 V této studii byl potvrzen prognostický význam markeru MSI-H ve stadiu II, overexprese p53 a ztráta SMAD4 u stadia III, TS u stadia II i III. U mutací genů KRAS a BRAF nebyla zjištěna prognostická role (tab. 2, 3). Studie PETACC-4 (EORTC 40012) pro nádory stadia II byla uzavřena kvůli pomalému náboru pacientů. V současnosti nejsou kombinace s irinotekanem v adjuvantním podání přípustné.
V této studii byl potvrzen prognostický význam markeru MSI-H ve stadiu II, overexprese p53 a ztráta SMAD4 u stadia III, TS u stadia II i III. U mutací genů KRAS a BRAF nebyla zjištěna prognostická role (tab. 2, 3). Studie PETACC-4 (EORTC 40012) pro nádory stadia II byla uzavřena kvůli pomalému náboru pacientů. V současnosti nejsou kombinace s irinotekanem v adjuvantním podání přípustné.
Kombinace s oxaliplatinou
Po zavedení oxaliplatiny do léčby metastatického kolorektálního karcinomu [22] probíhaly opět studie s adjuvantním podáním. V roce 2007 byla publikována studie NSABP C-07 [23]. V této studii bylo randomizováno 2492 pacientů radikálně odoperovaných ve stadiu II a III do 2 ramen v poměru 1 : 1 pro podání chemoterapie režimem FULV (kombinace bolusového fluorouracilu s leukovorinem, režim Roswell Park) versus FLOX (kombinace fluorouracilu s leukovorinem a oxaliplatinou). Signifikantně byl zlepšen primární cíl studie (DFS) u pacientů s přidanou oxaliplatinou (HR bylo 0,80; 95% CI 0,69–0,93) s absolutním rozdílem 6,2 % při 4letém DFS. Riziko toxicity, zejména ohrožujících průjmů, bylo vysoké v obou režimech.
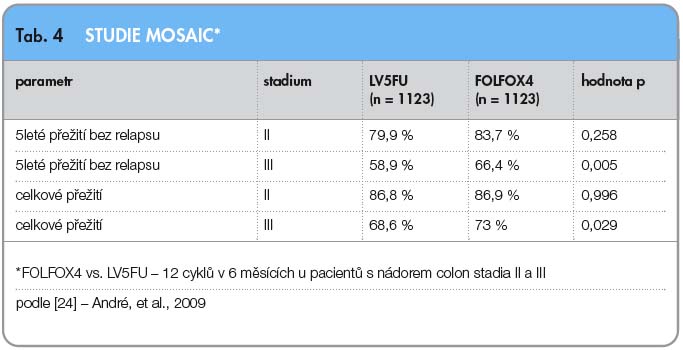 Ve studii fáze III MOSAIC bylo zařazeno 2246 pacientů (ITT populace) po radikální resekci ve stadiu II a III [24]. Pacienti byli randomizováni v poměru 1 : 1. Porovnávaly se režimy LV5FU (kombinace bolusového a kontinuálního podání fluorouracilu) s oxaliplatinou (FOLFOX4) oproti samotnému režimu LV5FU. Primárním cílem bylo DFS, sekundárními cíli OS a bezpečnost. Studie MOSAIC prokázala, že přidání oxaliplatiny k režimu de Gramont (fluorouracil a leukovorin) je prospěšné pouze u stadia III v parametrech přežívání bez relapsu i v parametrech celkového přežití (tab. 4). Kombinace s oxaliplatinou jsou nyní standardní v adjuvantním podání zejména u pacientů s nádory colon a rekta stadia III, nejasná je role ve stadiu II.
Ve studii fáze III MOSAIC bylo zařazeno 2246 pacientů (ITT populace) po radikální resekci ve stadiu II a III [24]. Pacienti byli randomizováni v poměru 1 : 1. Porovnávaly se režimy LV5FU (kombinace bolusového a kontinuálního podání fluorouracilu) s oxaliplatinou (FOLFOX4) oproti samotnému režimu LV5FU. Primárním cílem bylo DFS, sekundárními cíli OS a bezpečnost. Studie MOSAIC prokázala, že přidání oxaliplatiny k režimu de Gramont (fluorouracil a leukovorin) je prospěšné pouze u stadia III v parametrech přežívání bez relapsu i v parametrech celkového přežití (tab. 4). Kombinace s oxaliplatinou jsou nyní standardní v adjuvantním podání zejména u pacientů s nádory colon a rekta stadia III, nejasná je role ve stadiu II.
Kombinace s raltitrexedem
Studie PETACC-1, která probíhala od roku 1998, porovnávala izoefektivitu ralti-trexedu oproti fluorouracilu [25]. Při zařazení 1921 pacientů z celkem 2765 plánovaných byla studie pozastavena pro vyšší výskyt úmrtí v souvislosti s léčbou v rameni s raltitrexedem a následně uzavřena. Raltitrexed není v současnosti používán.
Kombinace s bevacizumabem
V letech 2004 až 2007 bylo zařazeno do tříramenné studie AVANT 3451 pacientů, z toho 2867 ve stadiu III [26]. Studie porovnávala 3 režimy chemoterapie: 1. rameno s režimem FOLFOX4 po dobu 24 týdnů, 2. rameno s režimem FOLFOX4 a bevacizumabem po dobu 24 týdnů, po nichž následovalo do 48 týdnů podávání samostatného bevacizumabu, 3. rameno s re-žimem XELOX po dobu 24 týdnů, poté následovalo opět podávání samostatného bevacizumabu do 48 týdnů. Primárním cílem bylo DFS, sekundárním cílem OS. Ramena s bevacizumabem neprokázala zlepšení výsledků ani v jednom z primárních cílů studie. Naopak, v ramenech s bevacizumabem bylo zaznamenáno více relapsů a úmrtí.
 Další významnou studií byla studie NSABP C-08 [27]. Celkem 2672 pacientů bylo randomizováno v poměru 1 : 1 do ramen s chemoterapií mFOLFOX6 s délkou podávání 6 měsíců s přidáním bevacizumabu a bez něj do celkové doby podávání 1 rok. Primární cíl, prodloužení DFS, nebyl statisticky potvrzen (tab. 5). Výsledky další studie s podáním bevacizumabu QUASAR 2 ještě nebyly publikovány.
Další významnou studií byla studie NSABP C-08 [27]. Celkem 2672 pacientů bylo randomizováno v poměru 1 : 1 do ramen s chemoterapií mFOLFOX6 s délkou podávání 6 měsíců s přidáním bevacizumabu a bez něj do celkové doby podávání 1 rok. Primární cíl, prodloužení DFS, nebyl statisticky potvrzen (tab. 5). Výsledky další studie s podáním bevacizumabu QUASAR 2 ještě nebyly publikovány.
Nahrazení fluorouracilu kapecitabinem
Na základě dat z léčby pokročilých stadií nádorů tlustého střeva byla vypracována studie X-ACT [28], která potvrdila stejnou efektivitu (žádný vliv na DFS a OS) a lepší toleranci kapecitabinu oproti bolusově podávanému fluorouracilu v adjuvantním podání u pacientů s nádory stadia III. Další potvrzení efektivity a bezpečnosti kapeci-tabinu přinesla například studie AVANT [26]. Kapecitabin se stal plnohodnotnou alternativou fluorouracilu.
Kombinace s inhibitory cyklooxygenázy
Z laboratorních a předchozích klinických dat o zásadní roli COX-2 dráhy v karcinogenezi kolorektálního karcinomu vycházela studie PETACC-5 (EORTC 40023), zahájená v roce 2004 [29]. Pacientům s nádorem tlustého střeva stadia III byla podávána standardní chemoterapie s fluorouracilem a v experimentálním rameni přidán celekoxib. Studie byla předčasně ukončena. Další studií, která zkoumala efekt inhibitorů cyklooxygenázy na celkové přežití u pacien-tů s nádory tlustého střeva a konečníku stadia II a III, byla studie VICTOR, probíhající od roku 2002 [30]. V roce 2004 bylo předčasně ukončeno přijímání pacientů, celkem jich bylo zařazeno 2404. Nebyl nalezen rozdíl v celkovém přežití ani prognostická nebo prediktivní hodnota exprese COX-2 v nádoru. Přidání inhibitorů cyklooxygenázy k chemoterapii není v současné době opod-statněné.
Budoucnost
V současnosti probíhají studie zamě-řené na vyřešení dalších otázek při adjuvantním podání – zvýšení efektu adjuvantní terapie, určení prognostických a prediktivních faktorů onemocnění, určení optimální doby terapie a určení skupiny pacientů stadia II, kteří mají z podávání adjuvantní léčby pros-pěch.
Přijímání pacientů – zatím bez prezentovaných výsledků – je ukončeno ve studii QUASAR 2, která porovnávala vliv přidaného bevacizumabu k chemoterapii kapecitabinem u nemocných s nádorem tlustého střeva a konečníku stadia II a III [31]. Primárním cílem je 3leté DFS společné pro stadia II a III (1892 pacientů), sekundárním cílem je 3leté DFS pouze u stadia III (1411 pacientů). Ukončení studie se očekává v pro-sinci 2013. Je otázkou, zda lze očekávat zásadně jiné výsledky než u studie AVANT nebo NSABP C-08, tedy takové, které by vedly ke změně dosavadního postupu.
Další významnou probíhající studií je PETACC-8 (EORTC 40052), jež porovnává adjuvantní terapii FOLFOX4 vs. FOLFOX4 plus cetuximab u radikálně resekovaného nádoru tlustého střeva [32]. Nábor byl uzavřen v listopadu 2009, celkem bylo randomizováno 2565 pacientů. Primárním cílem této studie je DFS. Dosud nebyly prezentovány žádné výsledky.
Významnou studií hodnotící perioperativní podání chemoterapie a radioterapie u pacientů s karcinomem rekta je studie PETACC-6 (EORTC 40054-22026) [33]. Byla zahájena v roce 2008 a dosud probíhá příjem pacientů. Je plánováno zařadit celkem 1090 nemocných s lokálně pokročilým karcinomem rekta. Pacienti jsou následně randomizováni mezi dvě ramena léčby. V prvním rameni je podáván kapecitabin s radioterapií před operačním zákrokem následovaný kapecitabinem po výkonu. Ve druhém rameni je podáván kapecitabin s oxaliplatinou a radioterapií před výkonem následovaný kapecitabinem s oxaliplatinou po výkonu. Primárním cílem je zhodnocení DFS. Původním termínem ukončení příjmu pacientů do studie byl stanoven prosinec 2011.
Zajímavou studií je PePiTA 001 NCT 00994864 (Preoperative Chemosensitivity Testing as Predictor of Treatment Benefit in Adjuvant Stage III Colon Cancer) [34]. Pracovní hypotézou zde je, že testování preoperativní senzitivity pomocí fluorodeoxyglukózové pozitronové emisní tomografie (FDG-PET) před prvním cyklem neoadjuvantní chemoterapie FOLFOX4 a po ukončení tohoto cyklu může identifikovat pacienty, kteří mají přínos z adjuvantní terapie FOLFOX u stadia III nádoru tlustého střeva. Bude analyzována korelace změn v akumulaci FDG během předoperačního období s parametry DFS a OS.
Další velmi zajímavou probíhající studií je Enroute +, která zkoumá vliv mikrometastáz pN0micro+ na prognózu a přežití u pacientů s nádory tlustého střeva sta-dia I a II [35].
Na základě zjištěných dat o roli MSI na prognózu pacienta, například ze studie Westry a kolektivu [36], byla zahájena velmi důležitá a zajímavá studie ECOG E5202; tato studie fáze III s 3610 pacienty sledovala efekt případně podané adjuvantní chemoterapie pacientům s nádorem tlustého střeva stadia II po předchozí chirurgické terapii [37]. Podle molekulárních markerů nádorové tkáně jsou pacienti rozděleni na vysoce a nízce rizikovou populaci. Pacienti zařazení do vysoce rizikové skupiny jsou s mikrosatelitní stabilitou (MSS) nebo nízkou mikrosatelitní nestabilitou (MSI-L) a mají ztrátu heterozygozity v 18q (18qLOH). Pacienti s nízkým rizikem jsou s vysokou mikrosatelitní nestabilitou (MSI-H; zde i podle předchozích studií není zjištěn přínos z terapie fluorouracilem) nebo MSS, MSI-L a bez ztráty heterozygozity v 18q (no los 18q). Kohorta pacientů s vysokým rizikem je dále randomizována v poměru 1 : 1. Jedna skupina dostane chemoterapii FOLFOX6 a druhá skupina FOLFOX6 s bevacizumabem. Kohorta pacientů s nízkým rizikem je bez adjuvantní terapie. Výsledky dosud nebyly publikovány. Podrobnější dosud známé informace o roli adjuvantní chemoterapie a možných prognostických a prediktivních faktorech u stadia II jsou uvedeny v práci Verga a kolektivu [38].
Dále probíhá několik studií zabývajících se možností zkrácení doby podání adjuvantní chemoterapie na 3 měsíce [39–42], některé navíc opět s preparáty bevacizumabem a celekoxibem [43, 44]. Další studie sledují časně zahájenou adjuvantní terapii (do 2 týdnů po výkonu) [45], neoadjuvantní podání léčby [46] a kombinaci neoadjuvantního a adjuvantního podání s panitumumabem [47]. Je zkoumáno též intraoperativní podání chemoterapie [48]. Výsledky těchto studií ani podrobnější informace dosud nebyly publikovány.
Závěr
Již několik let zůstává indikace a způsob podání adjuvantní chemoterapie beze změny. Používají se kombinace fluroura-cilu s leukovorinem a oxaliplatinou nebo kapecitabinu s oxaliplatinou. Je indikována u pacientů s karcinomem tlustého střeva a konečníku u stadia III, stadia II u nádorů konečníku a u rizikových pacientů s nádory tlustého střeva. Za rizikové charakteristiky je považován rozsah nádoru T4, perforace, perineurální invaze, angioinvaze, nedostatečný počet vyšetřených uzlin, operace v ileózním stavu. Statusy MSI, MSS nebo 18qLOH nemají prokázaný prediktivní význam pro adjuvantní terapii a nejsou nyní v rozhodování o poskytnutí adjuvantní terapie používány. Změny postupů bude možné uskutečnit až na základě vyhodnocení nyní probíhajících studií. Význam adjuvantní chemoterapie je potvrzen výsledky dvacetiletého vývoje kombinací a způsobů podání. Při hodnocení významu pro lokální i celkové přežití je nutné si uvědomit význam pečlivé a včas provedené chirurgická resekce po-dle všech onkochirurgických zásad. U stadia III byla pravděpodobnost pětiletého přežití bez adjuvantní terapie ve studiích kolem 44 %, u stadia II 70–75 %. Při podání adjuvantní léčby s fluorouracilem se pravděpodobnost pětiletého přežití stadia III zvyšuje nad hranici 50 % a při zařazení oxaliplatiny nad hranici 75 %. U stadia II není efekt adjuvantní chemoterapie tolik přesvědčivý, pravděpodobnost pětiletého přežívání zvyšuje na hodnoty převyšující 80 %. Kurativní efekt adjuvantní léčby lze vyjádřit zvýšeným přežitím o 6–10 % v 5 a více letech, paliativní pak prodloužením středního přežití a doby do relapsu prakticky u všech relabujících pacientů asi o 6 měsíců. Zdá se, že hlavní význam má adjuvantní léčba tam, kde nebyla nebo nemohla být ideálně načasována a provedena chirurgická léčba nebo u inaparentně diseminovaného onemocnění. Je předpoklad, že personalizovaná léčba, používaná již nyní v pokročilých stadiích, bude na základě nyní probíhajících studií zařazena i do konceptu adjuvantní léčby s dalším růstem pravděpodobnosti přežívání u pa-cientů s určitým typem biomarkerů. Na druhé straně patrně též budou identifikováni pacienti bez možnosti vyléčení a bez významu zatěžování adjuvantní terapií.
Seznam použité literatury
- [1] TNM klasifikace. http: //www.uzis.cz/publikace/tnm-klasifikace-zhoubnych-novotvaru-7-vydani-original-2011
- [2] Epidemiologie zhoubných nádorů v České republice. www.svod.cz
- [3] Panettiere FJ, Goodmann PJ, Costanzi JJ, et al. Adjuvant therapy in large bowel adenocarcinoma: longterm results of a Southwest Oncology Group Study. J Clin Oncol 1988; 6: 947–954.
- [4] Adjuvant therapy of colon cancer–results of a prospectively randomized trial. Gastrointestinal Tumor Study Group. N Engl J Med 1984; 310: 737–743.
- [5] Higgins GA Jr, Amadeo JH, McElhinney J, et al. Efficacy of prolonged intermitent therapy with combined 5-fluorouracil and methyl-CCNU following resection for carcinoma of large bowel. A Veterans Administration Surgical Oncology Group report. Cancer 1984; 53: 1–8.
- [6] Buyse M, Zeleniuch-Jacquotte A, Chalmers TC. Adjuvant therapy of colorectal cancer. Why we still don’t know. Jama 1988; 259: 3571–3578.
- [7] Wolmark N, Fisher B, Rockette H, et al. Postope-rative adjuvant chemotherapy or BCG for colon cancer: results from NSABP protocol C-01. Journal Nat Cancer Inst 1988; 80: 30–36.
- [8] Laurie JA, Moertel CG, Fleming TR, et al. Surgical adjuvant therapy of large-bowel carcinoma: an evaluation of levamisole and the combination of levamisole and fluorouracil. The North Central Cancer Treatment Group and the Mayo Clinic. J Clin Oncol 1989; 7: 1447–1456.
- [9] Moertel CG, Fleming TR, Macdonald JS, et al. Levamisole and fluorouracil for adjuvant thera-py of resected colon carcinoma. N Engl J Med 1990; 322: 352–358.
- [10] Moertel CG, Fleming TR, Macdonald JS, et al. Fluorouracil plus levamisole as effective adjuvant therapy after resection of stage III colon carcinoma: a final report. Ann Intern Med 1995; 122: 321–326.
- [11] Wolmark N, Rockette H, Fisher B, et al. The benefit of leucovorin-modulated fluorouracil as postoperative adjuvant therapy for primary colon Cancer: results from National Surgical Adjuvant Breast and Bowel Project protocol C-O3. J Clin Oncol 1993; 11: 1879–1887.
- [12] Wolmark N, Rockette H, Mamounas E, et al. Clinical trial to assess the relative efficacy of fluorouracil and leucovorin, fluorouracil and levamisole, and fluorouracil, leucovorin, and levamisole in patients with Dukes’B and C carcinoma of the colon: results from National Surgical Adjuvant Breast and Bowel Project protocol C-O4. J Clin Oncol 1999; 17: 3553–3559.
- [13] Haller DG, Catalano PJ, Macdonald JS, et al. Phase III study of fluorouracil, leucovorin, and levamisole in high-risk stage II and colon cancer: final report of Intergroup 0089. J Clin Oncol 2005; 23: 8671–8678.
- [14] Arkenau HT, Hermann A, Rettig K, et al. 5- fluorouracil plus leucovorin is an effective adjuvant chemotherapy in curatively resected stage III colon cancer: long-term follow-up results of the adjCCA-01 trial. Ann Oncol 2003; 14: 395–399.
- [15] Constanzo Di, Sombrero A, Gasperoni S, et al. Adjuvant chemotherapy in the treatment of colon cancer: randomized multicenter trial of the Ita-lian national intergroup of adjuvant chemothe-rapy in colon cancer (INTACC). Ann Oncol 2003; 14: 1365–1372.
- [16] Gray R, Barnwell J, McConkey C. Adjuvant chemotherapy versus observation in patients with colorectal cancer: a randomised study. Lancet 2007; 370: 2020–2029.
- [17] Cunningham D, Pyrhönen S, James RD, et al. Randomised trial of irinotecan plus supportive care versus supportive care alone after fluoro-uracil failure for patients with metastatic colorectal cancer. Lancet 1998; 352: 1413–1418.
- [18] Duillard JY, Cunningham D, Roth AD, et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicenter randomised trial. Lancet 2000; 355: 1041–1047.
- [19] Salz LB, Cox LV, Blanke C, et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer; Irinotecan Study Group. N Engl J Med 2000; 343: 905–914.
- [20] Saltz LB, Niedzwiecki D, Hollis D, et al. Irino-tecan Fluorouracil Plus Leucovorin Is Not Superior to Fluorouracil Plus Leucovorin Alone As Adjuvant Treatment for Stage III Colon Cancer: Results of CALGB 89803. J Clin Oncol 2007; 25: 3456–3461.
- [21] Van Cutsem E, Labianca R, Hossfeld D, et al. Randomized phase III trial comparing biweekly infusional fluorouracil/leucovorin alone or with irinotecan in the adjuvant treatment of stage III colon cancer: PETACC-3. J Clin Oncol 2009; 27: 3117–3125.
- [22] de Gramont A, Figer A, Seymour M, et al. Leucovorin and Fluorouracil With or Without Oxaliplatin as First-Line Treatment in Advanced Colorectal Cancer. J Clin Oncol 2000; 18: 2938–2947.
- [23] Kuebler JP, Wieand HS, O’Connell J, et al. Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: results from NSABP C-07. J Clin Oncol 2007; 25: 2198–2204.
- [24] André T, Boni C, Navarro M, et al. Improved over-all survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J Clin Oncol 2009; 27: 3109–3116.
- [25] Popov I, Wolls J, Carrato A, et al. Final results of the PETACC-1 trial of bolus 5-FU/LV vs raltitrexed: An unsuccessful story. J Clin Oncol 2008; 26: No 15S, 4053.
- [26] de Gramont A, Van Cutsem E, Tabernero J, et al. AVANT: Results from randomized, three-arm multinational phase III study to investigate bevacizumab with either XELOX or FOLFOX4 versus FOLFOX4 alone as adjuvant treatment for colon cancer. J Clin Oncol 2011; 29: No 4S, 362.
- [27] Wolmark N, Yothers M, O’Connell J, et al. A phase III trial comparing mFOLFOX6 to mFOLFOX6 plus bevacizumab in stage II or III carcinoma of the colon: Results of NSABP protocol C-08. J Clin Oncol 2009; 27: No 18S.
- [28] Twelves C, Wong A, Nowacki MP, et al. Capecitabine ad adjuvant treatment for stage III colon cancer N Engl J Med 2005; 352: 2696–2704.
- [29] National Cancer Institut, USA, portfolio databáze, PETACC-5 (EORTC 40023) http://www.cancer.gov/clinicaltrials/ search/view?cdrid=367335 &version=healthprofessional
- [30] Midgley RS, McConkey CC, Johnstone EC, et al. Phase III randomized trial assessing rofecoxib in the adjuvant setting of colorectal cancer: Final results of the VICTOR trial. J Clin Oncol 2010; 28: 4575–4580.
- [31] UK Clinical research network: portfolio databáze, Study QUASAR2.
- [32] National Cancer Institut, USA, portfolio databáze, studie PETACC-8 (EORTC 40052) http:// www.cancer.gov/clinicaltrials/search/view?cdrid=453839&version=health professional
- [33] National Cancer Institut, USA, portfolio databáze, studie PETACC-6 (EORTC 40054-www.cancer. gov/clinicaltrials/search/ view?cdrid=614916&version=Health Professional
- [34] U.S National Institutes of Health, portfolio databáze, Preoperative chemosensitivy testing as predictor of treatment benefit in adjuvant stage III. colon cancer“ ClinicalTrialsgov/ct2/show/ NCT00994864
- [35] Lips DJ, Koebrugge B, Liefers GJ, et al. The influence of micrometastases on prognosis and survival in stage I-II colon cancer patients: the Enroute + study. BMC Surg 2011; 11: 11.
- [36] Westra JL, Schaapveld M, Hollema H, et al. Determination od TP53 mutation is more relevant than microsatellite instability status for predic-tion of disease-free survival in adjuvant-treated stage III colon cancer patients. J Clin Oncol 2005; 23: 5635–5643.
- [37] National Cancer Institut, USA, http: //www.cancer.gov/clinicaltrials/search/view? cdrid=443410& version= HealthProfessional
- [38] Vergo M, Khrizman P, Meropol NJ, et al. Adjuvant chemotherapy for stage II colon cancer: Are we closer to finding the patients who benefit? Asco Educational Book page 2010; 123–129.
- [39] Phase III Randomized Study of 3 Months Versus 6 Months of Adjuvant Modified FOLFOX 6 Therapy in Patients With Stage III Colon Cancer http:// www.cancer.gov/ clinicaltrials/search/view?cdrid =647466&version= HealthProfessional&protocolsearchid=9830406
- [40] Phase III Randomized Study Comparing Two Schedules of Adjuvant Chemotherapy in Patients With Fully Resected High-Risk Stage II or III Colorectal Cancer http: //www.cancer.gov/clinicaltrials/search/view?cdrid=613042&version= HealthProfessional&protocolsearchid=9830406
- [41] Study Investigating the Role of Oxaliplatin Duration in Modified FOLFOX-6 Regimem as Adjuvant Colon Cancer Therapy,http://www.cancer.gov/clinicaltrials/search/view? cdrid=669486&version= HealthProfessional&protocolsearchid=9830406
- [42] Adjuvant Therapy (3 vs. 6 Months) With the FOLFOX 4 or XELOX for Stage II or Stage III Colon Cancer, http://www.cancer.gov/clinicaltrials/search/ view?cdrid=696877& version=HealthProfessional&protocolsearchid=9830406
- [43] FOLFOX-4 3months Versus 6 Months and Bevacizumab as Adjuvant Therapy for Patients With Stage II/III Colon Cancer, http: //www.cancer. gov/clinicaltrials/search/view? cdrid=593458&version= HealthProfessional&protocolsearchid= 9830406
- [44] Phase III Randomized Study of Adjuvant FOLFOX Chemotherapy Comprising Oxaliplatin, Leucovorin Calcium, and Fluorouracil With Versus Without Celecoxib in Patients With Resected Stage III Colon Cancer http://www.cancer.gov/clinicaltrials/search/view?cdrid= 675693&version=HealthProfessional&protocolsearchid=9830406
- [45] Early Commencement of Adjuvant Chemotherapy for Colon Cancer http://www.cancer.gov/clinicaltrials/search/view?cdrid=715734&version= HealthProfessional&protocolsearchid=9830406
- [46] Neoadjuvant Treatment of Colon Cancer, http:// www.cancer.gov/clinicaltrials/search/view?cdrid= 671719&version= HealthProfessional&protocolsearchid=9830406
- [47] Phase III Randomized Pilot Study of Neoadjuvant and Adjuvant Fluorouracil and Oxaliplatin With or Without Panitumumab in Patients With Resectable High-Risk Colon Cancer, http: //www.cancer.gov/clinicaltrials/search/view?cdrid=590089&version=Health Professional&protocolsearchid= 9830406
- [48] Intra-operative Chemotherapy With 5-FU for Colorectal Cancer Patients Receiving Curative Resection: Efficacy and Safety http://www.cancer.gov/ clinicaltrials/search/view?cdrid= 716328&version= HealthProfessional&protocolsearchid=9830406