Adjuvantní hormonoterapie postmenopauzálních pacientek s karcinomem prsu
Souhrn:
Krásenská M. Adjuvantní hormonoterapie postmenopauzálních pacientek s karcinomem prsu. Remedia 2018; 28: 331–335.
Adjuvantní hormonoterapie je základní součástí systémové léčby nemocných s hormonálně dependentním onemocněním. Podání tamoxifenu a inhibitoru aromatázy v této indikaci snižuje riziko rekurence nemoci, kontralaterálního karcinomu prsu a zlepšuje přežití. Součástí rozhodnutí, jak nejlépe konkrétní pacientku léčit, je zhodnocení rizika časného a pozdního relapsu onemocnění. Inhibitory aromatázy jsou ve srovnání s tamoxifenem o něco účinnější, jejich včasné zařazení do léčby je proto významné u pacientek s vyšším rizikem návratu nemoci v prvních letech po operaci, současně jsou hledány postupy, jak zmírnit rovněž riziko pozdního relapsu. V poslední době byly publikovány výsledky několika klinických studií s prodlouženým podáním adjuvantní hormonoterapie pacientkám, které byly v úvodu léčeny inhibitorem aromatázy. Toto sdělení shrnuje současné poznatky a doporučení pro léčbu postmenopauzálních nemocných, jak jsou uvedena v mezinárodních guidelines.
Summary:
Krasenska M. Adjuvant hormone therapy of post‑menopausal patients with breast cancer. Remedia 2018; 28: 331–335.
Adjuvant hormone therapy is the basic component of systemic therapy in patients with hormone‑dependent disease. The administration of tamofixen and aromatase inhibitor in this indication lowers the recurrence risk of the disease, contralateral breast carcinoma and improves survival. Part of the best treatment decision for a particular patient is the early and late disease relapse risk assessment. Aromatase inhibitors demonstrate slighlty better efficacy compared with tamofixen; therefore, introducing them into treatment in a timely manner is important in patients with higher disease relapse risk in the years following surgery. At the same time, methods of lowering late relapse risk are also sought. Recently, results of several clinical studies with prolonged administration of hormone therapy to patients initially treated with aromatase inhibitor were published. This review provides information on current understanding and recommendations for the treatment of post‑menopausal patients, as outlined in the international guidelines.
Key words: breast cancer, recurrence - menopause – tamoxifen, aromatase inhibitors.
Přibližně 75‒80 % postmenopauzálních pacientek s časným karcinomem prsu trpí hormonálně dependentním onemocněním (exprese estrogenového receptoru, ER) spojeným s přetrvávajícím rizikem relapsu choroby minimálně 15 let od operace [1]. Těmto nemocným by měla být v rámci adjuvantní léčby podána hormonoterapie, která redukuje riziko vzniku lokoregionální a vzdálené recidivy choroby, kontralaterálního karcinomu prsu a snižuje mortalitu na toto onemocnění [2,3].
Účinnost tamoxifenu a inhibitorů aromatázy
Tamoxifen podávaný po dobu pěti let redukuje riziko rekurence nemoci zhruba o polovinu během aktivní léčby a o jednu třetinu v dalších pěti letech, mortalitu téměř o jednu třetinu během prvních 15 let od diagnózy. Inhibitory aromatázy (IA) 3. generace (anastrozol, letrozol, exemestan), které se podávají jako iniciální adjuvantní terapie tzv. upfront, nebo sekvenčně po 2‒3 letech užívání tamoxifenu (na základě tzv. switch strategie), snižují ve srovnání se samotným pětiletým podáváním tamoxifenu riziko recidivy nemoci zhruba o dalších 30 % a mortalitu na karcinom prsu během prvních 10 let asi o 15 % [4,5]. Výraznější redukce výskytu recidiv při terapii IA ve srovnání s tamoxifenem byla v oxfordské metaanalýze EBCTCG (Early Breast Cancer Trialists’ Collaborative Group) pozorována pouze v době, kdy byl IA aktivně podáván [5]. Redukce počtu recidiv se projeví jako snížení mortality, které přetrvává dlouhodobě. U tamoxifenu byl pozorován přetrvávající efekt na redukci recidiv i v době, kdy již pacientka nebyla aktivně léčena (pokračující redukce počtu recidiv mezi 5.‒10. rokem a později, tzv. přenesený efekt, carry over effect). Tato redukce se opět projeví jako pokles mortality na karcinom prsu minimálně v dalších 15 letech od operace [5]. Ze včasného zahájení léčby IA tedy mají prospěch zejména pacientky, které jsou ohroženy vyšším rizikem časného relapsu onemocnění.
Kdy léčit pacientku inhibitorem aromatázy?
Vzhledem k vyšší účinnosti podávání IA oproti samotnému tamoxifenu se jeho zařazení v prvních pěti letech doporučuje u nemocných s vyšším rizikem recidivy, jako jsou pacienti s postižením uzlin, s vysokým gradem, s lobulární histologií a s HER2 pozitivitou [6]. Lze volit mezi switch strategií, kdy léčbu zahajujeme tamoxifenem na 2‒3 roky, nebo tzv. upfront podáváním inhibitoru aromatázy. Při rozhodování je třeba zohlednit riziko u konkrétní pacientky (střední riziko – switch, vysoké riziko – upfront IA), profil nežádoucích účinků, přidružená onemocnění a preferenci nemocné. Samotný tamoxifen na dobu pěti let je možné i nadále podávat pacientkám s nízkým rizikem relapsu (stadium I bez přítomnosti rizikových faktorů) a u všech nemocných, které léčbu IA netolerují.
Lobulární karcinom
Invazivní lobulární karcinom je méně častou variantou karcinomu prsu, představuje asi 10 % všech onemocnění [7]. Liší se od invazivního duktálního karcinomu epidemiologií, klinicko patologickými charakteristikami a odpovědí na systémovou léčbu (menší citlivost k chemoterapii). Klasický lobulární karcinom je hormonálně dependentní, s nízkým až středním histologickým gradem. Vzácnější je agresivnější varianta (pleiomorfní lobulární karcinom) [7].
Ve velké adjuvantní studii BIG 1 98, která zkoumala účinnost letrozolu ve srovnání s tamoxifenem v adjuvantní léčbě časného ER pozitivního karcinomu prsu, byla u nemocných s lobulárním karcinomem prokázána statisticky významně větší efektivita letrozolu. Pacientky (n = 2 923) byly rozděleny po centrální revizi histologického nálezu podle jejích výsledků (invazivní duktální/lobulární karcinom) a podle proliferace (hodnota Ki67) do čtyř následujících skupin: luminal A duktální/lobulární karcinom a luminal B duktální/lobulární onemocnění. Pacientky s lobulárním fenotypem měly výrazně větší přínos z léčby letrozolem bez ohledu na hodnotu proliferace. Lobulární luminal A ‒ doba přežití bez nemoci (disease free survival, DFS): poměr rizik (hazard ratio, HR) 0,50, 95% interval spolehlivosti (confidence interval, CI) 0,32‒0,78; lobulární luminal B ‒ DFS: HR 0,34, 95% CI 0,21‒0,55. Ve skupině nemocných s invazivními duktálními karcinomy měly z léčby letrozolem větší prospěch pouze pacientky s luminálními B nádory, tedy s nádory s vyšší proliferací (duktální luminal B ‒ DFS: HR 0,65, 95% CI 0,53‒0,79 vs. duktální luminal A ‒ DFS: HR 0,95, 95% CI 0,76‒1,20) [8]. U nemocných s lobulárním karcinomem má být IA zařazen do iniciální léčby, u onemocnění s vyšší proliferací nebo s vyšším gradem by měl být IA podán nejlépe upfront.
Pozdní relaps
Pacientky s časným karcinomem prsu jsou navzdory pětileté adjuvantní hormonální léčbě tamoxifenem nebo IA ohroženy rizikem recidivy po dobu nejméně 15 let od diagnózy (kumulativní roční riziko 2‒4 %). Asi polovina relapsů je pozdních [4]. Rizikovými faktory jsou stav uzlin a velikost tumoru. Předmětem klinických studií bylo zjištění, zda delší podávání hormonoterapie povede k další redukci relapsů a mortality.
Tamoxifen podávaný déle než pět let
Podávání tamoxifenu po dobu delší než pět let zkoumaly dvě velké randomizované klinické studie – ATLAS (Adjuvant Tamoxifen Longer Against Shorter) a aTTom (Adjuvant Tamoxifen: To Offer More?). Ve skupině nemocných léčených ve studii ATLAS tamoxifenem po dobu 10 let byla prokázána další redukce rizika relapsu (p = 0,002), mortality na karcinom prsu (p = 0,01) a úmrtí z jakékoliv příčiny (p = 0,01). Převážná část tohoto efektu se objevovala až v pozdější době. Zlepšení během 5.‒10. roku užívání tamoxifenu bylo jen mírné s mnohem výraznějším přeneseným efektem po dalších pěti letech (po 10 letech léčby redukce rizika recidivy o 39 %, p < 0,0001, mortality o 36 %, p < 0,0001) [9]. Podobné výsledky přinesla také britská studie aTTom [10]. Nejvýznamnějšími nežádoucími účinky bylo zvýšení rizika výskytu endometriálního karcinomu (2,9 %, významné u žen starších 45 let) včetně úmrtí na toto onemocnění (1,1 % nemocných) a tromboembolické nemoci. Přínos desetileté léčby tamoxifenem tedy výrazně převyšuje rizika komplikací.
Prodloužená adjuvantní léčba letrozolem po pěti letech užívání tamoxifenu
V randomizované, placebem kontrolované studii MA 17 byl zkoumán přínos pětileté léčby letrozolem po ukončené čtyř až šestileté léčbě tamoxifenem s trvající remisí onemocnění.
Při mediánu sledování 2,4 roku byla prokázána signifikantně významná redukce rizika recidivy v rameni s letrozolem (DFS: HR 0,57; p = 0,00008) [11]. Studie byla odslepena a všem pacientkám, které byly dosud léčeny placebem, byl nabídnut switch na letrozol. Ten signifikantně snižoval riziko vzniku vzdálených metastáz ve skupině nemocných s negativním i pozitivním nálezem na uzlinách (p = 0,0002) a signifikantně zlepšoval celkové přežití (overall survival, OS) o 39 % u nemocných s pozitivními uzlinami (HR 0,61; p = 0,04) [12], a to navzdory tomu, že celých 66 % pacientek léčených dosud placebem podstoupilo tzv. cross over na letrozol. Účinnost byla prokázána pro všechny podskupiny nemocných (starší 70 let, mladší pacientky). Nejčastějšími nežádoucími účinky byly artralgie, myalgie, alopecie, zvýšené riziko vzniku osteoporózy (8,1 % vs. 6,0 %) a nesignifikantní nárůst počtu osteoporotických fraktur (5,3 % vs. 4,6 %; p = 0,25).
Léčba inhibitory aromatázy delší než pět let
Studie MA 17 a některé
další prokázaly přínos delšího podávání adjuvantní
hormonoterapie ve smyslu redukce rizika pozdního relapsu
onemocnění. V současné době je pro pacientky středního
a vysokého rizika relapsu doporučeno zařazení IA již
do úvodní léčby (prvních pět let od diagnózy). Není
však příliš jasné, jak postupovat po jejím ukončení.
Několik klinických studií se snažilo najít odpověď na otázku,
zda bude pro nemocné i v této situaci delší trvání
léčby IA přínosem. Jde o studie MA 17R, NSABP B 42,
DATA, IDEAL a SOLE, jejichž výsledky již byly publikovány
a v přehledu je uvádí tabulka 1. Problémem je obtížná srovnatelnost dosažených
výsledků vzhledem k uspořádání studií a stanovení
různých sledovaných parametrů jako cílových ukazatelů.
Studie MA 17R
V roce 2016 byly poprvé zveřejněny na kongresu ASCO (American Society of Clinical Oncology) 2016 výsledky klinické studie MA 17R. Šlo o randomizovanou, dvojitě zaslepenou, placebem kontrolovanou studii fáze III, která zařadila 1 918 pacientek předléčených adjuvantní terapií IA po dobu 4,5‒6 let (většina nemocných byla předléčena tamoxifenem, medián délky podávání pět let, pouze 21 % nemocných tamoxifen neužívalo). Pacientky mohly být do studie zařazeny nejdéle dva roky poté, kdy ukončily předchozí léčbu IA (medián 6 měsíců). Následně byly randomizovány k podávání letrozolu v dávce 2,5 mg denně nebo placeba po dobu pěti let. Většina nemocných měla v úvodu tumor velikosti do 5 cm (T1 + T2 91 % nemocných), 47 % pacientek mělo negativní uzliny, 47 % pozitivní 1‒3 uzliny, postižení lymfatických uzlin klasifikované jako stadium N2–3 bylo zaznamenáno pouze u 4 % nemocných. Medián délky předchozího podávání IA před randomizací byl pět let, pacientky v době randomizace měly medián doby od diagnózy karcinomu prsu téměř 11 let. Primárním cílovým ukazatelem studie bylo pětileté přežití bez recidivy (lokoregionální, vzdálené, bez kontralaterálního karcinomu prsu), sekundární cílový ukazatel představovalo celkové přežití [13].
Léčba letrozolem zlepšila pětileté DFS včetně poklesu výskytu kontralaterálního karcinomu prsu (95 % v intervenčním rameni vs. 91 % ve skupině placeba; HR 0,66; p = 0,01), pětileté OS bylo však v obou ramenech stejné (93 % vs. 94 %; HR 0,97; p = 0,83). Letrozol významně snižoval výskyt kontralaterálního karcinomu prsu (roční incidence 0,21 % u letrozolu vs. 0,49 % u placeba), což vzhledem k proporčně významnému podílu na celkové redukci výskytu událostí může částečně vysvětlit chybějící vliv na mortalitu. Dalším důvodem je také to, že tato léčba byla zahajována po více než 10 letech od stanovení diagnózy onemocnění, kdy již úvodní riziko relapsu v čase klesá. Absolutní přínos prodloužené adjuvantní hormonoterapie je největší v prvních letech od diagnózy. Z nežádoucích účinků byly hlášeny artralgie a myalgie, letrozol zvyšoval výskyt nově zjištěné osteoporózy (11 % vs. 6 %) a osteoporotických fraktur (14 % vs. 9 %).
Studie NSABP B 42
NSABP B 42 byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie, která zkoumala adjuvantní hormonoterapii letrozolem u pacientek s časným ER pozitivním karcinomem prsu po dokončení předchozí adjuvantní hormonoterapie IA. Zařazeny mohly být pacientky stadia I‒III po pěti letech adjuvantní léčby (IA, nebo tamoxifen 2‒3 roky se switchem na IA). Nemocné byly randomizovány k podávání letrozolu nebo placeba na dobu pěti let. Primárním cílovým ukazatelem studie bylo DFS (lokální, regionální, vzdálená recidiva, sekundární nádor, úmrtí z jakékoliv příčiny jako první událost). Sekundární cílové ukazatele zahrnovaly OS, BCFI (breast cancer free interval, interval bez známek rekurence nebo výskytu kontralaterálního karcinomu prsu jako první událost), dobu do vzdálené recidivy (distant recurrence, DR), výskyt osteoporotické fraktury a arteriální trombotické příhody. Randomizováno bylo 3 966 nemocných v období září 2006 až leden 2010, 34 % pacientek bylo mladších 60 let, 57 % mělo negativní nález na uzlinách, 39 % bylo léčeno tamoxifenem, 14 % bylo HER2 pozitivních. Letrozol neprokázal statisticky významné zlepšení DFS (HR 0,85; p = 0,048) ani OS, prokázal však statisticky významnou 29% redukci v parametru BCFI (HR 0,71; p = 0,003) a 28% redukci DR (HR 0,72; p = 0,03). Výskyt osteoporotických fraktur byl vyšší v rameni s letrozolem (5,4 % vs. 4,8 %) [14].
Studie DATA
Výsledky multicentrické otevřené studie fáze III, která srovnávala období tří a šesti let léčby anastrozolem po 2‒3 letech užívání tamoxifenu u postmenopauzálních žen s ER pozitivním časným karcinomem prsu, byly publikovány na konferenci v San Antoniu v roce 2016 a koncem roku 2017 v časopise Lancet. V období červenec 2006 až srpen 2009 bylo randomizováno 1 663 pacientek (medián věku 57 let, medián velikosti tumoru 21 mm, nádory velikosti T3/4 představovaly 7 %, třetina nemocných byla N0, polovina N1, pN2/N3 mělo 15 % pacientek, HER2 pozitivitu 2 %, u 8 % nemocných nebyl znám status, adjuvantní trastuzumab nebyl standardní léčbou, 64 % nemocných bylo léčeno chemoterapií). Primárním cílovým ukazatelem studie bylo adaptované DFS (ADFS) definované jako DFS delší než tři roky po randomizaci (v úvodu byly všechny pacientky léčeny tři roky anastrozolem), nežádoucí příhody zahrnovaly lokální, regionální a vzdálené recidivy, sekundární ukazatele představovaly primární nádory prsu (invazivní, neinvazivní) a úmrtí z jakékoliv příčiny. Pětileté ADFS bylo 79 % ve tříletém rameni a 83 % v šestiletém rameni s anastrozolem (HR 0,78; p = 0,0528), u pacientek s pozitivním nálezem na uzlinách bylo HR 0,71 (p = 0,0232), u nemocných s N0 byla hodnota HR 1,01 (p = 0,9817) a u pacientek s pozitivitou obou receptorů (ER+/PR+) 0,68 (p = 0,0072) [15,16]. Při analýze se pětileté celkové přežití v obou ramenech nelišilo. Efektivita delšího podávání IA tak nebyla prokázána v celém souboru nemocných, ale měla význam pro definované skupiny pacientek (postižení uzlin, pozitivita obou hormonálních receptorů). Výskyt osteopenie/osteoporózy byl větší při delším podávání anastrozolu (21 % vs. 16 %). Studie pokračuje dalším sledováním, které má ověřit dlouhodobou účinnost a bezpečnost anastrozolu, další analýza je plánována na rok 2021.
Studie IDEAL
Další randomizovaná studie fáze III zkoumala optimální trvání prodloužené léčby letrozolem po standardní pětileté adjuvantní hormonoterapii. Výsledky byly publikovány na konferenci SABCS (San Antonio Breast Cancer Symposium) 2016. Ve studii bylo v období duben 2007 až listopad 2011 randomizováno celkem 1 824 nemocných v 74 nemocnicích v Nizozemsku. Pacientky byly předléčeny jakoukoliv adjuvantní hormonoterapií podávanou po dobu pěti let (v 87,9 % byl podán IA), přípustné bylo ukončení léčby maximálně před dvěma lety. Následně byly pacientky randomizovány k podávání letrozolu po dobu 2,5 roku nebo pěti let. Primárním cílovým ukazatelem studie bylo DFS, sekundárním cílovým ukazatelem OS a přežití bez vzdálené recidivy (distant disease free survival, DDFS), výskyt kontralaterálního karcinomu a bezpečnost. Studie neprokázala statisticky významný rozdíl ve sledovaných parametrech (HR pro DFS 0,96, 1% redukce výskytu kontralaterálního karcinomu) [17].
Studie SOLE
Výsledky studie SOLE prezentoval Colleoni na konferenci ASCO 2017. Studie měla zajímavé uspořádání, kdy randomizovala pacientky po ukončené pětileté adjuvantní hormonoterapii ke kontinuálnímu nebo intermitentnímu podávání letrozolu (aplikace devět měsíců v roce s následnou tříměsíční pauzou, kontinuální podávání v pátém roce léčby). Účinnost léčby ani její tolerance se v obou ramenech významně nelišily, což může být dobrou zprávou pro nemocné, které potřebují občasnou pauzu v terapii kvůli její toleranci [18].
Jak určit skupinu nemocných, které budou mít z delší léčby prospěch?
Vzhledem k výsledkům výše
uvedených studií není prodloužené podávání IA po předchozí
terapii těmito léčivy v prvních pěti letech adjuvantní
hormonoterapie standardně doporučeno všem nemocným. Měli bychom
o něm uvažovat u pacientek s vyšším rizikem
relapsu na základě klinických ukazatelů (větší tumor,
uzlinové postižení, typicky stadium II a III), u nemocných,
které byly v úvodu léčeny tamoxifenem, eventuálně při
průkazu vyššího genomického rizika [6]. Problematickým se jeví
určení vhodného genomického testu, který by vytipoval pacientky
s vyšším rizikem pozdní recidivy onemocnění. V práci
prezentované na SABCS 2016 se takovými testy pro predikci
pozdního relapsu (5.‒10. rok od diagnózy) ve studii
TransATAC jevily u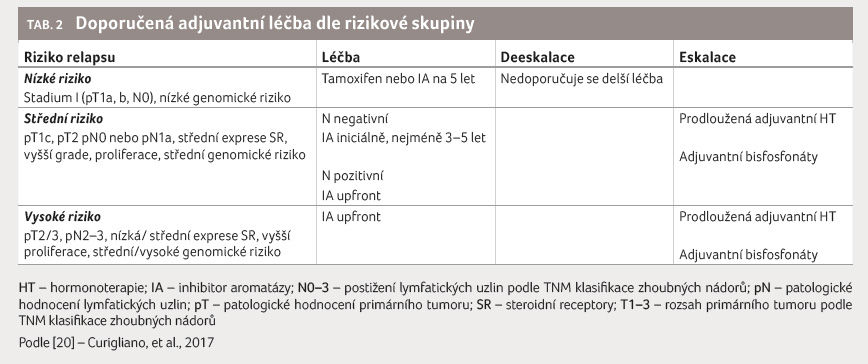 nemocných s negativním nálezem
na uzlinách BCI (Breast Cancer Index), ROR (Risk of Recurrence)
a EPclin (EndoPredict molecular clinicopathological
hybrid score), přičemž v případě nízkého rizika
není prodloužená adjuvantní hormonoterapie doporučena.
U pacientek s pozitivním nálezem na uzlinách nízké
riziko DR stanovené ROR/EPclin rovněž určovalo nemocné, které
nemají z prodloužené hormonoterapie prospěch [19].
nemocných s negativním nálezem
na uzlinách BCI (Breast Cancer Index), ROR (Risk of Recurrence)
a EPclin (EndoPredict molecular clinicopathological
hybrid score), přičemž v případě nízkého rizika
není prodloužená adjuvantní hormonoterapie doporučena.
U pacientek s pozitivním nálezem na uzlinách nízké
riziko DR stanovené ROR/EPclin rovněž určovalo nemocné, které
nemají z prodloužené hormonoterapie prospěch [19].
Pro běžnou praxi v České republice je vhodné řídit se aktuálními mezinárodními doporučeními, např. závěry konsenzu z konference v St. Gallen z roku 2017 [6], jak je uvádí Modrá kniha České onkologické společnosti [20], resp. v tomto textu stručně tabulka 2.
Závěr
V současné době je adjuvantní hormonoterapie doporučena pro všechny nemocné s ER pozitivním časným karcinomem prsu. U pacientek se středním a vysokým rizikem relapsu má být vždy zařazen režim IA, a to již v prvních pěti letech terapie (formou upfront nebo switche), a je doporučeno dle tolerance a preference nemocné zvážit prodloužené podávání hormonoterapie. U pacientek s nízkým rizikem postačí standardně pětiletá léčba. Lepší toleranci prodloužené léčby IA lze očekávat u mladších nemocných bez průkazu závažné osteopenie. Velmi doporučujeme v souladu s mezinárodními guidelines zvažovat u postmenopauzálních pacientek také podání adjuvantních bisfosfonátů v režimu samoplátce, které mohou dále redukovat riziko kostního relapsu, snižují mortalitu a jako příznivý vedlejší účinek rovněž redukují riziko úbytku kostní hmoty [6,21].
Seznam použité literatury
- [1] Saphner T, Tormey DC, Gray R. Annual hazard rates of recurrence for breast cancer after primary therapy. J Clin Oncol 1996; 14: 2738‒2746.
- [2] Early Breast Cancer Trialists’ Collaborative Group: Effects of chemotherapy and hormonal therapy for early breast cancer reccurence and 15‑year survival: An overview of the randomised trials. Lancet 2005; 365: 1687‒1717.
- [3] Early Breast Cancer Trialists’ Collaborative Group: Effects of adjuvant tamoxifen and of cytotoxic therapy on mortality in early breast cancer: An overview of 61 randomised trials among 28,896 women. N Engl J Med 1988; 319: 1681‒1692.
- [4] Early Breast Cancer Trialists’ Collaborative Group: Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient‑level meta‑analysis of randomised trials. Lancet 2011; 378: 771‒784.
- [5] Early Breast Cancer Trialists’ Collaborative Group: Aromatase inhibitors versus tamoxifen in early breast cancer: patient‑level meta‑analysis of the randomised trials. Lancet 2015; 386: 1341‒1352.
- [6] Curigliano G, Burstein HJ, Winer EP, et al. De‑escalating and escalating treatments for early‑stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Ann Oncol 2017; 28: 1700–1712.
- [7] Rakha EA, Ellis IO. Lobular breast carcinoma and its variants. Semin Diagn Pathol 2010; 27: 49‒61.
- [8] Filho OM, Giobbie‑Hurder A, Mallon E, et al. Relative effectiveness of letrozole compared with tamoxifen for patients with lobular carcinoma in the BIG 1‑98 trial. J Clin Oncol 2015; 33: 2772‒2779.
- [9] Davies C, Pan H, Godwin J, et al. Long‑term effect of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor‑positive breast cancer: ATLAS, a randomised trial. Lancet 2013; 381: 805‒816.
- [10] Gray RG, Rea D, Handley K, et al. aTTOm: Long‑term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years in 6,953 women with early breast cancer. J Clin Oncol 2013; 31(Suppl), Abstr 5.
- [11] Goss PE, Ingle JN, Martino S, et al. A randomized trial of letrozole in postmenopauzal women after five years of tamoxifen therapy for early‑stage breast cancer. N Engl J Med 2003; 349: 1793‒1802.
- [12] Goss PE, Ingle JN, Martino S, et al. A randomized trial of letrozole following tamoxifen as extended adjuvant therapy in receptor‑positive breast cancer: updated findings from NCIC CTG MA.17. J Natl Cancer Inst 2005; 97: 1262‒1271.
- [13] Goss PE, Ingle JN, Pritchard NJ, et al. Extending aromatase‑inhibitor adjuvant therapy to 10 years. N Engl J Med 2016; 375: 209‒219.
- [14] Mamounas EP, Bandos H, Lembersky BC, et al. A randomized, double‑blinded, placebo‑controlled clinical trial of extended adjuvant endocrine therapy (tx) with letrozole (L) in postmenopausal women with hormone‑receptor (+) breast cancer (BC) who have completed previous adjuvant tx with an aromatase inhibitor (AI): Results from NRG Oncology/NSABP B‑42. 2016 San Antonio Breast Cancer Symposium (Abstract S1‑05).
- [15] Tjan‑Heijnen VCG, van Hellemond IEG, Peer PGM, et al. First results from the multicenter phase III DATA study comparing 3 versus 6 years of anastrozole after 2‒3 years of tamoxifen in postmenopausal women with hormone receptor‑positive early breast cancer. 2016 San Antonio Breast Cancer Symposium (Abstract S1‑03).
- [16] Tjan‑Heijnen VCG, van Hellemond IEG, Peer PGM, et al. Extended adjuvant aromatase inhibition after sequential endocrine therapy (DATA): a randomised, phase 3 trial. Lancet Oncol 2017; 18: 1502‒1511.
- [17] Blok EJ, van de Velde CJH, Meershoek‑Klein Kranenbarg EM, et al. Optimal duration of extended letrozole treatment after 5 years of adjuvant endocrine therapy; results of the randomized phase III IDEAL trial (BOOG 2006‑05). 2016 San Antonio Breast Cancer Symposium (Abstract S1‑04).
- [18] Colleoni M, Luo W, Karlsson P, et al. SOLE (Study of Letrozole Extension): A phase III randomized clinical trial of continuous vs intermittent letrozole in postmenopausal women who have received 4‒6 years of adjuvant endocrine therapy for lymph node‑positive, early breast cancer (BC). J Clin Oncol 2017; 35: Abstract 503.
- [19] Sestak I, Buus R, Cuzick J, et al. Comprehensive Comparison of Prognostic Signatures for Breast Cancer Recurrence in TransATAC. 2016 San Antonio Breast Cancer Symposium (Abstract S1‑05).
- [20] Curigliano G, Burstein HJ, Winer E, et al. De‑escalating and escalating treatments for early‑stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Ann Oncol 2017; 28: 1700‒1712.
- [21] Modrá kniha České onkologické společnosti. Dostupné na: http://www.linkos.cz
- [22] Dhesy‑Thind S, Fletcher GG, Blanchette PS, et al. Use of adjuvant bisphosphonates and other bone‑modifying agents in breast cancer: a cancer care Ontario and American Society of Clinical Oncology clinical practice guideline. J Clin Oncol 2017; 35: 2062‒2081.