Agonisté receptoru pro glukagon-like peptid-1 a jejich zařazení do algoritmu léčby diabetu mellitu 2. typu
Nové poznatky o etiopatogenezi diabetu mellitu 2. typu (DM2T) ovlivnily strategii a taktiku léčby tohoto onemocnění. V nedávné době se rozšířila léčba DM2T o novou skupinu antidiabetik – inkretiny. K jejich uplatnění přispěl rozvoj poznání mechanismu účinku inkretinového hormonu glukagon-like peptidu-1 (GLP-1) na homeostázu glukózy. Článek se podrobněji zabývá účinkem GLP-1 a využitím agonistů receptoru pro glukagon-like peptid-1 (GLP-1R), kam řadíme analoga GLP-1 (do klinické praxe uvedený liraglutid) a látky založené na exendinu-4 (do klinické praxe uvedený exenatid a exenatid LAR). Účinek těchto léků na kompenzaci DM2T je popsán na základě výsledků kontrolovaných klinických studií u diabetiků 2. typu. Dosavadní výsledky léčby agonisty GLP-1R prokázaly vedle zlepšení kompenzace DM2T i korekci dalších metabolických odchylek u diabetiků 2. typu. Data dosud získaná z těchto studií zatím vedou k předpokladu i jistého dlouhodobého příznivého efektu na kardiovaskulární morbiditu či mortalitu.
Úvod
Diabetes mellitus 2. typu (DM2T) je komplexní a progresivní onemocnění, které je nyní dle odhadu diagnostikováno asi u 257 milionů lidí na celém světě [1].
Dlouhá léta se v literatuře uvádí, že pa-togeneze DM2T je duální, tedy že ke vzniku nemoci je nutná současná přítomnost periferní a centrální inzulinové rezistence a poruchy sekrece inzulinu, jež není schopna kompenzovat jeho zvýšenou potřebu a snížené působení v důsledku inzulinové rezistence.
V současné době víme, že patofyziologické poruchy, které vedou ke vzniku DM2T, jsou komplexnější. V posledních letech, po objevení a potvrzení existence inkretinových hormonů a jejich inkretinového efektu, se vědecký výzkum soustředil na další poruchy endokrinní sekrece pankreatu u diabetiků 2. typu. Tyto poruchy zahrnují zvýšenou sekreci glukagonu A-buňkami Langerhansových ostrův-ků pankreatu, která se podílí na vzniku nadměrné produkce glukózy v játrech, a dále nedostatečnou stimulaci sekrece inzulinu B-buňkami střevními hormony – inkretiny [2].
Farmaceutický výzkum se zaměřil na možnost terapeutického využití účinku inkretinových hormonů v léčbě DM2T. Výsledkem je zavedení nové skupiny léků – agonistů GLP-1R, působících na snížení glykemie obdobně jako přirozený lidský inkretinový hormon GLP-1. Dosavadní výsledky prokazují, že je vhodné tyto nové léky kombinovat s dalšími dosud použí-vanými léčebnými přístupy a dosáhnout tak lepší kompenzace diabetu.
Obecně v léčbě DM2T platí, že u nově diagnostikovaného diabetika bez přítomnosti komplikací by léčba měla být intenzivní, s cílem dosáhnout cílových hodnot kompenzace [3], a měla by být preferována terapie léky, které nezvyšují hmotnost a nezpůsobují hypoglykemii.
Agonisté GLP-1R představují novou třídu antidiabetik, jež mohou svými vlastnostmi umožnit dosažení efektivní tera-peutické intervence u pacientů s DM2T.
Inkretiny
![Inkretinový efekt – rozdíl v sekreci inzulinu jako odpověď na glukózu podanou per os oproti intravenóznímu podání glukózy – měřeno hladinou C-peptidu; podle [4] – Nauck, et al., 1986.](https://www.remedia.cz/photo-a-28802---.jpg) Znalosti účinku působků uvolňovaných z buněk střevní sliznice v reakci na stimulaci potravou jsou staré více než sto let. Pro tyto látky byl používán pojem inkretiny a k jejich zásadnímu poznání přispělo až zavedení laboratorního stanovování hladiny inzulinu radioimunoanalýzou v 70. letech minulého století. Teorie inkretinových hormonů pak byla potvrzena srovnáním hladiny inzulinu po podání glukózy perorálně a intravenózně. Tato měření prokázala, že zvýšení hladiny inzulinu po perorálním podání glukózy je výrazně vyšší než při podání intravenózním, a tento jev byl nazván inkretinový efekt (graf 1). Dnes se předpokládá, že se tento efekt podílí na celkové inzulinové sekreční odpovědi asi 60–70 % [4].
Znalosti účinku působků uvolňovaných z buněk střevní sliznice v reakci na stimulaci potravou jsou staré více než sto let. Pro tyto látky byl používán pojem inkretiny a k jejich zásadnímu poznání přispělo až zavedení laboratorního stanovování hladiny inzulinu radioimunoanalýzou v 70. letech minulého století. Teorie inkretinových hormonů pak byla potvrzena srovnáním hladiny inzulinu po podání glukózy perorálně a intravenózně. Tato měření prokázala, že zvýšení hladiny inzulinu po perorálním podání glukózy je výrazně vyšší než při podání intravenózním, a tento jev byl nazván inkretinový efekt (graf 1). Dnes se předpokládá, že se tento efekt podílí na celkové inzulinové sekreční odpovědi asi 60–70 % [4].
Obecně se za inkretiny, hormony produkované střevem a fyziologicky stimulující inzulinovou sekreci, uznávají glukózodependentní inzulinotropní polypeptid (GIP), objevený v roce 1969, a glukagon-like peptid-1 (GLP-1), který byl popsán v roce 1978.
![Inkretinový efekt u diabetiků: srovnání plazmatické hladiny inzulinu po intravenózním a po perorálním podání glukózy u zdravých osob a u pacientů s diabetem 2. typu; podle [4] – Nauck, et al., 1986.](https://www.remedia.cz/photo-a-28803---.jpg) Koncepce inkretinové léčby DM2T vychází z poznatku, že se inkretiny spolupodílí na patofyziologii diabetu. Požití stravy nevede u diabetiků 2. typu k dostatečnému vyplavení GLP-1, takže stimulace sekrece inzulinu a suprese glukagonu je u nich nedostatečná (graf 2).
Koncepce inkretinové léčby DM2T vychází z poznatku, že se inkretiny spolupodílí na patofyziologii diabetu. Požití stravy nevede u diabetiků 2. typu k dostatečnému vyplavení GLP-1, takže stimulace sekrece inzulinu a suprese glukagonu je u nich nedostatečná (graf 2).
V léčbě DM2T je využíván GLP-1, který je secernován enteroendokrinními L-buňkami v distálním ileu a v proximální části colon. GLP-1 působí přes specifický receptor GLP-1R. Tento receptor je exprimován v řadě tkání, včetně B-buněk a A-buněk pankreatu, v mozku, v ledvinách, v srdci, v gastrointestinálním traktu včetně parietálních buněk žaludku a také v buňkách cévní stěny. Po stimulaci potravou se hladina GLP-1 zvyšuje na 2–3násobek bazální hladiny, po jeho navázání na GLP-1R na B-buňkách se zvýší glukózodependentní sekrece inzulinu a prostřednictvím vazby na GLP-1R na A-buňkách dojde ke snížení glukagonové sekrece.
Zde je nutno zdůraznit, že vliv na tyto endokrinní buňky pankreatu je závislý na hladině glukózy, takže je minimalizováno riziko hypoglykemie, je-li tento efekt GLP-1 použit v léčbě hyperglykemie u DM2T. V experimentech na zvířatech zvyšuje GLP-1 transkripci a expresi inzulinového genu, stimuluje proliferaci B-buněk pankreatu a inhibuje jejich apoptózu, dále dochází ke zvýšení proliferace B-buněk a zvýšení obsahu inzulinu v Langerhansových ostrůvcích pankreatu. Zda je tento účinek přítomen u lidí, zatím není zcela jasné [5].
GLP-1 ovlivňuje postprandiální hyper-glykemii i tím, že snižuje sekreci žaludeční kyseliny a pankreatických trávicích enzymů, zpomaluje evakuaci žaludku a snižuje tak příjem potravy [5].
GLP-1 má účinky také v CNS – jeho podání snižuje pocit hladu a snižuje příjem potravy i tekutin, což vede k poklesu tělesné hmotnosti [6]. Data získaná hlavně z experimentálních studií se zvířaty vypovídají o tom, že GLP-1 má též kardioprotektivní efekt – jeho podávání vede ke zmenšení velikosti infarktového ložiska a u dilatační kardiomyopatie ke zlepšení funkce levé komory srdeční [7].
GLP-1 má po uvolnění do cirkulace velmi krátký biologický poločas eliminace (obvykle kratší než 2 minuty), což způsobuje rychlá inaktivace serinovou peptidázou dipeptidylpeptidázou-4 (DPP-4). Výsledkem výzkumů orientovaných na využití tohoto hormonu v léčbě pak bylo objevení dvou nových léčebných přístupů využívajících inkretinového efektu.
Prvním přístupem je farmakologická inhibice DPP-4 pomocí inhibitorů tohoto enzymu, které jsou souhrnně nazvány
gliptiny. Inhibitory DPP-4 prodlužují poločas endogenního GLP-1 a vedou ke zvýšení hladiny endogenně produkovaného GLP-1 [8].
Druhou možnost představuje podání tzv. agonistů receptoru pro GLP-1, což jsou látky, které se váží na GLP-1R a zároveň jsou rezistentní vůči účinkům DPP-4 [9]. Jedná se o dvě strukturální skupiny léků:
- látky založené na exendinu-4, který má částečnou podobnost s endogenním GLP-1;
- látky, které mají strukturu bližší endogennímu humánnímu GLP-1, tedy analoga GLP-1.
Podáním agonistů GLP-1R lze dosáhnout plné restituce antidiabetického účinku GLP-1. Tyto látky jsou peptidy a je nutno je podávat v subkutánní injekci. V klinické praxi jsou v České republice dostupné dvě léčivé látky: exenatid a liraglutid. Trendem je vývoj nových látek s dlouhodobějším účinkem a s méně častou frekvencí aplikace (například 1krát týdně).
Exenatid
Prvním agonistou GLP-1R schváleným k užívání v klinické praxi byl v roce 2005 exenatid. Je to syntetická forma v přírodě se vyskytujícího peptidu exendinu-4, který byl objeven ve slinách ještěrky korovce jedovatého (Heloderma suspectum). Je složen z 39 aminokyselin a má z 53 % shodnou sekvenci aminokyselin s lidským GLP-1. To způsobuje, že je rezistentní k de-gradaci DPP-4. Jeho poločas je 2,4 hodiny. Exendin-4 má navíc 1000krát silnější afinitu ke GLP-1R než endogenní GLP-1. Po vazbě na lidský GLP-1R působí aktivaci stejných signálních kaskád jako endogenní GLP-1 a rovněž klinické účinky exenatidu jsou prakticky shodné s GLP-1. Je podáván subkutánně 2krát denně [5].
Hlavní účinky exenatidu
Po subkutánním podání dochází ke zvýšení sekrece inzulinu z B-buněk pankreatu. Sekrece je závislá na glykemii – k sekreci tedy nedochází při normálních nebo nižších hodnotách glykemie. Exenatid také snižuje neadekvátně zvýšenou sekreci glukagonu a zpomaluje vyprazdňování žaludečního obsahu. Při dlouhodobém podávání dochází ke snížení příjmu potravy, což je způsobeno zvýšeným pocitem sytosti, a dojde k poklesu hmotnosti nemocného [10].
Klinické studie s exenatidem
Podávání exenatidu bylo hodnoceno v kontrolovaných klinických studiích u pa-cientů ve všech stadiích DM2T, a to jak v monoterapii, tak v kombinaci s metforminem, s deriváty sulfonylurey, s glitazony i v kombinaci s inzulinem.
Ve studii trvající 24 týdnů vedla monoterapie exenatidem v dávce 5 µg dvakrát denně k signifikantnímu poklesu koncentrace HbA1c o 0,7 % a u skupiny léčené dávkou 10 µg dvakrát denně o 0,9 %, ve srovnání s poklesem o 0,2 % ve skupině s placebem. V obou skupinách dosáhlo téměř 50 % (46 %, resp. 48 %) pacientů hodnoty HbA1c < 5,3 % (IFCC). Toto zlepšení bylo spojeno též s významným poklesem hmotnosti u obou skupin léčených exenatidem: o 2,8 kg, respektive o 3,1 kg [11].
![Studie AMIGO: snížení hladiny HbA1c po 30 týdnech léčby exenatidem; podle [12–14] – DeFronzo, et al., 2005, Buse, et al., 2004, Kendall, et al., 2005. MET – metformin; SU – derivát sulfonylurey](https://www.remedia.cz/photo-a-28804---.jpg) Ve třech randomizovaných, placebem kontrolovaných studiích fáze III (AC2993: Diabetes Management for Improvement Glucose Outcomes – AMIGO I–III) byl exena-tid testován po dobu 30 týdnů u pacientů nedostatečně kompenzovaných maximál-ními dávkami metforminu nebo deriváty sulfonylurey v monoterapii nebo kombi-nací metforminu a derivátu sulfonylurey [12–14]. Exenatid vedl k signifikantnímu poklesu HbA1c o 0,40–0,86 % a k redukci hmotnosti o 1,6–2,8 kg (graf 3).
Ve třech randomizovaných, placebem kontrolovaných studiích fáze III (AC2993: Diabetes Management for Improvement Glucose Outcomes – AMIGO I–III) byl exena-tid testován po dobu 30 týdnů u pacientů nedostatečně kompenzovaných maximál-ními dávkami metforminu nebo deriváty sulfonylurey v monoterapii nebo kombi-nací metforminu a derivátu sulfonylurey [12–14]. Exenatid vedl k signifikantnímu poklesu HbA1c o 0,40–0,86 % a k redukci hmotnosti o 1,6–2,8 kg (graf 3).
Po ukončení fáze III se pak někteří pa-cienti dále účastnili otevřeného sledování, které bylo uzavřeno po 3 letech a mělo odpovědět na otázku, zda pozitivní účinky exenatidu přetrvávají dlouhodobě. Tato otevřená studie [15] potvrdila, že u 217 pa-cientů, kteří byli léčeni metforminem, deriváty sulfonylurey nebo jejich kombinací a kterým byl exenatid podáván 2krát denně v dávce 10 mg po dobu 3 let, došlo k průměrnému snížení HbA1c o 1,0 %; toto snížení HbA1c bylo zachováno po dobu 3letého sledování a byl zaznamenán pokles hmotnosti o 5,3 kg. Došlo také ke zlepšení indexu HOMA-B (index hodnotící funkci B-buněk), ke snížení krevního tlaku, k poklesu hladiny alanin aminotransferázy a ke snížení hladin lipidů.
Exenatid (v dávce 10µg 2krát denně) přidaný ke glitazonu v monoterapii nebo ke kombinaci glitazonu s metforminem vedl v klinické studii, jíž se účastnilo 233 diabetiků 2. typu, po 16 týdnech podávání ke snížení HbA1c o 0,98 % ve srovnání s placebem a ke snížení tělesné hmotnosti o 1,5 kg [16].
Léčba exenatidem byla také srovnávána s terapií dlouhodobě působícím inzulinem u pacientů s DM2T s neuspokojivou kompenzací při podávání kombinace metforminu a derivátu sulfonylurey v maximálních dávkách. Ve 26týdenní studii bylo 551 pacientů randomizováno k léčbě exenatidem v dávce 10 mg dvakrát denně nebo k léčbě inzulinem glarginem jednou denně s titrací dávky k dosažení glykemie nalačno nižší než 5,6 mmol/l. Na konci
studie dosáhly obě skupiny srovnatelného zlepšení – snížení HbA1c o 1,1 %. Podávání glarginu (průměrná dávka 24,9 IU/den) vedlo k významnějšímu poklesu glykemie nalačno, exenatid významněji snižoval glykemii postprandiální. Hmotnost pacientů klesla při léčbě exenatidem o 2,3 kg, zatímco léčba glarginem vedla ke zvýšení hmotnosti o 1,8 kg. Celkový výskyt symptomatických hypoglykemií byl v obou skupinách srovnatelný, nižší výskyt nočních hypoglykemií byl zaznamenán při léčbě exenatidem [17].
Exenatid LAR
V roce 2011 schválila EMA (European Medicines Agency) do klinického užívání exenatid s prodlouženým hypoglykemizujícím účinkem – exenatid LAR (Long Acting Release, tedy pomalu se uvolňující). Exenatid LAR je polyaktidovou glykolidovou suspenzí exenatidu, která významně prodlužuje jeho účinnost. Tato retardovaná forma je podávána pouze 1krát týdně, obvykle v dávce 2,0 mg. Tento preparát byl testován v programu klinických randomizovaných studií s akronymem DURA-TION (Diabetes therapy Utilization: Researching changes in A1c, weight and other factors Through Intervention with exena-tide ONce weekly), do nichž byli zařazeni pacienti dosud neúspěšně léčení nefarmakologicky i kombinací s perorálními antidiabetiky (PAD) – 68 % pacientů bylo léčeno monoterapií metforminem. V těchto studiích byly účinnost, bezpečnost a změny hmotnosti hodnoceny u pacientů léčených exenatidem LAR podávaným jednou týdně oproti exenatidu podávanému dvakrát denně (DURATION-1 a DURATION-5), dále oproti sitagliptinu nebo pioglitazonu (DU-RATION-2) nebo oproti inzulinu glarginu (DURATION-3). Studie DURATION-4 srovnávala exenatid LAR v monoterapii s monoterapií sitagliptinem, pioglitazonem nebo metforminem. Studie DURATION-6 porovnávala podávání exenatidu LAR jednou týdně s liraglutidem podávaným jednou denně.
Výsledky prokázaly výraznější snížení HbA1c při léčbě exenatidem LAR ve srovnání s terapií exenatidem, oproti titrovanému inzulinu glarginu i oproti maximální dávce sitagliptinu nebo pioglitazonu. Léčba exenatidem LAR ve srovnání s exenatidem podávaným dvakrát denně (DURATION-1) vedla k většímu snížení glykemie nalačno a k poklesu hladiny glukagonu. Redukce hmotnosti byla stejná, ale při podání retardované formy byl zaznamenán nižší výskyt nauzey. Tato nová forma exenatidu má dle publikovaných výsledků klinických studií lepší účinky na metabolické parametry než exenatid, její podávání je pro pacienty pohodlnější a je provázeno nižším výskytem nežádoucích účinků [18].
Liraglutid
Liraglutid je druhým schváleným a do klinické praxe uvedeným lékem ze skupiny agonistů GLP-1R (v červnu 2009 schválen EMA a v lednu 2010 FDA). Liraglutid je analog GLP-1, který je z 97 % identický s humánním GLP-1. Byl vytvořen záměnou aminokyselin argininu s lysinem na pozici 34 a přidáním kyseliny glutamové, na kterou je připojen boční řetězec s mastnou kyselinou s 16 C (palmitoyl). Díky této struktuře je liraglutid mnohem odolnější vůči degradaci enzymem DPP-4.
Po aplikaci dochází ke spontánnímu shlukování molekul do heptamerů a molekula se reverzibilně váže na albumin, což také způsobuje prodloužení účinku. Bio-logický poločas eliminace liraglutidu po subkutánním podání je mezi 10–15 hodinami, což umožňuje jeho podávání 1krát denně [19].
Stejně jako GLP-1, liraglutid aktivuje GLP-1R a způsobuje tak po subkutánním podání zvýšení glukózodependentní sekrece inzulinu, což signifikantně snižuje postprandiální glykemii. Publikované výsledky dokládají, že míra snížení glykemie je závislá na podané dávce léčivé látky [20]. U pa-cientů s DM2T, kteří byli léčeni liraglutidem v dávce 6 µg/kg, se prokázala také postprandiálně snížená sekrece glukagonu [20].
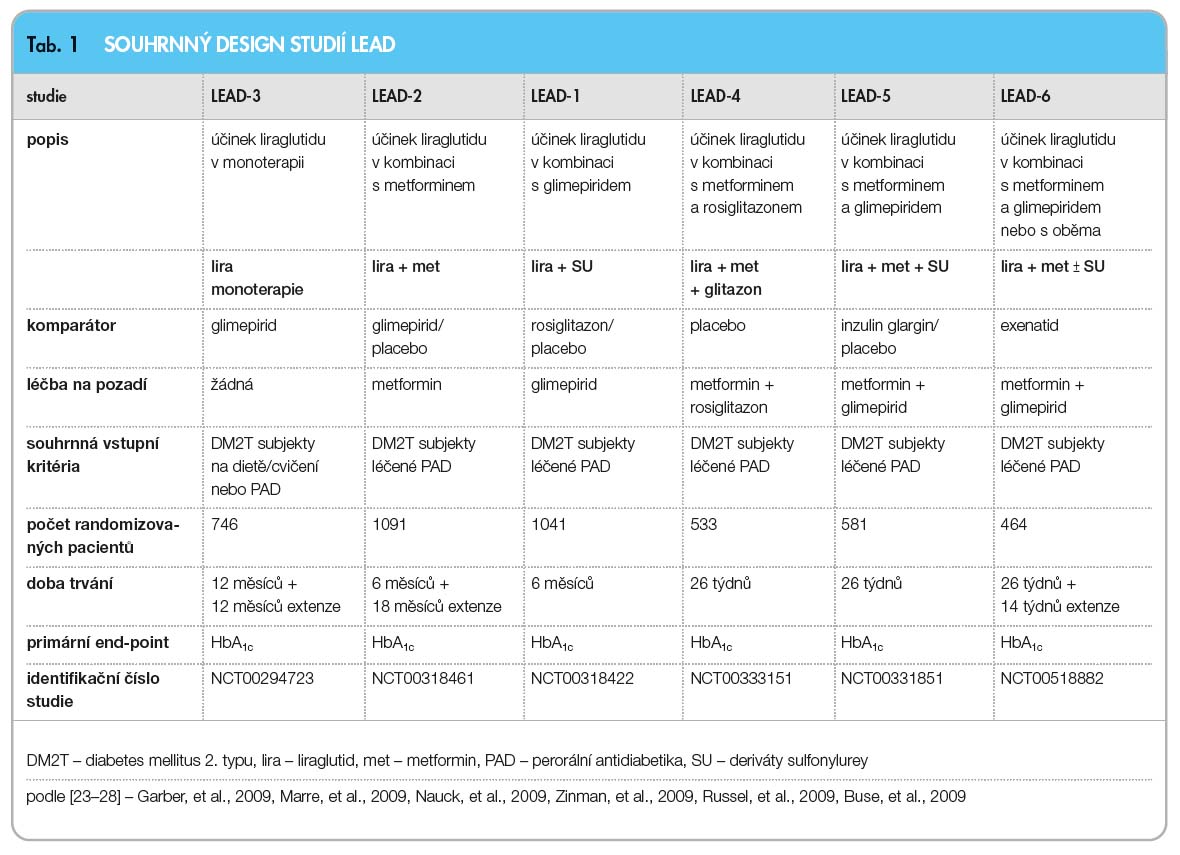 Experimentální studie provedené na zvířatech ukázaly, že liraglutid vede ke zvýšení počtu B-buněk v Langerhansových ostrůvcích a snižuje jejich apoptózu [21]. Po preklinických zkouškách a po potvrzení bezpečnosti a antidiabetického účinku u lidí studiemi fáze II byl uskutečněn projekt klinických studií LEAD (tab. 1).
Experimentální studie provedené na zvířatech ukázaly, že liraglutid vede ke zvýšení počtu B-buněk v Langerhansových ostrůvcích a snižuje jejich apoptózu [21]. Po preklinických zkouškách a po potvrzení bezpečnosti a antidiabetického účinku u lidí studiemi fáze II byl uskutečněn projekt klinických studií LEAD (tab. 1).
Klinický projekt LEAD (Liraglutide Effect and Action in Diabetes) 1–6 zahrnuje komplex studií, které pokrývají kontinuitu péče o pacienty s DM2T. V těchto studiích je liraglutid srovnáván s dosud standardní léčbou metforminem, deriváty sulfonylurey, glitazonem, inzulinem glarginem a exenatidem. Studie se uskutečnily jako kontrolované, dvojitě zaslepené (LEAD 1–5) nebo otevřené (LEAD 6), paralelní, multicentrické a mezinárodní s účastí asi 6500 pacientů ze 41 zemí celého světa, z nichž 4445 bylo léčeno liraglutidem po dobu 26–104 týdnů.
Do studií byli zařazeni pacienti s DM2T, jejichž diabetes byl dosud neuspokojivě kompenzován dietou a cvičením nebo již léčbou jedním nebo více PAD. Při vstupu do přípravné fáze byla proto dle designu studie u některých pacientů léčba již dříve užívaným PAD ukončena a nahrazena liraglutidem. V průběhu všech studií byl liraglutid podáván jednou denně s postupnou titrací dávky po týdnu, a to od 0,6 mg denně do 1,8 mg denně dle randomizace pacienta.
![Snížení hladiny HbA1c po přidání liraglutidu do léčby; podle [23–28] – Garber, et al., 2009, Marre, et al., 2009, Nauck, et al., 2009, Zinman, et al., 2009, Russel, et al., 2009, Buse, et al., 2009.](https://www.remedia.cz/photo-a-28806---.jpg) Ve studii LEAD-1 a LEAD-2 byl liraglutid podáván v dávce 0,6 mg, 1,2 mg a 1,8 mg, ve studii LEAD-3 a LEAD-4 byl podáván v dávkách 1,2 mg a 1,8 mg, ve studiích LEAD-5 a LEAD-6 pak byla použita pouze dávka 1,8 mg/den [22]. Z výsledků studií vyplývá, že přidání lira-glutidu do léčby DMT2 vede k podstat-nému a trvalému poklesu hladin HbA1c, který byl stanoven jako primární cíl k vyhodnocení účinnosti léčby (graf 4).
Ve studii LEAD-1 a LEAD-2 byl liraglutid podáván v dávce 0,6 mg, 1,2 mg a 1,8 mg, ve studii LEAD-3 a LEAD-4 byl podáván v dávkách 1,2 mg a 1,8 mg, ve studiích LEAD-5 a LEAD-6 pak byla použita pouze dávka 1,8 mg/den [22]. Z výsledků studií vyplývá, že přidání lira-glutidu do léčby DMT2 vede k podstat-nému a trvalému poklesu hladin HbA1c, který byl stanoven jako primární cíl k vyhodnocení účinnosti léčby (graf 4).
Studie LEAD-1 prokázala vyšší účinnost kombinace liraglutid–glimepirid (lék ze skupiny derivátů sulfonylurey) ve srovnání s kombinací rosiglitazon (lék ze skupiny glitazonů) a glimepirid [24].
Ve studii LEAD-2 se snížení HbA1c dávkou 1,2 mg a 1,8 mg liraglutidu přidaného k metforminu nelišilo od výsledků léčby kombinací glimepirid–metformin [25].
Ve studii LEAD-3 byla monoterapie liraglutidem v dávce 1,2 a 1,8 mg účinnější než podání 8 mg glimepiridu [23].
Studie LEAD-4 prokázala signifikantní zlepšení kompenzace DM2T po přidání liraglutidu do kombinace s metforminem a rosiglitazonem. Tato kombinace léků nevedla ke vzestupu tělesné hmotnosti, který je obvyklý při léčbě glitazonem [26].
26 týdnů trvala studie LEAD-5, ve které prokázal liraglutid v kombinaci s metforminem a glimepiridem non-inferioritu dle poklesu HbA1c oproti kombinaci těchto antidiabetik s inzulinem glarginem (průměr-ná dávka 24 IU/den). Léčba liraglutidem vedla oproti léčbě inzulinem glarginem k poklesu tělesné hmotnosti (rozdíl 3,5 kg) [27].
V přímém srovnání s exenatidem ve studii LEAD-6 pak byl zjištěn při podání dávky liraglutidu 1,8 mg vyšší účinek na hladinu HbA1c [28].
Z výsledků provedené metaanalýzy dat všech 6 studií LEAD po 26 týdnech léčby vyplývá, že 42 % pacientů léčených dávkou 1,8 mg liraglutidu a 35 % léčených dávkou 1,2 mg dosáhlo stanoveného kombinovaného výsledku – poklesu HbA1c na méně než 7 % (DCCT, tj. 5,3 % IFCC) bez závažné nebo nezávažné hypoglykemie a bez vzestupu hmotnosti ve srovnání s 6–15 % těch pacientů, kteří byli léčeni komparátory ze skupin PAD [29]. Pokles hmotnosti od počátku léčby byl v programu LEAD zaznamenán u 76 % pacientů léčených liraglutidem, u téměř 25 % pacientů došlo k redukci hmotnosti o více než 5 % [30].
V metaanalýze byl vyhodnocen vztah mezi poklesem HbA1c a hodnotou C-peptidu při léčbě liraglutidem a glimepiridem. Nejvyšší pokles HbA1c při léčbě liraglutidem byl dokumentován u pacientů s nejvyšší hladinou C-peptidu na počátku studie, což může implikovat větší klinický přínos, je-li léčba liraglutidem započata včas [31].
Léčba byla spojena s nízkou incidencí hypoglykemií. V případě monoterapie nebyla zaznamenána žádná závažná hypo-glykemie. Velmi nízké riziko vzniku hypoglykemie provází podávání kombinace s metforminem. Ve studiích se prokázalo zvýšené riziko hypoglykemií při léčbě kombinací liraglutidu s glimepiridem (0,02 události/pa- cient/rok), což potvrzují i výsledky léčby kombinací exenatid–derivát sulfonylurey. Příčinou může být rozpojení na glukóze závislé sekrece inzulinu stimulované GLP-1 v přítomnosti derivátu sulfonylurey [29].
Nežádoucí účinky
Nejčastěji byly ve studiích s oběma analogy zaznamenány nežádoucí gastrointestinální účinky, a to nauzea a průjem. Nauzea byla přechodná a byl zaznamenán trend ke snížení výskytu tohoto příznaku v průběhu prvních týdnů léčby, výskyt nevolnosti byl při léčbě liraglutidem nižší oproti léčbě exenatidem. Tyto nežádoucí účinky nevedou ve velké většině případů k nutnosti ukončit léčbu – například v projektu LEAD odstoupilo pro tyto potíže ze studie pouze 2,8 % pacientů [29].
Zařazení do algoritmu léčby DM2T
Léčba založená na inkretinech, která zahrnuje podávání agonistů GLP-1R a inhibitorů DPP-4, představuje nový terapeutický přístup k pacientům s DM2T. Tyto léky jsou nadějné proto, že jejich účinek je založen na fyziologickém působení. Jak prokázaly dosavadní výsledky studií, agonisté GLP-1R zlepšují kompenzaci diabetu, léčba je zatížena minimálním rizikem hypo-glykemie, snižují hmotnost, mají pravděpodobně kardioprotektivní a neuroprotektivní účinky a patrně chrání B-buňky. Vlastním mechanismem účinku je zlepšení sekrece inzulinu prostřednictvím zvýšené koncentrace GLP-1, proto jsou účinnější u pacientů, u nichž onemocnění diabetem trvá krátkou dobu, neboť je známo, že sekreční potenciál s délkou trvání DMT2 ubývá [32].
Výhodou léčby agonisty GLP-1R je možnost kombinační terapie s jinými PAD.
Podávání exenatidu je dle SPC indikováno ke kombinační léčbě DM2T dospělých osob, u kterých není dosaženo dostatečné kontroly glykemie při podávání maximálních tolerovaných dávek perorálních přípravků – do kombinace s metforminem, s deriváty sulfonylurey nebo s glitazony [33].
Výsledky klinické studie z roku 2011 potvrdily příznivý efekt kombinace léčby inzulinem glarginem a exenatidem, který se projevil jak poklesem HbA1c, tak redukcí hmotnosti. Silnou stránkou léčby glarginem je úprava glykemie nalačno, zatímco předností exenatidu je úprava postpran-diální glykemie a snížení hmotnosti pacientů [34]. Lze očekávat, že i tato léčba bude v Evropě v dohledné době povolena.
Liraglutid je dle SPC určen pro léčbu dospělých s DM2T v kombinaci s metforminem nebo s deriváty sulfonylurey a dále pak v kombinaci s metforminem a derivátem sulfonylurey nebo s metforminem a glitazonem u pacientů se špatnou kompenzací navzdory kombinované léčbě těmito léky [35].
Na kongresu EASD (European Associa-tion for the Study of Diabetes) v roce 2011 byla prezentována randomizovaná studie, v níž byl pacientům neúspěšně kompenzovaným léčbou kombinací metformin–lira-glutid podán inzulin detemir a titrován k dosažení hodnoty HbA1c < 7,0 % (DCTT). Po 26 týdnech léčby se koncentrace
HbA1c snížila o 0,5 % oproti kontrolní skupině bez detemiru; 43 % pacientů dosáhlo hodnoty HbA1c < 7,0 % (DCTT), hmotnost se snížila v obou skupinách (tedy i po přidání detemiru) a ve všech skupinách byl zaznamenán nízký počet hypoglykemií. Tato léčebná kombinace již byla povolena v zemích EU [36].
Doporučené postupy léčby DM2T jsou odvozeny od nových patogenetických poznatků i závěrů velkých klinických studií. Konsenzus ADA/EASD (American Diabetes Association/European Association for the Study of Diabetes) zařazuje léčbu inkretiny do 2. linie – mezi léky, které mají menší počet klinicky ověřených dat, protože jsou v léčbě používány kratší dobu. Dle tohoto algoritmu zaujímají agonisté GLP-1R své místo v přidání do kombinace v kroku 2, pokud selže léčba kroku prvního, kterým je podání metforminu. Tento postup má být preferován, pokud by hypoglykemie a také nárůst hmotnosti byly pro pacienta rizikové [37].
![Snížení hladiny HbA1c po přidání liraglutidu do léčby; podle [23–28] – Garber, et al., 2009, Marre, et al., 2009, Nauck, et al., 2009, Zinman, et al., 2009, Russel, et al., 2009, Buse, et al., 2009.](https://www.remedia.cz/photo-a-28807---.jpg) Doporučení České diabetologické společnosti (ČDS) vycházejí z doporučení ADA/EASD [5]. Do těchto doporučení jsou již včleněny moderní aspekty terapie, a to že léčba musí být zahájena včas již při zjištění diagnózy DM2T, u všech pacientů; a pokud není dosaženo dobré kompenzace prvním krokem, tedy úpravou životního stylu a podáváním metforminu, je indikována kombinační terapie metforminem i s novými antidiabetiky (agonisty GLP-1R, respektive gliptiny), obr. 1.
Doporučení České diabetologické společnosti (ČDS) vycházejí z doporučení ADA/EASD [5]. Do těchto doporučení jsou již včleněny moderní aspekty terapie, a to že léčba musí být zahájena včas již při zjištění diagnózy DM2T, u všech pacientů; a pokud není dosaženo dobré kompenzace prvním krokem, tedy úpravou životního stylu a podáváním metforminu, je indikována kombinační terapie metforminem i s novými antidiabetiky (agonisty GLP-1R, respektive gliptiny), obr. 1.
Pro jednoznačný sled kombinační léčby není zatím dost důkazů [32]. I přes velmi nadějné výsledky dosavadních studií je jisté, že o postavení agonistů GLP-1R v algoritmu léčby DM2T rozhodnou studie zaměřené na vliv této léčby na kardiovas-kulární komplikace a bezpečnost. V současné době probíhají dvě velké klinické studie: LEADER s liraglutidem (Liraglutide Effect and Action in Diabetes Evaluation of Cardiovascular Outcome Results), s předpokládaným vyhodnocením v roce 2016, a studie EXSCEL s exenatidem LAR (Exenatide Study of Cardiovascular Event Lowering), jejíž vyhodnocení se předpokládá v roce 2017.
V současné době se zdá, že agonisté GLP-1R jsou účinnými a bezpečnými léky s výhodnou kombinací hypoglykemizujícího účinku s účinkem na pokles hmotnosti a na ochranu B-buněk pankreatu. Ale teprve dlouhodobé studie a klinická praxe ukáží, zda se tyto poznatky potvrdí a zda pak můžeme očekávat zásadní změny v léčebném algoritmu DM2T.
Seznam použité literatury
- [1] International Diabetes Federation. IDF diabetes atlas, 4th edition 2009.
- [2] DeFronzo RA. Current issues in the treatment
- [3] Doporučený postup péče o diabetes mellitus
- [4] Nauck MA, Stockmann F, Bert R, Creutzfeld W. Reduced incretin effect in type 2 (non-insulin dependent) diabetes. Diabetologia 1986; 29: 46–52.
- [5] Haluzík M, Svačina Š. Inkretinová léčba diabetu, Praha Mladá fronta 2010, 136 s.
- [6] Williams DL. Minireview: Finding the sweet spot: peripheral versus central glucagon-like pepti-
- [7] Nikolaidis LA, Elahi D, Hentosz T, et al. Recombinant glucagon-like peptide-1 increases myocardial glucose uptake and improves left ventricular performance in consious dogs with pacing induced dilated cardiomyopathy. Circulation 2004; 110: 955–961.
- [8] Drucker DJ. Dipeptidyl peptidase-4 inhibition and the treatment of type 2 diabetes: preclinical biology and mechanisms of action. Diabetes Care 2007; 30: 1335–1343.
- [9] Haluzík M. Glukagonu podobný peptid 1 a jeho význam pro současnou diabetologii. Remedia 2011; 21: 20–25.
- [10] Perušičová J. Exenatid. Remedia 2008; Supl 1: S18–S23.
- [11] Moretto TJ, Milton DR, Ridge TD, et al. Efficacy and tolerability of exenatide monotherapy over 24 weeks in antidiabetic drug-naive patients with type 2 diabetes: a randomised, double-blind, placebo-controlled, paralell-group study. Clin Ther 2008; 30: 1448–1460.
- [12] DeFronzo RA, Rafner RE, Han J, et al. Effects of exenatide on glycemic control and weight over 30 weeks in metformin treated patients with type 2 diabetes. Diabetes Care 2005; 28: 1092–1100.
- [13] Buse JB, Henry RR, Han J, et al for the Exenatide-113 Clinical Study Group. Effects of exenatide on glycemic control over 30 weeks in sulpho-nylurea-treated patients with type 2 diabetes. Diabetes Care 2004; 27: 2628–2635.
- [14] Kendall DM, Riedle MC, Rosenstock J, et al. Effects of exenatide on glycemic control over 30 weeks in patients with type 2 diabetes treated with metformin and sulphonylurea. Diabetes Care 2005; 28: 1083–1091.
- [15] Klonoff DC, Buse JB, Nielsen LL, et al. Exenatide effects on diabetes, obesity, cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for at least 3 years. Curr Med Res Opin 2008; 24: 275–286.
- [16] Zinman B, Hoogwert BJ, Duran Garcia S, et al. The effect of adding exenatid to a thiazolidine-dione in suboptimally controlled type 2 diabe-tes: a randomized trial. Ann Intern Med 2007; 146: 477–485.
- [17] Heine RJ, VanGall LF, Johns D, et al. Exenatide versus insulin glargine in patients with suboptimally controlled type 2 diabetes: a randomized trial. Ann Intern Med 2005; 143: 559–569.
- [18] Stonehouse A, Walsh B, Cudihy R. Exenatide once-weekly clinical development: safety and efficacy across a range of backgroung therapies. Diabetes Technol Ther 2011; 13: 1063.
- [19] Liraglutide, Scientific Synopsis, Novo Nordisk 2010.
- [20] Degn KB, Juhl CB, Sturis J, et al. One week’s
- [21] Sturis J, Gotfredsen CF, Romer J, et al. GLP-1 derivate liraglutide in rats with beta-cell deficiencies: influence of metabolic state on beta-cell mass dynamics. Br J Pharmacol 2003; 140: 123-132.
- [22] Kvapil M. Diabetologie 2010. Triton, Praha 2010: 102–109.
- [23] Garber A, Henry R, Ratner R, et al. Liraglutide versus glimepiride monotherapy for type 2 diabetes (LEAD-3 Mono): randomised, 52-week, phase III, double-blind parallel-treatment trial. Lancet 2009; 373: 473–481.
- [24] Marre M, Shaw J, Brandle M, et al. Liraglutide, a once daily human GLP-1 analogue, added to a sulphonylurea over 26 weeks produces greater improvements in glycaemic and weight control compared with adding rosiglitazone or placebo in subjects with type 2 diabetes (LEAD-1SU). Diabet Med 2009; 26: 268–278.
- [25] Nauck MA, Frid A, Hermansen K, et al. Efficacy and safety comparison of liraglutide, glimepiride, and placebo, all in combination with metformin in type 2 diabetes. Diabetes Care 2009; 32: 84–90.
- [26] Zinman B, Gerich J, Buse J, et al. Efficacy and safety of the human GLP-1 analogue liraglutide in combination with metformin and TZD in patients with type 2 diabetes mellitus (LEAD–4 met+TZD). Diabetes Care 2009; 32: 1224–1237.
- [27] Russell-Jones D, Vaag A, Schmitz O, et al. Lira-glutide vs insulin glargine and placebo in combination with metformin and sulphonylurea therapy in type 2 diabetes mellitus: a randomised controlled trial (LEAD–5 met+SU). Diabetologia 2009; 52: 4026–4055.
- [28] Buse JB, Rosenstock J, Sesti G, et al. A study of two glucagon-like peptide-1 receptor agonists for the treatment of type 2 diabetes: liragluti-
- [29] Blonde L, Russell-Jones D. The safety and efficacy of liraglutide with or without oral antidiabetic drug therapy in type 2 diabetes: an overview of the LEAD 1–5 studies. Diab Obes Metab 2009; 11: 26–34.
- [30] Jendle J, Nauck MA, Matthews D, et al. Weight loss with liraglutide, a once-daily human GLP-1 analogue for type 2 diabetes treatment, is primarily due to a reduction in fat tissue (Abstract 797). Diabetologia 2008; 51: S318.
- [31] Matthews D, Marre M, Lle Thi TD, et al. Liraglutide, a human GLP-1 analogue, significantly improves beta-cell function subjects with type 2 diabetes (Abstract 891). Diabetologia 2008; 51: S356.
- [32] Rybka J. Patofyziologie mění algoritmy terapie diabetu 2. typu. Inter Med Prax 2011; 13: B37-B47.
- [33] SPC Byetta – dostupné na www.emea.europa.eu, citováno 25. 2. 2012.
- [34] Buse JB, Bergenstahl MR, Glass L, et al. Use of twice-daily exenatide in basal insulin-treated pa-tients with type 2 diabetes. Ann Intern Med 2011; 154: 103–112.
- [35] SPC Victoza – dostupné na www.emea.europa.eu, citováno 25. 2. 2012.
- [36] Bain SC, De Vries JH, Seufert J, et al. Ading insulin detemir to liraglutide and metformin compared to liraglutide and metformin in subjects with type 2 diabetes. Diabetologia 2011; 54: S37.
- [37] Nathan DM, Buse JB, Davidson MB, et al. American Diabetes Association, European Associa-tion for Study of Diabetes. Medical magement